八年级科学暑托作业10(质量守恒定律)(含答案)
文档属性
| 名称 | 八年级科学暑托作业10(质量守恒定律)(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-07-18 23:46:51 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
八年级科学暑假作业10
(质量守恒定律)
一、选择题
1.实验室用稀硫酸和亚硫酸钠反应制取二氧化硫气体,反应的化学方程式为:
Na2SO3+H2SO4=SO2↑+Na2SO4+X,则X的化学式为( )
A.H2S B.H2O C.H2 D.O2
2.a克木炭在b克氧气中完全燃烧,生成二氧化碳的质量是( )
A.大于(a+b)g B.等于(a+b)g C.小于或等于(a+b)g D.小于(a+b)g
3.关于化学方程式4P+5O22P2O5的理解,正确的是( )
A.反应前后分子总数保持不变
B.该反应的反应物是五氧化二磷
C.每四份质量的磷和五份质量的氧气完全反应
D.在点燃的条件下,磷和氧气反应生成五氧化二磷
4.能够直接用于验证质量守恒定律的实验是( )
A. B. C. D.
5.“绿色化学”的特点之一是“零排放”。在一定条件下,二氧化碳和氢气可以按照不同比
例反应,生成下列有机物,其中二氧化碳和氢气反应,只生成一种产物就能实现“零排
放”,该产物化学式是( )
A.CH4O B.CH2O2 C.C2H6O D.C2H4O2
6.下列有关“守恒”的叙述中,正确的是( )
A.镁带在空气中燃烧后,生成物的质量跟原镁带的质量相等
B.在反应3Cu+8HNO3=3Cu(NO3)2+2X↑+4H2O中,X的化学式是NO2
C.加热24.5gKClO3和4gMnO2的混合物,反应一段时间后,剩余固体24.9g,则生成O2的质量为3.6g
D.某纯净物在氧气中燃烧后生成CO2, SO2, CO,该物质中一定含有C,S,O元素
7.[2023·舟山]实验室中常用分解过氧化氢的方法来制取氧气,其反应微观模型如图。由该模型可知( )
A.过氧化氢的化学式为H2O2
B.水由氢原子和氧原子直接构成
C.反应前后的原子数目发生改变
D.生成的水分子和氧分子数目比为1:2
8.A、B、C三种物质各15g,它们化合时只能生成30g新物质D。若增加10gA,则反应停止后,原反应物中只剩余C。根据上述条件推断,下列说法正确的是( )
A.第一次反应停止后,B剩余9g B.第二次反应后,D的质量为60g
C.反应中A和B的质量比是3:2 D.反应中A和C的质量比是5:2
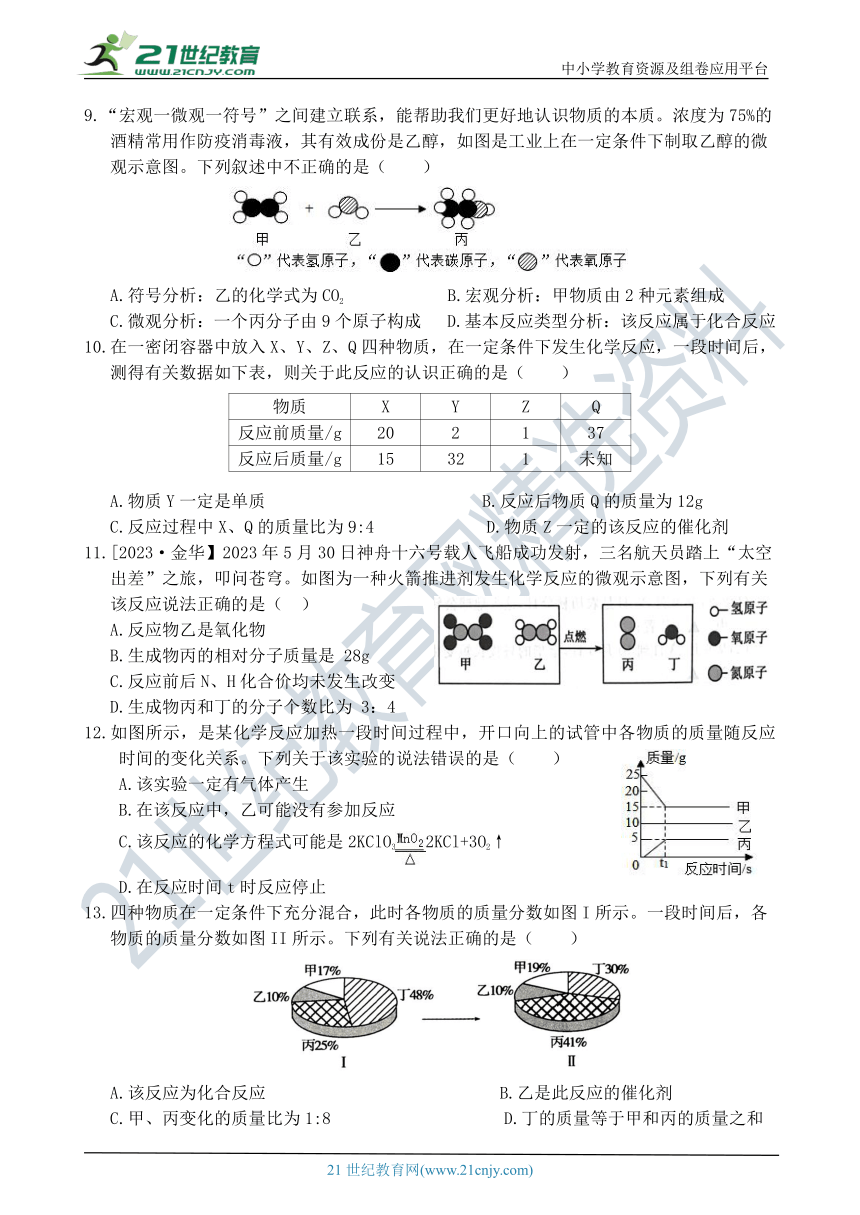
9.“宏观一微观一符号”之间建立联系,能帮助我们更好地认识物质的本质。浓度为75%的
酒精常用作防疫消毒液,其有效成份是乙醇,如图是工业上在一定条件下制取乙醇的微
观示意图。下列叙述中不正确的是( )
A.符号分析:乙的化学式为CO2 B.宏观分析:甲物质由2种元素组成
C.微观分析:一个丙分子由9个原子构成 D.基本反应类型分析:该反应属于化合反应
10.在一密闭容器中放入X、Y、Z、Q四种物质,在一定条件下发生化学反应,一段时间后,
测得有关数据如下表,则关于此反应的认识正确的是( )
物质 X Y Z Q
反应前质量/g 20 2 1 37
反应后质量/g 15 32 1 未知
A.物质Y一定是单质 B.反应后物质Q的质量为12g
C.反应过程中X、Q的质量比为9:4 D.物质Z一定的该反应的催化剂
11.[2023·金华】2023年5月30日神舟十六号载人飞船成功发射,三名航天员踏上“太空
出差”之旅,叩问苍穹。如图为一种火箭推进剂发生化学反应的微观示意图,下列有关
该反应说法正确的是( )
A.反应物乙是氧化物
B.生成物丙的相对分子质量是 28g
C.反应前后N、H化合价均未发生改变
D.生成物丙和丁的分子个数比为 3:4
12.如图所示,是某化学反应加热一段时间过程中,开口向上的试管中各物质的质量随反应时间的变化关系。下列关于该实验的说法错误的是( )
A.该实验一定有气体产生
B.在该反应中,乙可能没有参加反应
C.该反应的化学方程式可能是2KClO32KCl+3O2↑
D.在反应时间t时反应停止
13.四种物质在一定条件下充分混合,此时各物质的质量分数如图I所示。一段时间后,各物质的质量分数如图II所示。下列有关说法正确的是( )
A.该反应为化合反应 B.乙是此反应的催化剂
C.甲、丙变化的质量比为1:8 D.丁的质量等于甲和丙的质量之和
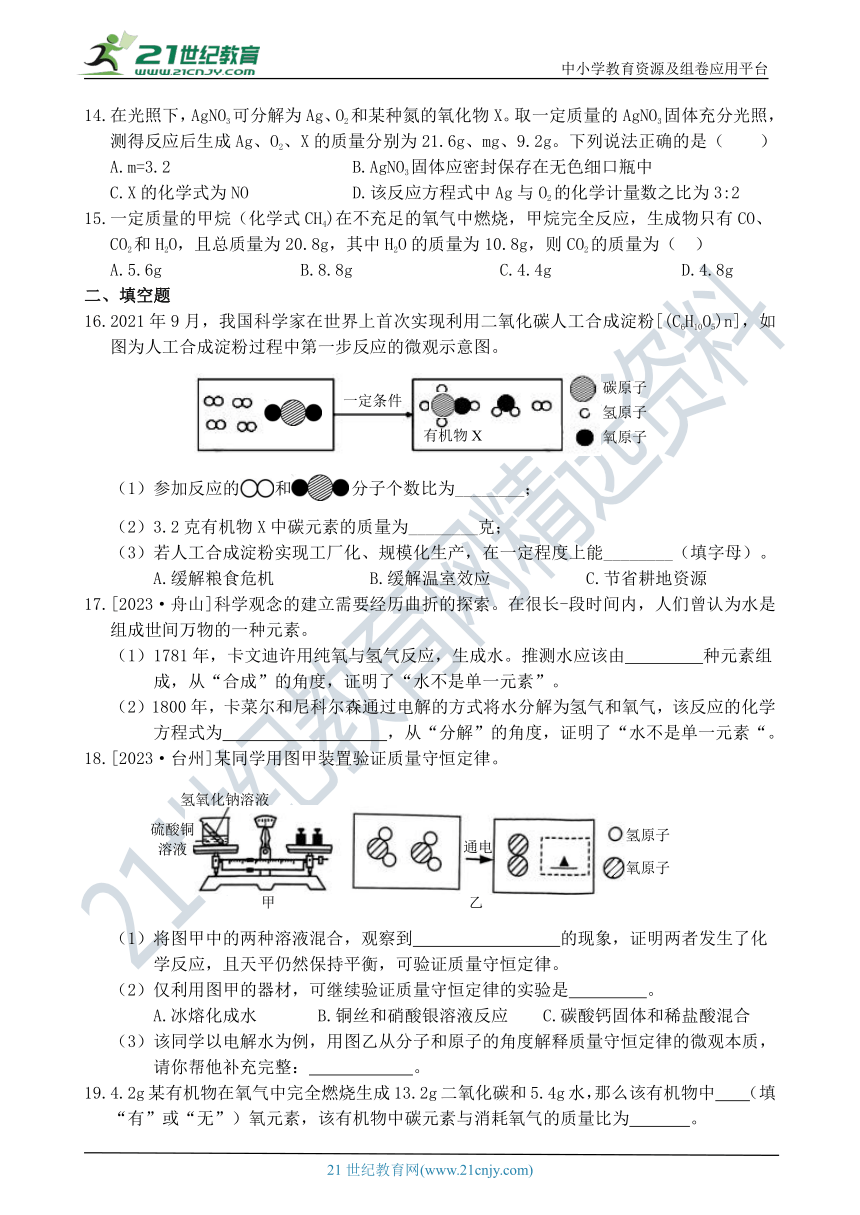
14.在光照下,AgNO3可分解为Ag、O2和某种氮的氧化物X。取一定质量的AgNO3固体充分光照,测得反应后生成Ag、O2、X的质量分别为21.6g、mg、9.2g。下列说法正确的是( )
A.m=3.2 B.AgNO3固体应密封保存在无色细口瓶中
C.X的化学式为NO D.该反应方程式中Ag与O2的化学计量数之比为3:2
15.一定质量的甲烷(化学式CH4)在不充足的氧气中燃烧,甲烷完全反应,生成物只有CO、
CO2和H2O,且总质量为20.8g,其中H2O的质量为10.8g,则CO2的质量为( )
A.5.6g B.8.8g C.4.4g D.4.8g
二、填空题
16.2021年9月,我国科学家在世界上首次实现利用二氧化碳人工合成淀粉[(C6H10O5)n],如图为人工合成淀粉过程中第一步反应的微观示意图。
(1)参加反应的和分子个数比为________;
(2)3.2克有机物X中碳元素的质量为________克;
(3)若人工合成淀粉实现工厂化、规模化生产,在一定程度上能________(填字母)。
A.缓解粮食危机 B.缓解温室效应 C.节省耕地资源
17.[2023·舟山]科学观念的建立需要经历曲折的探索。在很长-段时间内,人们曾认为水是
组成世间万物的一种元素。
(1)1781年,卡文迪许用纯氧与氢气反应,生成水。推测水应该由 种元素组
成,从“合成”的角度,证明了“水不是单一元素”。
(2)1800年,卡菜尔和尼科尔森通过电解的方式将水分解为氢气和氧气,该反应的化学
方程式为 ,从“分解”的角度,证明了“水不是单一元素“。
18.[2023·台州]某同学用图甲装置验证质量守恒定律。
(1)将图甲中的两种溶液混合,观察到 的现象,证明两者发生了化
学反应,且天平仍然保持平衡,可验证质量守恒定律。
(2)仅利用图甲的器材,可继续验证质量守恒定律的实验是 。
A.冰熔化成水 B.铜丝和硝酸银溶液反应 C.碳酸钙固体和稀盐酸混合
(3)该同学以电解水为例,用图乙从分子和原子的角度解释质量守恒定律的微观本质,
请你帮他补充完整: 。
19.4.2g某有机物在氧气中完全燃烧生成13.2g二氧化碳和5.4g水,那么该有机物中 (填“有”或“无”)氧元素,该有机物中碳元素与消耗氧气的质量比为 。
三、实验探究题
20.以下是俄国化学家罗蒙诺索夫曾开展的实验:
①先用天平称取质量为m1的金属锡粉。
②将这些锡粉放在密闭容器里进行完全燃烧,生成了白色固体物质,称量容器的总质量
为m2。
③打开容器,听到了空气进入容器发出的“丝丝的声响”,称量所得白色物质的质量
为m3。。
④把白色物质放回原容器里(容器中空气的组成恢复到初始状态),重新称量容器的总
质量为m4。
(1)根据所学知识判断,锡的燃烧是 变化。
(2)罗蒙诺索夫分析数据后发现,生成白色物质的质量m3= ,于是提出了“参加
反应的物质的总质量,等于反应后产物的总质量”的观点。
(3)请从微观角度解释质量守恒定律: 。
21.[2022 嘉兴(舟山)]小舟选用白磷、锥形瓶、气球、天平等药品和器材,探究化学反应中物质质量的变化规律,装置如图。
【实验思路】先确认化学反应已经发生,再比较反应物的质量总和和生成物的质量总和是否相等。
【实验步骤】
I.锥形瓶内装入白磷,塞紧瓶塞放在天平托盘上,调节平衡;
II.取下锥形瓶,将瓶塞上的铁丝在酒精灯上烧红后,接触引燃白磷,并立即塞紧瓶塞;
III.待反应结束冷却后,将锥形瓶放回天平托盘上,观察________。
【实验结论】参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
【交流反思】
(1)要确认化学反应已经发生,本实验中观察到的现象是________。
(2)反应结束后。若白磷有剩余,你认为是否仍能得出上述结论,并请说明理由。________。
四、解答题
22.[2022 温州]图甲是一款潜水艇紧急供氧设备的结构示意图,产氧药块主要成分是氯酸钠,需要镁粉氧化放热启动并维持反应进行,快速产生氧气。
(1)启动时,镁粉(Mg)与氧气反应生成氧化镁(MgO)。其化学方程式为:________。
(2)产氧药块反应会产生极少量有毒的氯气,推测图甲中试剂X应具有的性质是________。
(3)氯酸钠受热分解生成氯化钠和氧气。m克氯酸钠分解过程中各物质质量变化如图乙
所示,选择a、b、c、d、m中的部分数据,列出它们的等式关系以体现质量守恒定
律。 。
参考答案
一、选择题
1.B 2.C 3.D 4.B 5.B 6.D 7.A 8.D 9.A 10.B 11.D 12.C 13.C 14.D 15.C
二、填空题
16.(1)3:1 (2)1.2 (3)ABC
17.(1)两
(2)
18.(1)蓝色絮状沉淀(2)B(3)
19.没有 1:4
三、实验探究题
20.(1)化学 (2) m4﹣ m2+m1 (3)反应前后原子的种类不变,总个数不变,
21.【实验步骤】天平是否平衡
【交流反思】(1)白磷燃烧,产生大量白烟
(2)能,剩余白磷未参加反应,反应前后质量不变
四、解答题
22.(1)2Mg+O22MgO(2)吸收氯气,但不吸收氧气
(3)a+d=b+c(或a+d=m、b+c=m)
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
八年级科学暑假作业10
(质量守恒定律)
一、选择题
1.实验室用稀硫酸和亚硫酸钠反应制取二氧化硫气体,反应的化学方程式为:
Na2SO3+H2SO4=SO2↑+Na2SO4+X,则X的化学式为( )
A.H2S B.H2O C.H2 D.O2
2.a克木炭在b克氧气中完全燃烧,生成二氧化碳的质量是( )
A.大于(a+b)g B.等于(a+b)g C.小于或等于(a+b)g D.小于(a+b)g
3.关于化学方程式4P+5O22P2O5的理解,正确的是( )
A.反应前后分子总数保持不变
B.该反应的反应物是五氧化二磷
C.每四份质量的磷和五份质量的氧气完全反应
D.在点燃的条件下,磷和氧气反应生成五氧化二磷
4.能够直接用于验证质量守恒定律的实验是( )
A. B. C. D.
5.“绿色化学”的特点之一是“零排放”。在一定条件下,二氧化碳和氢气可以按照不同比
例反应,生成下列有机物,其中二氧化碳和氢气反应,只生成一种产物就能实现“零排
放”,该产物化学式是( )
A.CH4O B.CH2O2 C.C2H6O D.C2H4O2
6.下列有关“守恒”的叙述中,正确的是( )
A.镁带在空气中燃烧后,生成物的质量跟原镁带的质量相等
B.在反应3Cu+8HNO3=3Cu(NO3)2+2X↑+4H2O中,X的化学式是NO2
C.加热24.5gKClO3和4gMnO2的混合物,反应一段时间后,剩余固体24.9g,则生成O2的质量为3.6g
D.某纯净物在氧气中燃烧后生成CO2, SO2, CO,该物质中一定含有C,S,O元素
7.[2023·舟山]实验室中常用分解过氧化氢的方法来制取氧气,其反应微观模型如图。由该模型可知( )
A.过氧化氢的化学式为H2O2
B.水由氢原子和氧原子直接构成
C.反应前后的原子数目发生改变
D.生成的水分子和氧分子数目比为1:2
8.A、B、C三种物质各15g,它们化合时只能生成30g新物质D。若增加10gA,则反应停止后,原反应物中只剩余C。根据上述条件推断,下列说法正确的是( )
A.第一次反应停止后,B剩余9g B.第二次反应后,D的质量为60g
C.反应中A和B的质量比是3:2 D.反应中A和C的质量比是5:2
9.“宏观一微观一符号”之间建立联系,能帮助我们更好地认识物质的本质。浓度为75%的
酒精常用作防疫消毒液,其有效成份是乙醇,如图是工业上在一定条件下制取乙醇的微
观示意图。下列叙述中不正确的是( )
A.符号分析:乙的化学式为CO2 B.宏观分析:甲物质由2种元素组成
C.微观分析:一个丙分子由9个原子构成 D.基本反应类型分析:该反应属于化合反应
10.在一密闭容器中放入X、Y、Z、Q四种物质,在一定条件下发生化学反应,一段时间后,
测得有关数据如下表,则关于此反应的认识正确的是( )
物质 X Y Z Q
反应前质量/g 20 2 1 37
反应后质量/g 15 32 1 未知
A.物质Y一定是单质 B.反应后物质Q的质量为12g
C.反应过程中X、Q的质量比为9:4 D.物质Z一定的该反应的催化剂
11.[2023·金华】2023年5月30日神舟十六号载人飞船成功发射,三名航天员踏上“太空
出差”之旅,叩问苍穹。如图为一种火箭推进剂发生化学反应的微观示意图,下列有关
该反应说法正确的是( )
A.反应物乙是氧化物
B.生成物丙的相对分子质量是 28g
C.反应前后N、H化合价均未发生改变
D.生成物丙和丁的分子个数比为 3:4
12.如图所示,是某化学反应加热一段时间过程中,开口向上的试管中各物质的质量随反应时间的变化关系。下列关于该实验的说法错误的是( )
A.该实验一定有气体产生
B.在该反应中,乙可能没有参加反应
C.该反应的化学方程式可能是2KClO32KCl+3O2↑
D.在反应时间t时反应停止
13.四种物质在一定条件下充分混合,此时各物质的质量分数如图I所示。一段时间后,各物质的质量分数如图II所示。下列有关说法正确的是( )
A.该反应为化合反应 B.乙是此反应的催化剂
C.甲、丙变化的质量比为1:8 D.丁的质量等于甲和丙的质量之和
14.在光照下,AgNO3可分解为Ag、O2和某种氮的氧化物X。取一定质量的AgNO3固体充分光照,测得反应后生成Ag、O2、X的质量分别为21.6g、mg、9.2g。下列说法正确的是( )
A.m=3.2 B.AgNO3固体应密封保存在无色细口瓶中
C.X的化学式为NO D.该反应方程式中Ag与O2的化学计量数之比为3:2
15.一定质量的甲烷(化学式CH4)在不充足的氧气中燃烧,甲烷完全反应,生成物只有CO、
CO2和H2O,且总质量为20.8g,其中H2O的质量为10.8g,则CO2的质量为( )
A.5.6g B.8.8g C.4.4g D.4.8g
二、填空题
16.2021年9月,我国科学家在世界上首次实现利用二氧化碳人工合成淀粉[(C6H10O5)n],如图为人工合成淀粉过程中第一步反应的微观示意图。
(1)参加反应的和分子个数比为________;
(2)3.2克有机物X中碳元素的质量为________克;
(3)若人工合成淀粉实现工厂化、规模化生产,在一定程度上能________(填字母)。
A.缓解粮食危机 B.缓解温室效应 C.节省耕地资源
17.[2023·舟山]科学观念的建立需要经历曲折的探索。在很长-段时间内,人们曾认为水是
组成世间万物的一种元素。
(1)1781年,卡文迪许用纯氧与氢气反应,生成水。推测水应该由 种元素组
成,从“合成”的角度,证明了“水不是单一元素”。
(2)1800年,卡菜尔和尼科尔森通过电解的方式将水分解为氢气和氧气,该反应的化学
方程式为 ,从“分解”的角度,证明了“水不是单一元素“。
18.[2023·台州]某同学用图甲装置验证质量守恒定律。
(1)将图甲中的两种溶液混合,观察到 的现象,证明两者发生了化
学反应,且天平仍然保持平衡,可验证质量守恒定律。
(2)仅利用图甲的器材,可继续验证质量守恒定律的实验是 。
A.冰熔化成水 B.铜丝和硝酸银溶液反应 C.碳酸钙固体和稀盐酸混合
(3)该同学以电解水为例,用图乙从分子和原子的角度解释质量守恒定律的微观本质,
请你帮他补充完整: 。
19.4.2g某有机物在氧气中完全燃烧生成13.2g二氧化碳和5.4g水,那么该有机物中 (填“有”或“无”)氧元素,该有机物中碳元素与消耗氧气的质量比为 。
三、实验探究题
20.以下是俄国化学家罗蒙诺索夫曾开展的实验:
①先用天平称取质量为m1的金属锡粉。
②将这些锡粉放在密闭容器里进行完全燃烧,生成了白色固体物质,称量容器的总质量
为m2。
③打开容器,听到了空气进入容器发出的“丝丝的声响”,称量所得白色物质的质量
为m3。。
④把白色物质放回原容器里(容器中空气的组成恢复到初始状态),重新称量容器的总
质量为m4。
(1)根据所学知识判断,锡的燃烧是 变化。
(2)罗蒙诺索夫分析数据后发现,生成白色物质的质量m3= ,于是提出了“参加
反应的物质的总质量,等于反应后产物的总质量”的观点。
(3)请从微观角度解释质量守恒定律: 。
21.[2022 嘉兴(舟山)]小舟选用白磷、锥形瓶、气球、天平等药品和器材,探究化学反应中物质质量的变化规律,装置如图。
【实验思路】先确认化学反应已经发生,再比较反应物的质量总和和生成物的质量总和是否相等。
【实验步骤】
I.锥形瓶内装入白磷,塞紧瓶塞放在天平托盘上,调节平衡;
II.取下锥形瓶,将瓶塞上的铁丝在酒精灯上烧红后,接触引燃白磷,并立即塞紧瓶塞;
III.待反应结束冷却后,将锥形瓶放回天平托盘上,观察________。
【实验结论】参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
【交流反思】
(1)要确认化学反应已经发生,本实验中观察到的现象是________。
(2)反应结束后。若白磷有剩余,你认为是否仍能得出上述结论,并请说明理由。________。
四、解答题
22.[2022 温州]图甲是一款潜水艇紧急供氧设备的结构示意图,产氧药块主要成分是氯酸钠,需要镁粉氧化放热启动并维持反应进行,快速产生氧气。
(1)启动时,镁粉(Mg)与氧气反应生成氧化镁(MgO)。其化学方程式为:________。
(2)产氧药块反应会产生极少量有毒的氯气,推测图甲中试剂X应具有的性质是________。
(3)氯酸钠受热分解生成氯化钠和氧气。m克氯酸钠分解过程中各物质质量变化如图乙
所示,选择a、b、c、d、m中的部分数据,列出它们的等式关系以体现质量守恒定
律。 。
参考答案
一、选择题
1.B 2.C 3.D 4.B 5.B 6.D 7.A 8.D 9.A 10.B 11.D 12.C 13.C 14.D 15.C
二、填空题
16.(1)3:1 (2)1.2 (3)ABC
17.(1)两
(2)
18.(1)蓝色絮状沉淀(2)B(3)
19.没有 1:4
三、实验探究题
20.(1)化学 (2) m4﹣ m2+m1 (3)反应前后原子的种类不变,总个数不变,
21.【实验步骤】天平是否平衡
【交流反思】(1)白磷燃烧,产生大量白烟
(2)能,剩余白磷未参加反应,反应前后质量不变
四、解答题
22.(1)2Mg+O22MgO(2)吸收氯气,但不吸收氧气
(3)a+d=b+c(或a+d=m、b+c=m)
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
