2.2.氯及其化合物 课件(共32张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2.氯及其化合物 课件(共32张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-18 23:18:18 | ||
图片预览







文档简介
(共32张PPT)
第二节
氯及其化合物
1. 黄绿色气体
2. 有刺激性气味
3. 密度比空气大
4. 能溶于水(1:2)
5. 易液化
一、物理性质
氯气有毒
氯气对眼睛黏膜和皮肤有高度刺激性, 不仅如此,吸入氯气还会刺激呼吸道,使人咳嗽不止。
瑞典化学家舍勒
氯气的发现和确认
1774年舍勒发现了氯气,
1810年戴维确认了氯气
他将这种元素命名为Chlorine,这个名称来自希腊文,有“绿色”的意思。我国早年译文将其译成“绿气”,后改为氯气。
英国化学家戴维
舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。
思考与交流
启示1:科学研究需要有正确的理论作指导,错误的理论只能浪费时间和精力。
启示2:科学研究需要以大量事实为依据,只有大量事实才能推翻错误的理论,建立正确的理论或推动科学理论的发展。
启示3:科学研究需要有热爱科学的思想和奉献科学的精神。
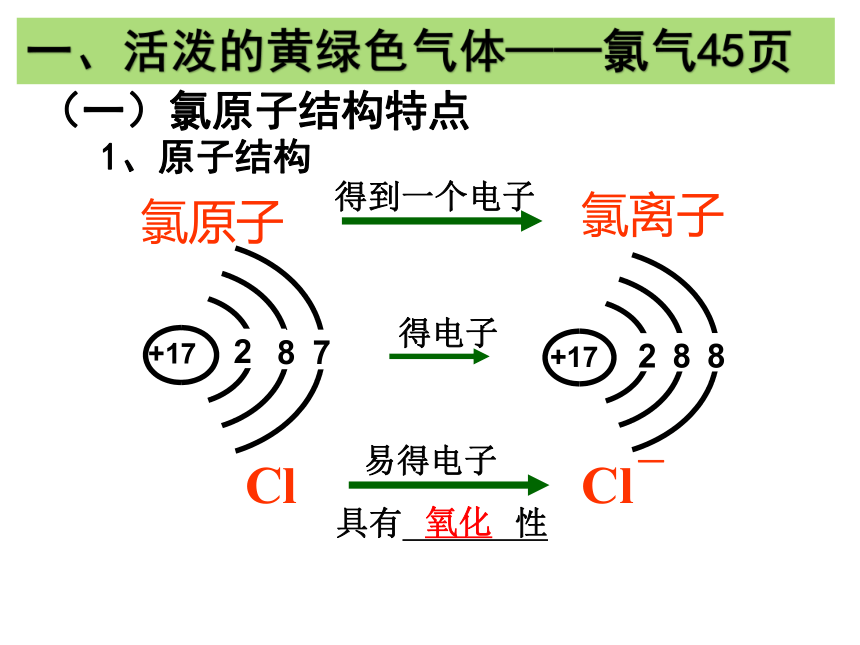
一、活泼的黄绿色气体——氯气45页
(一)氯原子结构特点
氯原子
得到一个电子
氯离子
+17
2
8
7
+17
2
8
8
得电子
Cl
Cl-
易得电子
1、原子结构
具有 性
氧化
2Na+Cl2 2NaCl
Cu + Cl2 CuCl2
1. 与金属反应
2Fe+3Cl2 2FeCl3
黄色火焰,大量白烟
棕褐色烟,棕黄色溶液
棕黄色烟,蓝绿色溶液
(使变价金属显高价)
注意:烟是固体小颗粒分散到空气中形成的。
二、化学性质
金属+氯气→金属氯化物
在通常情况下,干燥氯气不与铁反应,所以
可用钢瓶盛装和运输液氯。
2.与非金属反应
实验2-7 课本P45
反应现象:
①安静燃烧苍白的火焰
②反应产物在空气中呈现雾状
H2 + Cl2 === 2HCl
点燃
或光照
H2 与Cl2的混合气体在强光下发生爆炸
在一定条件下,Cl2还能与
P、S、C等非金属直接化合。
思考与交流
通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识
初中:物质与氧气发生发光发热的剧烈的化学反应叫燃烧
燃烧:任何发光发热的剧烈的化学反应叫做燃烧。燃烧不一定要有氧气参加,燃烧的本质是氧化还原反应。
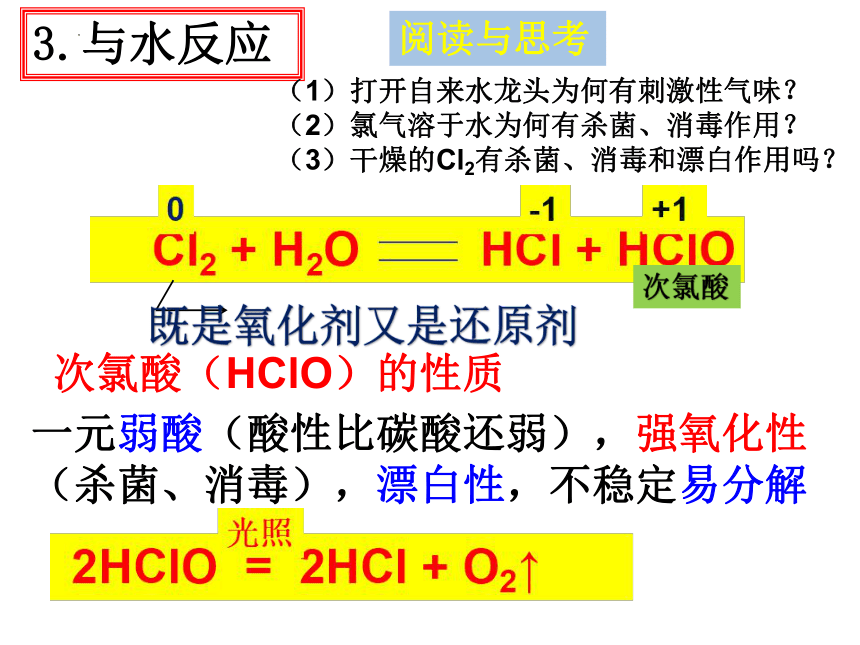
3.与水反应
阅读与思考
(1)打开自来水龙头为何有刺激性气味?
(2)氯气溶于水为何有杀菌、消毒作用?
(3)干燥的Cl2有杀菌、消毒和漂白作用吗?
次氯酸
既是氧化剂又是还原剂
次氯酸(HClO)的性质
一元弱酸(酸性比碳酸还弱),强氧化性(杀菌、消毒),漂白性,不稳定易分解
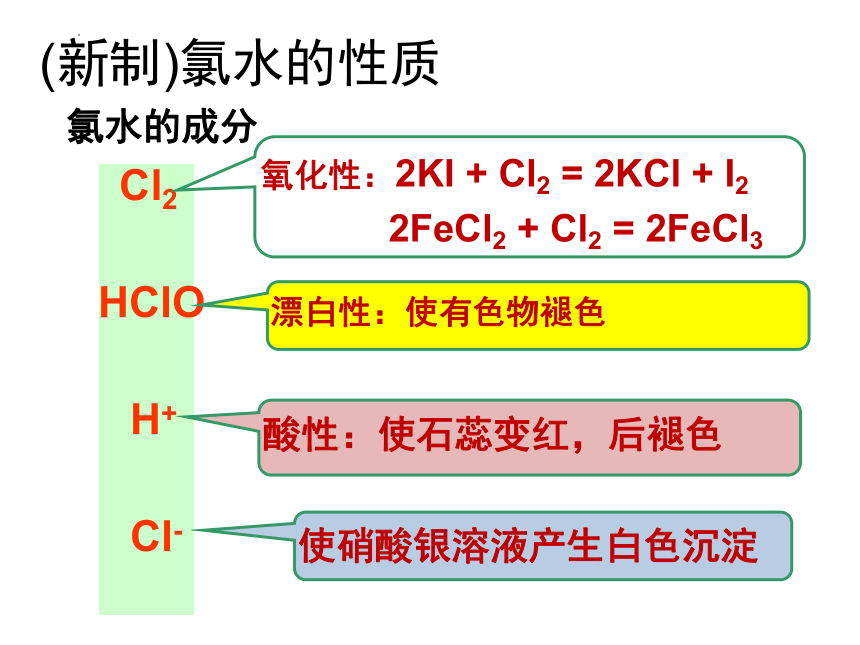
(新制)氯水的性质
氯水的成分
Cl2
HClO
H+
Cl-
氧化性:2KI + Cl2 = 2KCl + I2
2FeCl2 + Cl2 = 2FeCl3
漂白性:使有色物褪色
酸性:使石蕊变红,后褪色
使硝酸银溶液产生白色沉淀
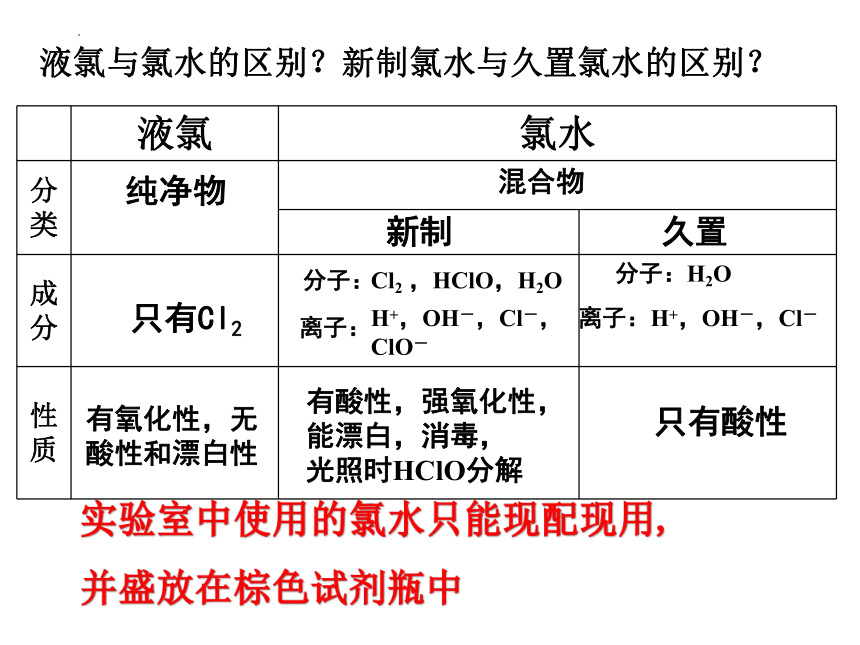
液氯与氯水的区别?新制氯水与久置氯水的区别?
液氯 氯水 分类
成分
性质
纯净物
混合物
新制
久置
只有Cl2
分子:
Cl2 ,HClO,H2O
离子:
H+,OH-,Cl-,ClO-
分子:H2O
离子:H+,OH-,Cl-
有氧化性,无酸性和漂白性
有酸性,强氧化性,能漂白,消毒,
光照时HClO分解
只有酸性
实验室中使用的氯水只能现配现用,
并盛放在棕色试剂瓶中
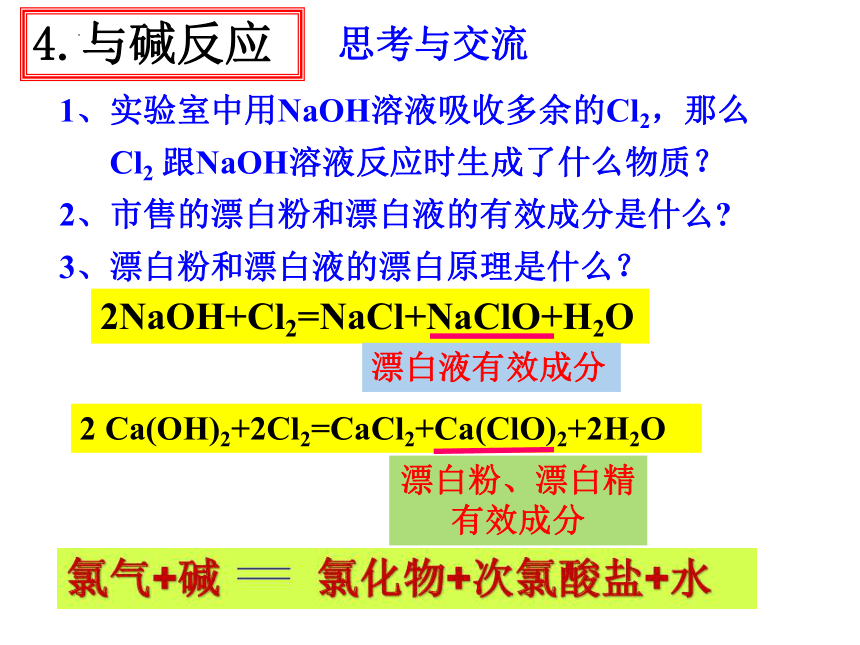
4.与碱反应
思考与交流
1、实验室中用NaOH溶液吸收多余的Cl2,那么
Cl2 跟NaOH溶液反应时生成了什么物质?
2、市售的漂白粉和漂白液的有效成分是什么
3、漂白粉和漂白液的漂白原理是什么?
2NaOH+Cl2=NaCl+NaClO+H2O
漂白液有效成分
2 Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
漂白粉、漂白精有效成分
漂白粉漂白原理:
日常 Ca(ClO)2+CO2+H2O = CaCO3↓+2HClO
(反应原理:强酸制取弱酸)
工业 Ca(ClO)2+2HCl = CaCl2+2HClO
氯水、漂白液、漂白粉、漂粉精的漂白作用都是因反应生成的HClO
漂白粉失效原因
Ca(ClO)2 + CO2 + H2O = CaCO3 + 2 HClO
思
考
1、为什么不直接用次氯酸作漂白剂?
次氯酸不稳定,次氯酸盐较稳定。
2、怎样保存漂白粉?
密封,保存于干燥处。
漂白性的比较
名称
原理
实质
程度
范围
过氧化钠
氯 水
将有色的色素
氧化为稳定的
无色物质
氯水中的HClO将有色物质氧化成无色物质
氧化作用
氧化作用
永久性
永久性
漂白大多数有色物质
漂白大多数有色物质,能使紫色石蕊试液褪色
活性炭
吸附色素
物理吸附
5.与盐溶液反应
与FeCl2 、KI等盐溶液反应(表现氯气的强氧化性)
2FeCl2 + Cl2 = 2FeCl3
Cl2 + 2KI = I2 + 2KCl
(四)氯气的用途
1、SiCl4、GeCl4、TiCl4分别是制取高纯硅、锗(半导体)和金属钛的重要中间物质
3、处理工业废水,将具有还原性的有毒物质硫化氢、氰化物等氧化成无毒物
2、合成塑料、橡胶、人造纤维、农药、染料和药品的重要原料
4、杀菌消毒,制漂白粉(液)
三、氯气的实验室制法
1、反应原理
MnO2+4HCl(浓) MnCl2+Cl2 +2H2O
浓盐酸表现的性质:
酸性、还原性
实验室制取气体装置
发生装置
除杂装置
干燥装置
收集装置
尾气处理
发生装置
分液漏斗
圆底烧瓶
选择依据:反应物状态及反应条件
浓盐酸
MnO2
讨论:那么氯气的制备应选择什么发生装置?
2、装置连接
发生装置:
固体与液体加热
除杂装置:
饱和食盐水(除Cl2中的HCl)
收集装置:
向上排空气法
(或排饱和食盐水法)
尾气处理:
NaOH溶液吸收
干燥装置:
浓硫酸(除Cl2中的H2O)
方法2.湿润的蓝色石蕊试纸放在瓶口,是否先变红后褪色。
方法1.将湿润的淀粉-KI试纸放在瓶口,观察试纸是否变蓝。
讨论:氯气收集时如何验满?
淀粉碘化钾试纸
2KI+Cl2=2KCl+I2
淀粉碘化钾或蓝色石蕊试纸
尾气处理时,不能用澄清石灰水吸收氯气,因为澄清石灰水中Ca(OH)2的含量少,吸收不完全。
讨论:制取氯气时,如何进行尾气处理?
有毒气体的处理装置
处理依据:气体性质
自来水通常用氯气来杀菌消毒,如何检验自来水中含有氯离子?
HCl
NaCl
Na2CO3
AgNO3溶液
AgNO3溶液
AgNO3溶液
HNO3溶液
HNO3溶液
HNO3溶液
Cl- + Ag+ = AgCl↓
CO32- + 2Ag+ = Ag2CO3↓
Ag2CO3 + 2H+ = 2Ag+ +
CO2↑ + H2O
四、Cl-的检验
问题讨论
在下列溶液中各滴入几滴AgNO3溶液,再分别加入少量稀HNO3,出现什么现象?
氯离子(Cl-)的检验方法
1、顺序:先加稀HNO3溶液,再加AgNO3溶液。
2、现象:产生白色沉淀。
3、原理:Ag+ + Cl- == AgCl↓。
4、加稀硝酸的目的:排除 等离子的干扰。
【归纳总结】
取少量待测溶液(于试管中),加入稀硝酸(酸化),再加硝酸银溶液,若有白色沉淀,则(证明)原溶液中有Cl-。
50页
课堂小结
指出装置中的错误
缺石棉网
缺酒精灯
没有使用浓盐酸
位置颠倒
导管应该长进短出
Ca(OH)2
应该用NaOH
4
课堂练习
应该用向上排空气法
(1)连接上述仪器的正确顺序(填各接口处的字母):___接___;___接___;___接___;___接___。
二氧化锰跟浓盐酸反应制备干燥纯净的氯气。
E
C
D
A
B
H
G
F
(2)装置中,饱和食盐水的作用是____________;NaOH溶液的作用是_______________。
除Cl2中的HCl
吸收过量的氯气
(3)化学实验中常用湿润的淀粉 -KI
试纸检验是否有Cl2产生。如果有Cl2产生,可观察到________,反应的化学方程式为___________________。
试纸变蓝
2KI+Cl2=2KCl+I2
(4)写出下列化学反应的化学方程式:
①气体发生装置中:________________________。
②NaOH溶液中:__________________________。
MnO2+4HCl(浓) MnCl2+Cl2↑
+2H2O
2NaOH+Cl2=NaCl+NaClO+H2O
浓盐酸
课堂练习
检验Cl-时所用试剂HNO3的作用是( )
A.防止CO32-的干扰
B.防止Cl-的干扰
C.生成Ag2CO3沉淀
D.防止NO3-的干扰
课堂练习
A
3. 氯气的实验室制备
(原理、试剂、仪器、装置、验满、尾气处理)
MnO2 + 4HCl(浓)= MnCl2 +2H2O + Cl2
除去氯化氢
干燥氯气
收集氯气
吸收氯气
气体净化
E
C
D
A
B
H
G
F
淀粉碘化钾或蓝色石蕊试纸
二、Cl-的检验
实验:P85实验4-6
加入
AgNO3后
实验现象
加入稀硝酸后
蒸馏水
自来水
Na2CO3溶液
NaCl溶液
稀盐酸
解析
白色沉淀
白色沉淀
无现象
白色沉淀
白色沉淀
无现象
白色沉淀
白色沉淀消失,
同时有气泡生成
自来水有Cl-
Ag+ + Cl- = AgCl↓
2Ag+ + CO32- = Ag2CO3↓
Ag2CO3 + 2HNO3 ==
2AgNO3 + H2O +CO2↑
白色沉淀
白色沉淀
Ag+ + Cl- = AgCl↓
Ag+ + Cl- = AgCl↓
结论:检验试剂—硝酸银、干扰离子— CO32-等
排除干扰试剂—硝酸
方法:先加稀硝酸,后加硝酸银溶液
或:先加硝酸银溶液,后加稀硝酸
生成白色沉淀不溶于稀硝酸
第二节
氯及其化合物
1. 黄绿色气体
2. 有刺激性气味
3. 密度比空气大
4. 能溶于水(1:2)
5. 易液化
一、物理性质
氯气有毒
氯气对眼睛黏膜和皮肤有高度刺激性, 不仅如此,吸入氯气还会刺激呼吸道,使人咳嗽不止。
瑞典化学家舍勒
氯气的发现和确认
1774年舍勒发现了氯气,
1810年戴维确认了氯气
他将这种元素命名为Chlorine,这个名称来自希腊文,有“绿色”的意思。我国早年译文将其译成“绿气”,后改为氯气。
英国化学家戴维
舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。
思考与交流
启示1:科学研究需要有正确的理论作指导,错误的理论只能浪费时间和精力。
启示2:科学研究需要以大量事实为依据,只有大量事实才能推翻错误的理论,建立正确的理论或推动科学理论的发展。
启示3:科学研究需要有热爱科学的思想和奉献科学的精神。
一、活泼的黄绿色气体——氯气45页
(一)氯原子结构特点
氯原子
得到一个电子
氯离子
+17
2
8
7
+17
2
8
8
得电子
Cl
Cl-
易得电子
1、原子结构
具有 性
氧化
2Na+Cl2 2NaCl
Cu + Cl2 CuCl2
1. 与金属反应
2Fe+3Cl2 2FeCl3
黄色火焰,大量白烟
棕褐色烟,棕黄色溶液
棕黄色烟,蓝绿色溶液
(使变价金属显高价)
注意:烟是固体小颗粒分散到空气中形成的。
二、化学性质
金属+氯气→金属氯化物
在通常情况下,干燥氯气不与铁反应,所以
可用钢瓶盛装和运输液氯。
2.与非金属反应
实验2-7 课本P45
反应现象:
①安静燃烧苍白的火焰
②反应产物在空气中呈现雾状
H2 + Cl2 === 2HCl
点燃
或光照
H2 与Cl2的混合气体在强光下发生爆炸
在一定条件下,Cl2还能与
P、S、C等非金属直接化合。
思考与交流
通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识
初中:物质与氧气发生发光发热的剧烈的化学反应叫燃烧
燃烧:任何发光发热的剧烈的化学反应叫做燃烧。燃烧不一定要有氧气参加,燃烧的本质是氧化还原反应。
3.与水反应
阅读与思考
(1)打开自来水龙头为何有刺激性气味?
(2)氯气溶于水为何有杀菌、消毒作用?
(3)干燥的Cl2有杀菌、消毒和漂白作用吗?
次氯酸
既是氧化剂又是还原剂
次氯酸(HClO)的性质
一元弱酸(酸性比碳酸还弱),强氧化性(杀菌、消毒),漂白性,不稳定易分解
(新制)氯水的性质
氯水的成分
Cl2
HClO
H+
Cl-
氧化性:2KI + Cl2 = 2KCl + I2
2FeCl2 + Cl2 = 2FeCl3
漂白性:使有色物褪色
酸性:使石蕊变红,后褪色
使硝酸银溶液产生白色沉淀
液氯与氯水的区别?新制氯水与久置氯水的区别?
液氯 氯水 分类
成分
性质
纯净物
混合物
新制
久置
只有Cl2
分子:
Cl2 ,HClO,H2O
离子:
H+,OH-,Cl-,ClO-
分子:H2O
离子:H+,OH-,Cl-
有氧化性,无酸性和漂白性
有酸性,强氧化性,能漂白,消毒,
光照时HClO分解
只有酸性
实验室中使用的氯水只能现配现用,
并盛放在棕色试剂瓶中
4.与碱反应
思考与交流
1、实验室中用NaOH溶液吸收多余的Cl2,那么
Cl2 跟NaOH溶液反应时生成了什么物质?
2、市售的漂白粉和漂白液的有效成分是什么
3、漂白粉和漂白液的漂白原理是什么?
2NaOH+Cl2=NaCl+NaClO+H2O
漂白液有效成分
2 Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
漂白粉、漂白精有效成分
漂白粉漂白原理:
日常 Ca(ClO)2+CO2+H2O = CaCO3↓+2HClO
(反应原理:强酸制取弱酸)
工业 Ca(ClO)2+2HCl = CaCl2+2HClO
氯水、漂白液、漂白粉、漂粉精的漂白作用都是因反应生成的HClO
漂白粉失效原因
Ca(ClO)2 + CO2 + H2O = CaCO3 + 2 HClO
思
考
1、为什么不直接用次氯酸作漂白剂?
次氯酸不稳定,次氯酸盐较稳定。
2、怎样保存漂白粉?
密封,保存于干燥处。
漂白性的比较
名称
原理
实质
程度
范围
过氧化钠
氯 水
将有色的色素
氧化为稳定的
无色物质
氯水中的HClO将有色物质氧化成无色物质
氧化作用
氧化作用
永久性
永久性
漂白大多数有色物质
漂白大多数有色物质,能使紫色石蕊试液褪色
活性炭
吸附色素
物理吸附
5.与盐溶液反应
与FeCl2 、KI等盐溶液反应(表现氯气的强氧化性)
2FeCl2 + Cl2 = 2FeCl3
Cl2 + 2KI = I2 + 2KCl
(四)氯气的用途
1、SiCl4、GeCl4、TiCl4分别是制取高纯硅、锗(半导体)和金属钛的重要中间物质
3、处理工业废水,将具有还原性的有毒物质硫化氢、氰化物等氧化成无毒物
2、合成塑料、橡胶、人造纤维、农药、染料和药品的重要原料
4、杀菌消毒,制漂白粉(液)
三、氯气的实验室制法
1、反应原理
MnO2+4HCl(浓) MnCl2+Cl2 +2H2O
浓盐酸表现的性质:
酸性、还原性
实验室制取气体装置
发生装置
除杂装置
干燥装置
收集装置
尾气处理
发生装置
分液漏斗
圆底烧瓶
选择依据:反应物状态及反应条件
浓盐酸
MnO2
讨论:那么氯气的制备应选择什么发生装置?
2、装置连接
发生装置:
固体与液体加热
除杂装置:
饱和食盐水(除Cl2中的HCl)
收集装置:
向上排空气法
(或排饱和食盐水法)
尾气处理:
NaOH溶液吸收
干燥装置:
浓硫酸(除Cl2中的H2O)
方法2.湿润的蓝色石蕊试纸放在瓶口,是否先变红后褪色。
方法1.将湿润的淀粉-KI试纸放在瓶口,观察试纸是否变蓝。
讨论:氯气收集时如何验满?
淀粉碘化钾试纸
2KI+Cl2=2KCl+I2
淀粉碘化钾或蓝色石蕊试纸
尾气处理时,不能用澄清石灰水吸收氯气,因为澄清石灰水中Ca(OH)2的含量少,吸收不完全。
讨论:制取氯气时,如何进行尾气处理?
有毒气体的处理装置
处理依据:气体性质
自来水通常用氯气来杀菌消毒,如何检验自来水中含有氯离子?
HCl
NaCl
Na2CO3
AgNO3溶液
AgNO3溶液
AgNO3溶液
HNO3溶液
HNO3溶液
HNO3溶液
Cl- + Ag+ = AgCl↓
CO32- + 2Ag+ = Ag2CO3↓
Ag2CO3 + 2H+ = 2Ag+ +
CO2↑ + H2O
四、Cl-的检验
问题讨论
在下列溶液中各滴入几滴AgNO3溶液,再分别加入少量稀HNO3,出现什么现象?
氯离子(Cl-)的检验方法
1、顺序:先加稀HNO3溶液,再加AgNO3溶液。
2、现象:产生白色沉淀。
3、原理:Ag+ + Cl- == AgCl↓。
4、加稀硝酸的目的:排除 等离子的干扰。
【归纳总结】
取少量待测溶液(于试管中),加入稀硝酸(酸化),再加硝酸银溶液,若有白色沉淀,则(证明)原溶液中有Cl-。
50页
课堂小结
指出装置中的错误
缺石棉网
缺酒精灯
没有使用浓盐酸
位置颠倒
导管应该长进短出
Ca(OH)2
应该用NaOH
4
课堂练习
应该用向上排空气法
(1)连接上述仪器的正确顺序(填各接口处的字母):___接___;___接___;___接___;___接___。
二氧化锰跟浓盐酸反应制备干燥纯净的氯气。
E
C
D
A
B
H
G
F
(2)装置中,饱和食盐水的作用是____________;NaOH溶液的作用是_______________。
除Cl2中的HCl
吸收过量的氯气
(3)化学实验中常用湿润的淀粉 -KI
试纸检验是否有Cl2产生。如果有Cl2产生,可观察到________,反应的化学方程式为___________________。
试纸变蓝
2KI+Cl2=2KCl+I2
(4)写出下列化学反应的化学方程式:
①气体发生装置中:________________________。
②NaOH溶液中:__________________________。
MnO2+4HCl(浓) MnCl2+Cl2↑
+2H2O
2NaOH+Cl2=NaCl+NaClO+H2O
浓盐酸
课堂练习
检验Cl-时所用试剂HNO3的作用是( )
A.防止CO32-的干扰
B.防止Cl-的干扰
C.生成Ag2CO3沉淀
D.防止NO3-的干扰
课堂练习
A
3. 氯气的实验室制备
(原理、试剂、仪器、装置、验满、尾气处理)
MnO2 + 4HCl(浓)= MnCl2 +2H2O + Cl2
除去氯化氢
干燥氯气
收集氯气
吸收氯气
气体净化
E
C
D
A
B
H
G
F
淀粉碘化钾或蓝色石蕊试纸
二、Cl-的检验
实验:P85实验4-6
加入
AgNO3后
实验现象
加入稀硝酸后
蒸馏水
自来水
Na2CO3溶液
NaCl溶液
稀盐酸
解析
白色沉淀
白色沉淀
无现象
白色沉淀
白色沉淀
无现象
白色沉淀
白色沉淀消失,
同时有气泡生成
自来水有Cl-
Ag+ + Cl- = AgCl↓
2Ag+ + CO32- = Ag2CO3↓
Ag2CO3 + 2HNO3 ==
2AgNO3 + H2O +CO2↑
白色沉淀
白色沉淀
Ag+ + Cl- = AgCl↓
Ag+ + Cl- = AgCl↓
结论:检验试剂—硝酸银、干扰离子— CO32-等
排除干扰试剂—硝酸
方法:先加稀硝酸,后加硝酸银溶液
或:先加硝酸银溶液,后加稀硝酸
生成白色沉淀不溶于稀硝酸
