1.2.1电解质的电离 课件(共20张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2.1电解质的电离 课件(共20张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 23.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-19 14:49:54 | ||
图片预览








文档简介
(共20张PPT)
第二节 离子反应
第一课时
电解质的电离
1.能从宏观和微观的角度理解电解质的概念,了解常见的电解质,会正
确识别判断电解质与非电解质。
2.认识酸、碱、盐在水溶液中或熔融状态下能发生电离,并会用电离方
程式表示。能从电离的角度认识酸、碱、盐的概念及其各自的通性。
核心素养发展目标
1965年,美国佛罗里达大学的橄榄球教练发现队员在训练后即使大量喝水,也无可避免失水甚至中暑的现象,研究后发现这种症状是严重的体液流失所导致。凯德博士首次尝试在运动员补充的水分中添加电解质,这一小小的举措和改变,获得了极大的成功,也因此诞生了运动饮料的开山鼻祖——佳得乐。
情境引入
[阅读以下化学史]
史料一:电解质的诞生﹣﹣法拉第的历史性发现
1833年,英国化学家和物理学家法拉第经过一系列的实验,发现当把电流作用在氯化钠的水溶液时,溶液中有电流即导电,他把通电条件下能够解离的物质叫做电解质,解离得到的产物叫做离子,带正电荷离子称为阳离子,带负电荷的离子称为阴离子,这一过程为电离,这些名称沿用至今。
史料二:电解质的新生﹣﹣阿伦尼乌斯石破天惊的挑战
1882-1887年,瑞典化学家阿伦乌斯研究发现,电解质电离出离子不需要电流,指出电解质溶于水后会不同程度地解离为带有正、负电离子。他的理论当时看来异常荒谬,遭到了包括门捷列夫在内的诸多化学"大神"的猛烈攻击。1890年电离理论得到认可,1903年阿伦尼乌斯 为历史上第三位获得诺贝尔奖的化学家。
探究
湿手直接接触电源容易触电,说明汗液中的成分如氯化钠溶液能够导电。
(1)氯化钠溶液解离出离子需不需要通电?
(2)氯化钠溶液能够导电,是哪些微粒引起的?请设计实验验证你的猜想
猜想: 水导电
氯化钠固体导电
氯化钠与水作用产生的微粒导电
精确的电导性实验表明,纯水大部分以H2O分子的
形式存在,但其中也存在着极少量的离子。
资料
电导率仪
Cl-
Na+
【思考】如何解释 NaCI 固体不导电, NaCI溶液能够导电?
氯化钠晶体,由带正电荷的 Na +与带负电荷的 CI ,通过静电作用按照一定规律紧密排列在一起,无法自由移动
在水分子作用下,破坏静电作用力, Na+和 CI-脱离晶体表面,变成能够自由移动离子。在外加电场作用下定向移动,电导仪的灯变亮。
水合 Na+、水合 CI- ,水合离子是微粒在水溶液中真正存在形式。
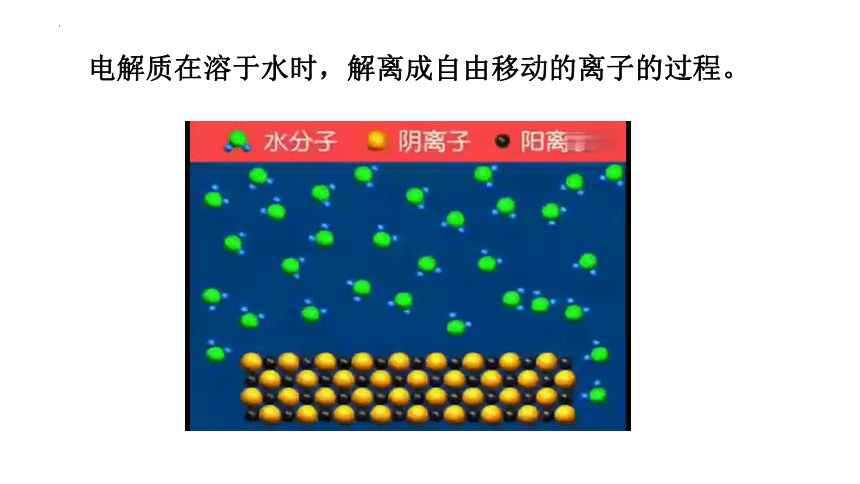
电解质在溶于水时,解离成自由移动的离子的过程。
水能破坏离子之间的静电引力,还有什么方法吗?
熔融状态,硝酸钾晶体由 K+和NO3 -构成,提供高温能量,微粒的运动速度加快,破坏 K+和NO3 -之间的静电引力,使之彼此远离,形成自由移动的离子从而导电。
2.物质导电的原因探究
(1)物质导电的原因:具有能________、_______的粒子。
(2)化合物(以NaCl为例)导电的原因。
NaCl固体 NaCl溶液 熔融NaCl
含有微粒 Na+、Cl- 水合钠离子、水合氯离子 Na+、Cl-
微粒能否自由移动 ___ ___ ___
能自由移动的原因 在水分子作用下Na+、Cl-脱离NaCl固体的表面 受热熔化时,离子运动随温度升高而加快,克服了离子间的作用
结论:化合物能导电的状态为_____或_________。
自由移动
带电荷
溶液
否
能
能
熔融状态
二、电解质的电离
1. 电离
(1)定义:物质溶于水或受热熔化时,解离 在 成能够自由移动的离子的过程
(2)电离的结果:阴离子、阳离子
与通电无关
②等号右边离子所带的电荷总数为0(电荷守恒)
①等号两边各元素的原子个数相等 (原子守恒)
(3)检查:
NaCl = Na+ + Cl-
阳离子
阴离子
化学式
离子符号
注意:电离过程,原子团不能拆
2. 电离方程式:
(1) 定义:用化学式和离子符号来表示物质电离的式子。
(2)书写:左边写化学式,右边写离子符号
HNO3
(1)HCl
H2SO4
(2)KOH
Ba(OH)2
NaOH
(3)BaCl2 (NH4)2SO4 KNO3
书写电离方程式
练习
2.从电离角度认识酸、碱、盐
KOH===K++OH-
全部是H+
Ca(OH)2===Ca2++2OH-
全部是OH-
金属阳离子(或铵根离子)
酸根离子
思考
有哪些方法能观测到电解质电离产生的离子?
导电性 酸碱性 颜色
电解质电离出离子
认识离子的性质
体现电解质的性质
1.下列说法正确的是
A.铜、石墨均能导电,所以它们都是电解质
B.氨、二氧化碳的水溶液都能导电,所以它们都是电解质
C.液态氯化氢、固体氯化钠都不能导电,所以它们都是非电解质
D.蔗糖、酒精在水溶液里或熔融状态下都不能导电,所以它们都是非电
解质
√
随堂演练 知识落实
(1)能导电的物质不一定是电解质(如金属、石墨、盐酸等),电解质不一定能导电。
(2)溶于水能导电的化合物不一定是电解质(如二氧化碳、氨等是非电解质)。
(3)电解质溶于水能导电,但熔融状态下不一定能导电(如氯化氢等)。
(4)电解质不一定易溶于水(如硫酸钡等),易溶于水的化合物不一定是电解质(如酒精等)。
(5)电解质、非电解质均必须是化合物,混合物(溶液)、单质既不是电解质也不是非电解质。
归纳总结
解析 盐酸为混合物、铁为单质,它们既不是电解质,也不是非电解质;碳酸钠、碳酸钙为电解质。
2.下列物质分类正确的组合是
选项 纯净物 混合物 电解质 非电解质
A 盐酸 空气 硫酸 干冰
B 蒸馏水 蔗糖溶液 氧化铝 二氧化硫
C 胆矾 氢氧化铁胶体 铁 碳酸钙
D 水银 澄清石灰水 氯化铜 碳酸钠
√
5.下列都是中学化学常见的物质:
①Cu ②NaCl ③NaHSO4 ④SO2 ⑤H2SO4 ⑥C2H5OH(酒精)
⑦CaCO3 ⑧BaSO4 ⑨Cu(OH)2 ⑩NaOH
请按下列分类标准回答:
(1)属于电解质的是 (填序号,下同)。
(2)溶于水能电离出H+的是 ,属于酸的是 。
(3)属于难溶性碱的是 ,属于难溶性盐的是 。
②③⑤⑦⑧⑨⑩
③⑤
⑤
⑨
⑦⑧
第二节 离子反应
第一课时
电解质的电离
1.能从宏观和微观的角度理解电解质的概念,了解常见的电解质,会正
确识别判断电解质与非电解质。
2.认识酸、碱、盐在水溶液中或熔融状态下能发生电离,并会用电离方
程式表示。能从电离的角度认识酸、碱、盐的概念及其各自的通性。
核心素养发展目标
1965年,美国佛罗里达大学的橄榄球教练发现队员在训练后即使大量喝水,也无可避免失水甚至中暑的现象,研究后发现这种症状是严重的体液流失所导致。凯德博士首次尝试在运动员补充的水分中添加电解质,这一小小的举措和改变,获得了极大的成功,也因此诞生了运动饮料的开山鼻祖——佳得乐。
情境引入
[阅读以下化学史]
史料一:电解质的诞生﹣﹣法拉第的历史性发现
1833年,英国化学家和物理学家法拉第经过一系列的实验,发现当把电流作用在氯化钠的水溶液时,溶液中有电流即导电,他把通电条件下能够解离的物质叫做电解质,解离得到的产物叫做离子,带正电荷离子称为阳离子,带负电荷的离子称为阴离子,这一过程为电离,这些名称沿用至今。
史料二:电解质的新生﹣﹣阿伦尼乌斯石破天惊的挑战
1882-1887年,瑞典化学家阿伦乌斯研究发现,电解质电离出离子不需要电流,指出电解质溶于水后会不同程度地解离为带有正、负电离子。他的理论当时看来异常荒谬,遭到了包括门捷列夫在内的诸多化学"大神"的猛烈攻击。1890年电离理论得到认可,1903年阿伦尼乌斯 为历史上第三位获得诺贝尔奖的化学家。
探究
湿手直接接触电源容易触电,说明汗液中的成分如氯化钠溶液能够导电。
(1)氯化钠溶液解离出离子需不需要通电?
(2)氯化钠溶液能够导电,是哪些微粒引起的?请设计实验验证你的猜想
猜想: 水导电
氯化钠固体导电
氯化钠与水作用产生的微粒导电
精确的电导性实验表明,纯水大部分以H2O分子的
形式存在,但其中也存在着极少量的离子。
资料
电导率仪
Cl-
Na+
【思考】如何解释 NaCI 固体不导电, NaCI溶液能够导电?
氯化钠晶体,由带正电荷的 Na +与带负电荷的 CI ,通过静电作用按照一定规律紧密排列在一起,无法自由移动
在水分子作用下,破坏静电作用力, Na+和 CI-脱离晶体表面,变成能够自由移动离子。在外加电场作用下定向移动,电导仪的灯变亮。
水合 Na+、水合 CI- ,水合离子是微粒在水溶液中真正存在形式。
电解质在溶于水时,解离成自由移动的离子的过程。
水能破坏离子之间的静电引力,还有什么方法吗?
熔融状态,硝酸钾晶体由 K+和NO3 -构成,提供高温能量,微粒的运动速度加快,破坏 K+和NO3 -之间的静电引力,使之彼此远离,形成自由移动的离子从而导电。
2.物质导电的原因探究
(1)物质导电的原因:具有能________、_______的粒子。
(2)化合物(以NaCl为例)导电的原因。
NaCl固体 NaCl溶液 熔融NaCl
含有微粒 Na+、Cl- 水合钠离子、水合氯离子 Na+、Cl-
微粒能否自由移动 ___ ___ ___
能自由移动的原因 在水分子作用下Na+、Cl-脱离NaCl固体的表面 受热熔化时,离子运动随温度升高而加快,克服了离子间的作用
结论:化合物能导电的状态为_____或_________。
自由移动
带电荷
溶液
否
能
能
熔融状态
二、电解质的电离
1. 电离
(1)定义:物质溶于水或受热熔化时,解离 在 成能够自由移动的离子的过程
(2)电离的结果:阴离子、阳离子
与通电无关
②等号右边离子所带的电荷总数为0(电荷守恒)
①等号两边各元素的原子个数相等 (原子守恒)
(3)检查:
NaCl = Na+ + Cl-
阳离子
阴离子
化学式
离子符号
注意:电离过程,原子团不能拆
2. 电离方程式:
(1) 定义:用化学式和离子符号来表示物质电离的式子。
(2)书写:左边写化学式,右边写离子符号
HNO3
(1)HCl
H2SO4
(2)KOH
Ba(OH)2
NaOH
(3)BaCl2 (NH4)2SO4 KNO3
书写电离方程式
练习
2.从电离角度认识酸、碱、盐
KOH===K++OH-
全部是H+
Ca(OH)2===Ca2++2OH-
全部是OH-
金属阳离子(或铵根离子)
酸根离子
思考
有哪些方法能观测到电解质电离产生的离子?
导电性 酸碱性 颜色
电解质电离出离子
认识离子的性质
体现电解质的性质
1.下列说法正确的是
A.铜、石墨均能导电,所以它们都是电解质
B.氨、二氧化碳的水溶液都能导电,所以它们都是电解质
C.液态氯化氢、固体氯化钠都不能导电,所以它们都是非电解质
D.蔗糖、酒精在水溶液里或熔融状态下都不能导电,所以它们都是非电
解质
√
随堂演练 知识落实
(1)能导电的物质不一定是电解质(如金属、石墨、盐酸等),电解质不一定能导电。
(2)溶于水能导电的化合物不一定是电解质(如二氧化碳、氨等是非电解质)。
(3)电解质溶于水能导电,但熔融状态下不一定能导电(如氯化氢等)。
(4)电解质不一定易溶于水(如硫酸钡等),易溶于水的化合物不一定是电解质(如酒精等)。
(5)电解质、非电解质均必须是化合物,混合物(溶液)、单质既不是电解质也不是非电解质。
归纳总结
解析 盐酸为混合物、铁为单质,它们既不是电解质,也不是非电解质;碳酸钠、碳酸钙为电解质。
2.下列物质分类正确的组合是
选项 纯净物 混合物 电解质 非电解质
A 盐酸 空气 硫酸 干冰
B 蒸馏水 蔗糖溶液 氧化铝 二氧化硫
C 胆矾 氢氧化铁胶体 铁 碳酸钙
D 水银 澄清石灰水 氯化铜 碳酸钠
√
5.下列都是中学化学常见的物质:
①Cu ②NaCl ③NaHSO4 ④SO2 ⑤H2SO4 ⑥C2H5OH(酒精)
⑦CaCO3 ⑧BaSO4 ⑨Cu(OH)2 ⑩NaOH
请按下列分类标准回答:
(1)属于电解质的是 (填序号,下同)。
(2)溶于水能电离出H+的是 ,属于酸的是 。
(3)属于难溶性碱的是 ,属于难溶性盐的是 。
②③⑤⑦⑧⑨⑩
③⑤
⑤
⑨
⑦⑧
