2.1.1活泼金属单质---钠 课件(共25张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 2.1.1活泼金属单质---钠 课件(共25张ppt)化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 34.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-19 00:00:00 | ||
图片预览





文档简介
(共25张PPT)
活泼金属单质---钠
人教版高中化学必修1
第一节 钠及其化合物(第一课时)
人教版高中化学必修一
人 生 五 味
酸
甜
苦
辣
咸
百味之王
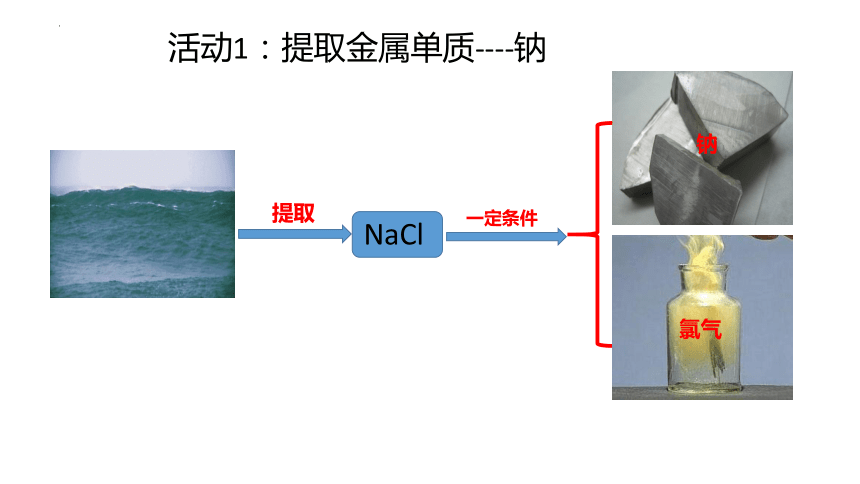
浩瀚的大海美丽而富饶。海洋是一个巨大的化学资源宝库,含有80多种元素,钠和氯既是其中含量较高的元素,也是典型的金属元素和典型的非金属元素。
海水中的重要元素-----钠和氯
钠
活动1:提取金属单质----钠
NaCl
提取
一定条件
氯气
3CO + Fe2O3 2Fe + 3CO2
高温
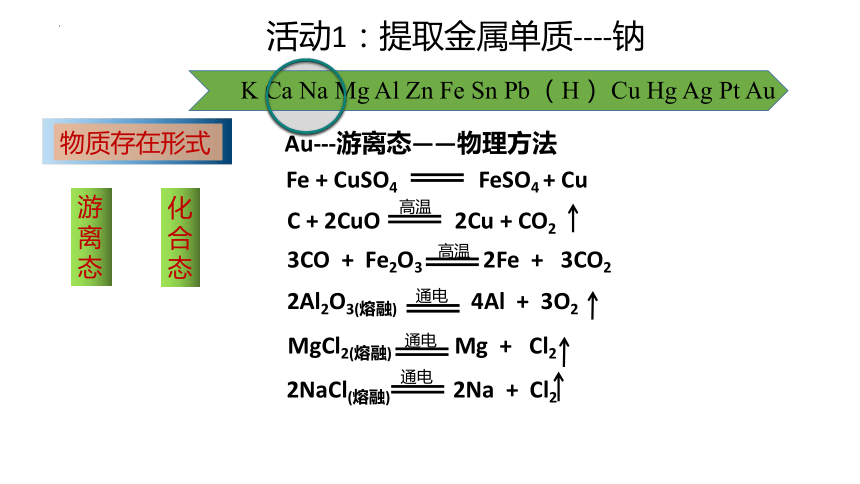
活动1:提取金属单质----钠
Au---游离态——物理方法
Fe + CuSO4 FeSO4 + Cu
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
C + 2CuO 2Cu + CO2
高温
2Al2O3(熔融) 4Al + 3O2
通电
MgCl2(熔融) Mg + Cl2
通电
2NaCl(熔融) 2Na + Cl2
通电
物质存在形式
游
离
态
化
合
态
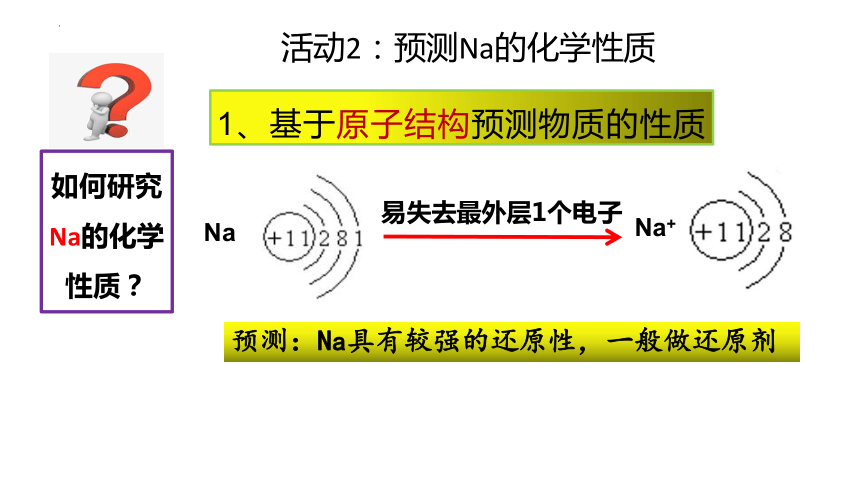
Na
Na+
易失去最外层1个电子
1、基于原子结构预测物质的性质
活动2:预测Na的化学性质
预测:Na具有较强的还原性,一般做还原剂
如何研究Na的化学性质?
2、基于金属活动顺序预测物质性质
活动2:预测Na的化学性质
预测:Na具有较强的还原性,一般做还原剂
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
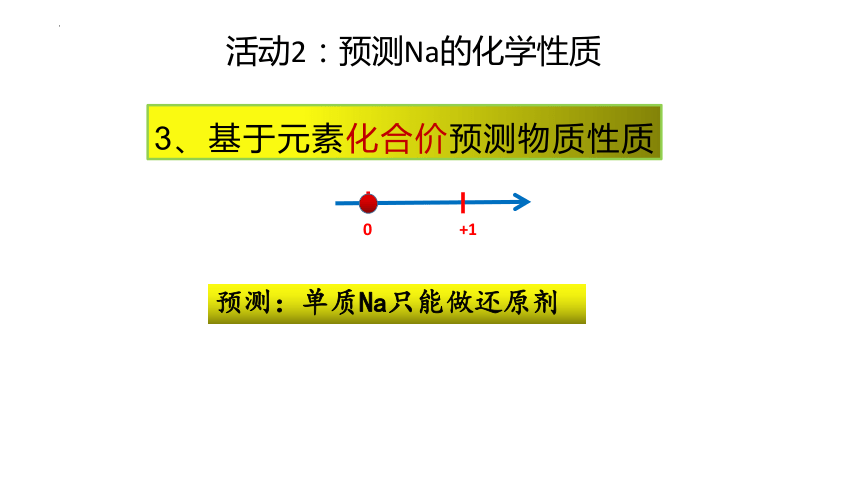
3、基于元素化合价预测物质性质
活动2:预测Na的化学性质
预测:单质Na只能做还原剂
0
+1
活动3:探究Na的性质(1)
思考:
1、钠可以用小刀切割,说明了什么?
2、新切开的钠的表面有怎样的变化?
硬度小
银白色、金属光泽;很快变暗
4Na + O2 2Na2O (灰白色)
常温:
一、活泼的金属单质------钠
(一)、钠的物理性质
(二)、钠的化学性质
硬度小、银白色、有金属光泽
4Na + O2 2Na2O (灰白色)
常温下与氧气反应:
活动3:探究Na的性质(2)
活动3:探究Na的性质(2)
加热:
2Na + O2 Na2O2 (淡黄色)
△
受热熔化
剧烈反应
黄色火焰
淡黄色固体
熔点低
生成过氧化钠
化学性质活泼
发黄光
一、活泼的金属单质------钠
(一)、钠的物理性质
(二)、钠的化学性质
硬度小、银白色、有金属光泽
4Na + O2 2Na2O (灰白色)
常温下:
熔点低
常温下:
2Na + O2 Na2O2 (淡黄色)
△
反应条件
影响反应产物
从氧化还原的角度思考 Na + H2O 反应的产物是什么?
预测:
0
+1
从化合价的角度分析:
Na
只能做还原剂
H2O
0
+1
可做氧化剂
-2
0
-1
可做还原剂
H
O
Na+
H2
O2
活动3:探究Na的性质(3)
预测:
Na+ H2O 2Na+ + H2
活动3:探究Na的性质(3)
密度小、反应放热
有碱性物质生成
剧烈、有气体生成
浮、熔
游、响
红
2Na+ 2H2O 2NaOH + H2
化学方程式:
2Na+ 2H2O 2Na+ + 2OH- + H2
离子方程式:
一、活泼的金属单质------钠
(一)、钠的物理性质
(二)、钠的化学性质
硬度小、银白色、有金属光泽
4Na + O2 2Na2O (灰白色)
常温与氧气反应:
熔点低
加热与氧气反应:
2Na + O2 Na2O2 (淡黄色)
△
密度比水小
2Na+ 2H2O 2NaOH + H2
与水反应:
活动4:金属钠该如何保存
思考:
1、金属钠、钾、锂性质相似,实验室应该如何保存?
2、如果保存不慎,金属钠着火应该怎么灭?
【资料】
煤油密度为0.8g/cm ;钠密度为0.971g/cm3 ;
钾密度为0.862g/cm ;锂密度为0.534g/cm ;
煤油液封
钾------煤油液封
锂------石蜡封存
干燥的沙土覆盖
分析物质组成
确定物质类别
确定物质性质
实验
预测物质性质
活动5:基于物质类别研究物质性质
如何研究Na的化学性质?
Fe
3Fe + 2O2 Fe3O4
点燃
Fe + 2HCl FeCl2 + H2
Fe + CuSO4 FeSO4 + Cu
金属单质 + 氧气 金属氧化物
金属单质 + 酸 盐 + 氢气
金属单质 + 盐 新盐 + 新金属
金属单质
活动5:基于物质类别研究物质性质
活动5:基于物质类别研究物质性质
金属单质 + 氧气 金属氧化物
金属单质 + 酸 盐 + 氢气
金属单质 + 盐 新盐 + 新金属
金属单质
2Na + O2 Na2O (灰白色)
2Na + O2 Na2O2 (淡黄色)
△
思考:
将Na放入硫酸铜溶液中,能否置换出铜?
2Na + 2HCl 2NaCl + H2
Na + KCl (熔融) NaCl + K
高温
活动7:钠的用途
高压钠灯使用时发出金白色光,具有发光效率高、耗电少、寿命长、透雾能力强和不锈蚀等优点。广泛应用于汽车、道路、高速公路、机场、码头、车站、广场、公园、体育馆、百货商店和宾馆等场所照明。火箭发射后,在大气层中释放出钠蒸气可产生明亮的橙黄色云雾,科学家据此就可确定火箭在空中的位置。
焰色反应
焰色反应,也称作焰色测试及焰色试验,是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特殊颜色的反应。根据火焰的颜色,可以判断样品中所含的金属元素。
一些金属及化合物的焰色反应
黄色
紫色
砖红色
洋红色
绿色
紫红色
黄绿色
1. 焰色反应是金属元素的性质,可以是游离态(单质),也可以是化合态(化合物),如Na和NaCl、Na2CO3等焰色反应都为黄色。
2. 并非所有金属元素都能发生焰色反应,如Fe、Al、Pt等金属元素均不发生焰色反应,故可用铂丝或铁丝来蘸取待检溶液做焰色反应。
注意事项:
3. 钾的焰色为紫色,但在观察钾的焰色时,要透过蓝色钴玻璃,以滤去钠的黄光,避免钠盐造成干扰。
4. 利用焰色反应可以检验某些用常规化学方法不能鉴别的金属元素(主要是钠和钾)。
5. 将铂丝或铁丝用盐酸洗净后放在火焰上灼烧至与原火焰颜色相同,是为了除去上面沾有的杂质。
注意事项:
活泼金属单质---钠
人教版高中化学必修1
第一节 钠及其化合物(第一课时)
人教版高中化学必修一
人 生 五 味
酸
甜
苦
辣
咸
百味之王
浩瀚的大海美丽而富饶。海洋是一个巨大的化学资源宝库,含有80多种元素,钠和氯既是其中含量较高的元素,也是典型的金属元素和典型的非金属元素。
海水中的重要元素-----钠和氯
钠
活动1:提取金属单质----钠
NaCl
提取
一定条件
氯气
3CO + Fe2O3 2Fe + 3CO2
高温
活动1:提取金属单质----钠
Au---游离态——物理方法
Fe + CuSO4 FeSO4 + Cu
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
C + 2CuO 2Cu + CO2
高温
2Al2O3(熔融) 4Al + 3O2
通电
MgCl2(熔融) Mg + Cl2
通电
2NaCl(熔融) 2Na + Cl2
通电
物质存在形式
游
离
态
化
合
态
Na
Na+
易失去最外层1个电子
1、基于原子结构预测物质的性质
活动2:预测Na的化学性质
预测:Na具有较强的还原性,一般做还原剂
如何研究Na的化学性质?
2、基于金属活动顺序预测物质性质
活动2:预测Na的化学性质
预测:Na具有较强的还原性,一般做还原剂
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
3、基于元素化合价预测物质性质
活动2:预测Na的化学性质
预测:单质Na只能做还原剂
0
+1
活动3:探究Na的性质(1)
思考:
1、钠可以用小刀切割,说明了什么?
2、新切开的钠的表面有怎样的变化?
硬度小
银白色、金属光泽;很快变暗
4Na + O2 2Na2O (灰白色)
常温:
一、活泼的金属单质------钠
(一)、钠的物理性质
(二)、钠的化学性质
硬度小、银白色、有金属光泽
4Na + O2 2Na2O (灰白色)
常温下与氧气反应:
活动3:探究Na的性质(2)
活动3:探究Na的性质(2)
加热:
2Na + O2 Na2O2 (淡黄色)
△
受热熔化
剧烈反应
黄色火焰
淡黄色固体
熔点低
生成过氧化钠
化学性质活泼
发黄光
一、活泼的金属单质------钠
(一)、钠的物理性质
(二)、钠的化学性质
硬度小、银白色、有金属光泽
4Na + O2 2Na2O (灰白色)
常温下:
熔点低
常温下:
2Na + O2 Na2O2 (淡黄色)
△
反应条件
影响反应产物
从氧化还原的角度思考 Na + H2O 反应的产物是什么?
预测:
0
+1
从化合价的角度分析:
Na
只能做还原剂
H2O
0
+1
可做氧化剂
-2
0
-1
可做还原剂
H
O
Na+
H2
O2
活动3:探究Na的性质(3)
预测:
Na+ H2O 2Na+ + H2
活动3:探究Na的性质(3)
密度小、反应放热
有碱性物质生成
剧烈、有气体生成
浮、熔
游、响
红
2Na+ 2H2O 2NaOH + H2
化学方程式:
2Na+ 2H2O 2Na+ + 2OH- + H2
离子方程式:
一、活泼的金属单质------钠
(一)、钠的物理性质
(二)、钠的化学性质
硬度小、银白色、有金属光泽
4Na + O2 2Na2O (灰白色)
常温与氧气反应:
熔点低
加热与氧气反应:
2Na + O2 Na2O2 (淡黄色)
△
密度比水小
2Na+ 2H2O 2NaOH + H2
与水反应:
活动4:金属钠该如何保存
思考:
1、金属钠、钾、锂性质相似,实验室应该如何保存?
2、如果保存不慎,金属钠着火应该怎么灭?
【资料】
煤油密度为0.8g/cm ;钠密度为0.971g/cm3 ;
钾密度为0.862g/cm ;锂密度为0.534g/cm ;
煤油液封
钾------煤油液封
锂------石蜡封存
干燥的沙土覆盖
分析物质组成
确定物质类别
确定物质性质
实验
预测物质性质
活动5:基于物质类别研究物质性质
如何研究Na的化学性质?
Fe
3Fe + 2O2 Fe3O4
点燃
Fe + 2HCl FeCl2 + H2
Fe + CuSO4 FeSO4 + Cu
金属单质 + 氧气 金属氧化物
金属单质 + 酸 盐 + 氢气
金属单质 + 盐 新盐 + 新金属
金属单质
活动5:基于物质类别研究物质性质
活动5:基于物质类别研究物质性质
金属单质 + 氧气 金属氧化物
金属单质 + 酸 盐 + 氢气
金属单质 + 盐 新盐 + 新金属
金属单质
2Na + O2 Na2O (灰白色)
2Na + O2 Na2O2 (淡黄色)
△
思考:
将Na放入硫酸铜溶液中,能否置换出铜?
2Na + 2HCl 2NaCl + H2
Na + KCl (熔融) NaCl + K
高温
活动7:钠的用途
高压钠灯使用时发出金白色光,具有发光效率高、耗电少、寿命长、透雾能力强和不锈蚀等优点。广泛应用于汽车、道路、高速公路、机场、码头、车站、广场、公园、体育馆、百货商店和宾馆等场所照明。火箭发射后,在大气层中释放出钠蒸气可产生明亮的橙黄色云雾,科学家据此就可确定火箭在空中的位置。
焰色反应
焰色反应,也称作焰色测试及焰色试验,是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特殊颜色的反应。根据火焰的颜色,可以判断样品中所含的金属元素。
一些金属及化合物的焰色反应
黄色
紫色
砖红色
洋红色
绿色
紫红色
黄绿色
1. 焰色反应是金属元素的性质,可以是游离态(单质),也可以是化合态(化合物),如Na和NaCl、Na2CO3等焰色反应都为黄色。
2. 并非所有金属元素都能发生焰色反应,如Fe、Al、Pt等金属元素均不发生焰色反应,故可用铂丝或铁丝来蘸取待检溶液做焰色反应。
注意事项:
3. 钾的焰色为紫色,但在观察钾的焰色时,要透过蓝色钴玻璃,以滤去钠的黄光,避免钠盐造成干扰。
4. 利用焰色反应可以检验某些用常规化学方法不能鉴别的金属元素(主要是钠和钾)。
5. 将铂丝或铁丝用盐酸洗净后放在火焰上灼烧至与原火焰颜色相同,是为了除去上面沾有的杂质。
注意事项:
