3.1铁及其化合物 课件(共31张PPT) 高一上学期化学人教版(2019)必修第一册第三章第一节
文档属性
| 名称 | 3.1铁及其化合物 课件(共31张PPT) 高一上学期化学人教版(2019)必修第一册第三章第一节 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-19 00:00:00 | ||
图片预览










文档简介
(共31张PPT)
第一节 铁及其化合物
68页
第三章 铁 金属材料
我国春秋时期铜柄铁剑
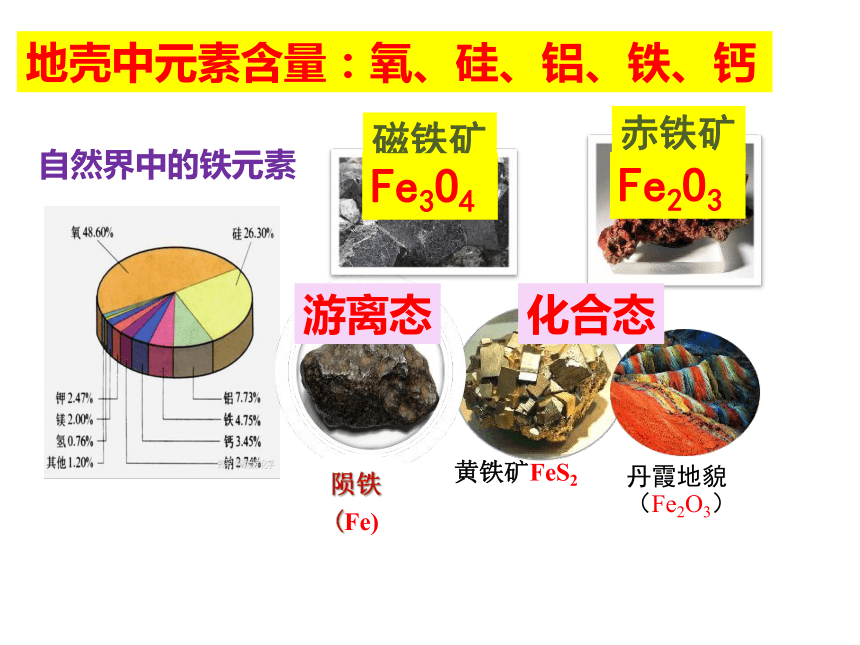
自然界中的铁元素
黄铁矿FeS2
陨铁(Fe)
丹霞地貌(Fe2O3)
磁铁矿
赤铁矿
阅读课本P68 了解铁在自然界的存在和冶炼
地壳中元素含量:氧、硅、铝、铁、钙
Fe3O4
Fe2O3
游离态
化合态
一、铁的存在及性质
1、存在:游离态、化合态
2、物理性质69页
铁具有银白色的固体,导电、导热,有延展性,密度较大,能被磁体吸引。工业上被称为黑色金属(铁、铬和锰)。
2Fe+3Cl2 = 2FeCl3
Fe+2HCl=FeCl2 + H2↑
Fe+CuSO4=FeSO4 + Cu
铁与强氧化剂反应
铁与弱氧化剂反应
Δ
⑴铁与非金属单质的反应
⑵铁与酸的反应
⑶铁与盐的反应
3、化学性质
炽热的铁水或钢水注入模具这前,模具要干燥处理,为什么?
思考与讨论: 教材P70图3-5所示装置
根据实验现象,分析可能的生成物
制水蒸气
检验H2
收集H2
3Fe + 4H2O(g)== Fe3O4 + 4H2
高温
⑷铁与水蒸气的反应
现象:加热时铁粉红热,产生肥皂泡;用燃着的木条靠近气泡,发出轻微爆鸣声;反应后试管内的固体仍呈黑色。
化学方程式:
练习
下列关于铁与水反应的描述不正确的是 ( )
A.铁与水蒸气反应的产物是黑色的Fe2O3
B.红热的铁能与水蒸气反应,放出的气体点燃时能发 出爆鸣声
C.铁与水蒸气的反应是氧化还原反应
D.常温下,Fe与H2O不反应,但在空气中O2、H2O的共同作用下能发生反应
A
二、铁的重要化合物
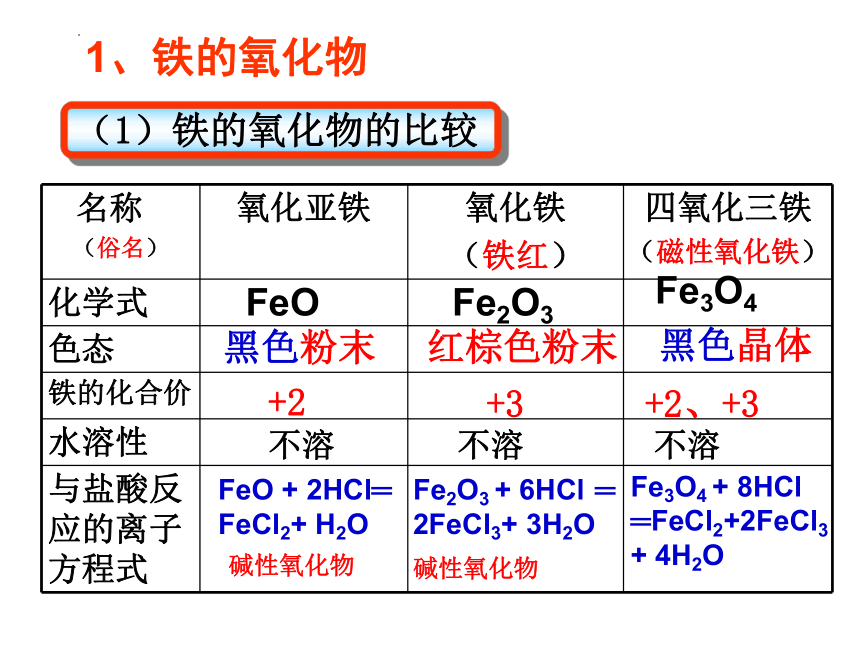
名称 (俗名) 氧化亚铁 氧化铁 (铁红) 四氧化三铁
(磁性氧化铁)
化学式
色态
铁的化合价
水溶性
与盐酸反应的离子方程式
+2
+3
+2、+3
不溶
不溶
不溶
FeO + 2HCl═
FeCl2+ H2O
Fe2O3 + 6HCl ═
2FeCl3+ 3H2O
黑色粉末
红棕色粉末
黑色晶体
FeO
Fe2O3
Fe3O4
1、铁的氧化物
(1)铁的氧化物的比较
碱性氧化物
碱性氧化物
Fe3O4 + 8HCl
═FeCl2+2FeCl3
+ 4H2O
Ⅰ. 作为冶炼金属的原料,如赤铁矿
Fe2O3+3CO ═ 2 Fe+3CO2
Ⅱ. 氧化铁常用于作油漆和涂料、油墨和橡胶的红色颜料。
高温
(2)铁的氧化物的用途
方案一:通过铁和水反应得到
方案二:通过铁的氧化物和水反应得到
方案二:用可溶性铁盐、亚铁盐与碱溶液反应得到
如何制备铁的两种氢氧化物?
Fe(OH)2 Fe(OH)3
思考交流:
铁有哪些氢氧化物?
加NaOH溶液
离子方程式
FeCl3溶液
FeSO4溶液
生成红褐色沉淀
Fe3++3OH- = Fe(OH)3↓
先生成白色絮状沉淀,后迅速变为灰绿色,最后变为红褐色沉淀
Fe2++2OH- = Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
实验3-1:71页
FeCl3+3NaOH = Fe(OH)3↓+3NaCl
FeSO4+2NaOH = Fe(OH)2↓+2NaSO4
既然Fe(OH)2 容易被空气中的氧气氧化,那么在制备Fe(OH)2时,应采取怎样操作方法更好
煮沸
FeSO4溶液
NaOH溶液
FeSO4溶液
NaOH
溶液
植物油、汽油、煤油或……
1. 新配置的FeSO4溶液
2.不含O2的蒸馏水配制的NaOH、FeSO4溶液
止水夹
稳定性
Fe(OH)2
Fe(OH)3
颜色、状态
与酸反应
溶解性
红褐色固体
白色固体
不溶于水
不溶于水
2Fe(OH)3 = Fe2O3+ 3H2O
不稳定,产物复杂
(2)氢氧化物的性质P72
Fe(OH)3+3HCl=FeCl3+3H2O
Fe(OH)2+2HCl=FeCl2+2H2O
常见的铁盐
3、铁盐(Fe 3+)和亚铁盐(Fe 2+)
Fe2(SO4)3、FeCl3、Fe(NO3)3
常见的亚铁盐
FeSO4、FeCl2、Fe(NO3)2
向FeCl3和FeCl2溶液中分别加入KSCN溶液
交流和讨论:
有哪些方法可以鉴别FeCl3溶液和FeCl2溶液
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液变成红色
无明显变化
(硫氰化钾)
Fe3+ + 3SCN- = Fe(SCN)3
取上一步实验所得的
上层清液加入氯水
FeCl3溶液加入Fe粉,后加入KSCN溶液
(4) Fe2+和Fe3+的相互转化
2Fe3+ + Fe = 3Fe2+
溶液不显红色
溶液变成红色
2Fe2+ + Cl2 = 2Fe3+ +2Cl
2FeCl3 + Fe = 3FeCl2
2FeCl2+Cl2=2FeCl3
加入铁粉
如何防止FeCl2溶液变质为FeCl3
2FeCl3 + Cu = 2FeCl2+CuCl2
铜与FeCl3反应:
(制电路板原理)
2FeCl3 + Fe = 3FeCl2
高价氧化,低价还
1、Fe只作还原剂
2、Fe3+只作氧化剂
3、Fe2+既可作氧化剂、也可作还原剂
Fe + 2H2SO4 = FeSO4 + H2↑
Fe + Fe2(SO4)3 = 3FeSO4
Zn + FeSO4 = Fe + ZnSO4
2FeCl2 + Cl2 = 2FeCl3
氧化剂
还原剂
Cl2 O2 Cu Fe
常作氧化剂的有:
常作还原剂的有:
Fe2+
Fe3+
Cu Fe
Cl2 O2
Cl2 O2
Cu Fe
归纳总结:
还原剂
氧化剂
(3)铁(+3)盐和亚铁(+2)盐的相互转换
从氧化性、还原性的角度考虑Fe2+、Fe3+、应如何转换?
Fe2+
Fe3+
Cl2、Br2、HNO3、H2O2、KMnO4等强氧化剂
金属单质(Zn到Cu)、H2S、S2-、I- 等强还原剂
铁三角关系:
Fe2+
Fe3+
Fe
Cl2、Br2、HNO3等强氧化剂
Cl2、Br2、HNO3、H2O2、KMnO4
金属单质(Zn到Cu)、H2S、S2-、I- 等还原剂
金属单质、H2、CO等还原剂
S、I2、非氧化性酸弱氧化剂
金属单质、H2、CO等还原剂
0
+3
+2
盐
氢氧化物
氧化物
Fe2+
Fe(OH)2
FeO
Fe3+
Fe(OH)3
Fe2O3
Fe
单质
认知模型
FeO
Fe2O3
Fe
氧化物
单质
Fe3O4
1、将钠投入到FeCl2溶液中,可观察到的现象是( )
A.最终生成白色沉淀
B.最终生成红褐色沉淀
C.有黄绿色气体产生
D.无变化
B
【课堂检测】
2、证明某溶液只含有Fe2+而不含Fe3+的实验方法是( )
A、先滴加氯水,再滴加KSCN溶液后显红色
B、先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C、滴加NaOH溶液,先产生白色沉淀,后变为灰绿色,最后变为红褐色
D、只需滴加KSCN溶液
B
3、室温下, A是常见的金属单质、单质B是黄绿色气体、单质C是无色气体; E溶液是无色溶液, F是浅绿色溶液, B和C反应发出苍白色火焰。在适当反应条件下,它们可以按下面框图进行反应。请回答:
1. A是_____ ,B是_____ ,C是____ (填写化学式) 。
第一节 铁及其化合物
68页
第三章 铁 金属材料
我国春秋时期铜柄铁剑
自然界中的铁元素
黄铁矿FeS2
陨铁(Fe)
丹霞地貌(Fe2O3)
磁铁矿
赤铁矿
阅读课本P68 了解铁在自然界的存在和冶炼
地壳中元素含量:氧、硅、铝、铁、钙
Fe3O4
Fe2O3
游离态
化合态
一、铁的存在及性质
1、存在:游离态、化合态
2、物理性质69页
铁具有银白色的固体,导电、导热,有延展性,密度较大,能被磁体吸引。工业上被称为黑色金属(铁、铬和锰)。
2Fe+3Cl2 = 2FeCl3
Fe+2HCl=FeCl2 + H2↑
Fe+CuSO4=FeSO4 + Cu
铁与强氧化剂反应
铁与弱氧化剂反应
Δ
⑴铁与非金属单质的反应
⑵铁与酸的反应
⑶铁与盐的反应
3、化学性质
炽热的铁水或钢水注入模具这前,模具要干燥处理,为什么?
思考与讨论: 教材P70图3-5所示装置
根据实验现象,分析可能的生成物
制水蒸气
检验H2
收集H2
3Fe + 4H2O(g)== Fe3O4 + 4H2
高温
⑷铁与水蒸气的反应
现象:加热时铁粉红热,产生肥皂泡;用燃着的木条靠近气泡,发出轻微爆鸣声;反应后试管内的固体仍呈黑色。
化学方程式:
练习
下列关于铁与水反应的描述不正确的是 ( )
A.铁与水蒸气反应的产物是黑色的Fe2O3
B.红热的铁能与水蒸气反应,放出的气体点燃时能发 出爆鸣声
C.铁与水蒸气的反应是氧化还原反应
D.常温下,Fe与H2O不反应,但在空气中O2、H2O的共同作用下能发生反应
A
二、铁的重要化合物
名称 (俗名) 氧化亚铁 氧化铁 (铁红) 四氧化三铁
(磁性氧化铁)
化学式
色态
铁的化合价
水溶性
与盐酸反应的离子方程式
+2
+3
+2、+3
不溶
不溶
不溶
FeO + 2HCl═
FeCl2+ H2O
Fe2O3 + 6HCl ═
2FeCl3+ 3H2O
黑色粉末
红棕色粉末
黑色晶体
FeO
Fe2O3
Fe3O4
1、铁的氧化物
(1)铁的氧化物的比较
碱性氧化物
碱性氧化物
Fe3O4 + 8HCl
═FeCl2+2FeCl3
+ 4H2O
Ⅰ. 作为冶炼金属的原料,如赤铁矿
Fe2O3+3CO ═ 2 Fe+3CO2
Ⅱ. 氧化铁常用于作油漆和涂料、油墨和橡胶的红色颜料。
高温
(2)铁的氧化物的用途
方案一:通过铁和水反应得到
方案二:通过铁的氧化物和水反应得到
方案二:用可溶性铁盐、亚铁盐与碱溶液反应得到
如何制备铁的两种氢氧化物?
Fe(OH)2 Fe(OH)3
思考交流:
铁有哪些氢氧化物?
加NaOH溶液
离子方程式
FeCl3溶液
FeSO4溶液
生成红褐色沉淀
Fe3++3OH- = Fe(OH)3↓
先生成白色絮状沉淀,后迅速变为灰绿色,最后变为红褐色沉淀
Fe2++2OH- = Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
实验3-1:71页
FeCl3+3NaOH = Fe(OH)3↓+3NaCl
FeSO4+2NaOH = Fe(OH)2↓+2NaSO4
既然Fe(OH)2 容易被空气中的氧气氧化,那么在制备Fe(OH)2时,应采取怎样操作方法更好
煮沸
FeSO4溶液
NaOH溶液
FeSO4溶液
NaOH
溶液
植物油、汽油、煤油或……
1. 新配置的FeSO4溶液
2.不含O2的蒸馏水配制的NaOH、FeSO4溶液
止水夹
稳定性
Fe(OH)2
Fe(OH)3
颜色、状态
与酸反应
溶解性
红褐色固体
白色固体
不溶于水
不溶于水
2Fe(OH)3 = Fe2O3+ 3H2O
不稳定,产物复杂
(2)氢氧化物的性质P72
Fe(OH)3+3HCl=FeCl3+3H2O
Fe(OH)2+2HCl=FeCl2+2H2O
常见的铁盐
3、铁盐(Fe 3+)和亚铁盐(Fe 2+)
Fe2(SO4)3、FeCl3、Fe(NO3)3
常见的亚铁盐
FeSO4、FeCl2、Fe(NO3)2
向FeCl3和FeCl2溶液中分别加入KSCN溶液
交流和讨论:
有哪些方法可以鉴别FeCl3溶液和FeCl2溶液
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液变成红色
无明显变化
(硫氰化钾)
Fe3+ + 3SCN- = Fe(SCN)3
取上一步实验所得的
上层清液加入氯水
FeCl3溶液加入Fe粉,后加入KSCN溶液
(4) Fe2+和Fe3+的相互转化
2Fe3+ + Fe = 3Fe2+
溶液不显红色
溶液变成红色
2Fe2+ + Cl2 = 2Fe3+ +2Cl
2FeCl3 + Fe = 3FeCl2
2FeCl2+Cl2=2FeCl3
加入铁粉
如何防止FeCl2溶液变质为FeCl3
2FeCl3 + Cu = 2FeCl2+CuCl2
铜与FeCl3反应:
(制电路板原理)
2FeCl3 + Fe = 3FeCl2
高价氧化,低价还
1、Fe只作还原剂
2、Fe3+只作氧化剂
3、Fe2+既可作氧化剂、也可作还原剂
Fe + 2H2SO4 = FeSO4 + H2↑
Fe + Fe2(SO4)3 = 3FeSO4
Zn + FeSO4 = Fe + ZnSO4
2FeCl2 + Cl2 = 2FeCl3
氧化剂
还原剂
Cl2 O2 Cu Fe
常作氧化剂的有:
常作还原剂的有:
Fe2+
Fe3+
Cu Fe
Cl2 O2
Cl2 O2
Cu Fe
归纳总结:
还原剂
氧化剂
(3)铁(+3)盐和亚铁(+2)盐的相互转换
从氧化性、还原性的角度考虑Fe2+、Fe3+、应如何转换?
Fe2+
Fe3+
Cl2、Br2、HNO3、H2O2、KMnO4等强氧化剂
金属单质(Zn到Cu)、H2S、S2-、I- 等强还原剂
铁三角关系:
Fe2+
Fe3+
Fe
Cl2、Br2、HNO3等强氧化剂
Cl2、Br2、HNO3、H2O2、KMnO4
金属单质(Zn到Cu)、H2S、S2-、I- 等还原剂
金属单质、H2、CO等还原剂
S、I2、非氧化性酸弱氧化剂
金属单质、H2、CO等还原剂
0
+3
+2
盐
氢氧化物
氧化物
Fe2+
Fe(OH)2
FeO
Fe3+
Fe(OH)3
Fe2O3
Fe
单质
认知模型
FeO
Fe2O3
Fe
氧化物
单质
Fe3O4
1、将钠投入到FeCl2溶液中,可观察到的现象是( )
A.最终生成白色沉淀
B.最终生成红褐色沉淀
C.有黄绿色气体产生
D.无变化
B
【课堂检测】
2、证明某溶液只含有Fe2+而不含Fe3+的实验方法是( )
A、先滴加氯水,再滴加KSCN溶液后显红色
B、先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C、滴加NaOH溶液,先产生白色沉淀,后变为灰绿色,最后变为红褐色
D、只需滴加KSCN溶液
B
3、室温下, A是常见的金属单质、单质B是黄绿色气体、单质C是无色气体; E溶液是无色溶液, F是浅绿色溶液, B和C反应发出苍白色火焰。在适当反应条件下,它们可以按下面框图进行反应。请回答:
1. A是_____ ,B是_____ ,C是____ (填写化学式) 。
