3.2.1金属材料 课件(共34张PPT) 第一课时高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 3.2.1金属材料 课件(共34张PPT) 第一课时高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-19 00:00:00 | ||
图片预览











文档简介
(共34张PPT)
第二节 金属材料
第1课时 铁合金 铝和铝合金 新型合金
【阅读思考】
阅读课本78-79页,回答以下问题:
1、合金的定义、特性
2、铁合金有哪几种?
3、生铁的组成、性能、用途分别是什么?
4、钢的分为哪几类?分类依据是什么?
5、高碳钢、中碳钢、低碳钢的组成、性能、用途是怎样的?
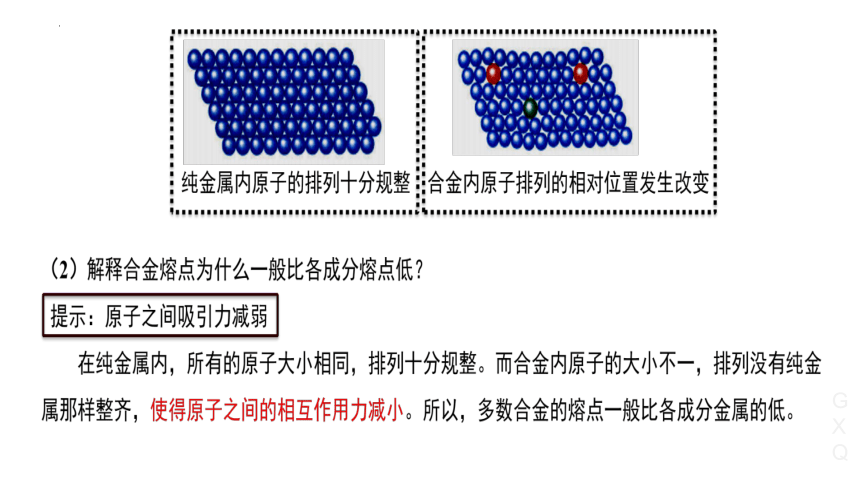
1、合金:两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
2、特性:合金具有许多优良的物理、化学或机械性能。
◇ 硬度大于各成分金属
◇ 熔点低
一般:
◇ 强度大
◇ 抗腐蚀性能大
认识合金的常见误区
(1)误认为合金都是由金属构成的。事实上,凡是在金属中加入某些金属或非金属而得到的具有金属特性的物质都是合金;尽管合金的许多性能都优于纯金属,但并不是说其所有性能都比纯金属要好,要根据实际需要,灵活选择使用纯金属或合金。
(2)以为金属材料都是由金属单质制成的。实际上,很多金属材料都是合金,合金具有较纯金属更广阔的应用范围。
(3)合金不一定是固态。如用作原子反应堆导热剂的钠—钾合金,常温下为液态。
生铁
钢
含碳量在2%~4.3%之间,还含硅、锰及少量硫、磷
碳素钢
{
低碳钢
(含碳0.3%~0.6%)
高碳钢
(含碳<0.3%)
中碳钢
(含碳0.6%~2% )
合金钢(特种钢):在碳素钢中加入铬、锰、钨、镍、钼、钴等元素
根据含碳量
一、铁合金
不锈钢是一种常见的合金钢,合金元素主要是铬、镍
二、铝和铝合金
铝在历史上曾非常稀有,因而也极其贵重。100多年前,为了表彰门捷列夫对化学的杰出贡献,英国皇家学会不惜重金制作了一个比黄金还要贵重的奖杯──铝杯,赠送给门捷列夫。法国皇帝拿破仑三世为了显示自己的尊贵,用铝做了一顶头盔,成为轰动一时的新闻。每逢盛大国宴,别人都用银制餐具,而他独自使用一套铝制餐具。这都说明在100多年前,铝是一种极其昂贵的“稀有金属”。
铝是地壳中含量最多的金属元素
铝的原子结构示意图
+13
2
8
3
1、铝
(1)物理性质
颜色 状态 熔点 密度 导电导热性 延展性
_____色 ___体 较___ 较___ _____ _____
①与氧气反应
4Al + 3O2 = 2Al2O3
(2)化学性质
致密的保护膜
2Al +6HCl =2AlCl3 + 3H2↑
现象:气泡产生,点燃有爆鸣声(或有淡蓝色火焰)。
2Al +6HCl =2AlCl3 + 3H2↑
Al2O3 +6HCl = 2AlCl3 + 3H2O
问题:铝表面的氧化铝保护膜怎么没起保护作用?
现象:打磨过铝片的试管中立即产生气泡;未打磨过的铝片的试管中开始没有气泡,一段时间后才产生气泡。两支试管均放出可燃性气体。
结论:
2Al + 2OH- + 2H2O = 2AlO2- + 3H2 ↑
铝的两性:既能与酸反应,又能与强碱反应
①与酸反应(HNO3和浓H2SO4除外):
2Al+6HCl = 2AlCl3 + 3H2↑
2Al + 6H+ = 2Al3+ + 3H2↑
②与强碱溶液反应:
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
2Al + 2OH- + 2H2O = 2AlO2- + 3H2 ↑
2Al —6H+ —3H2
2Al —2OH- —3H2
2、三氧化二铝 Al2O3
1.铝的氧化物—Al2O3
物理性质:白色固体,难溶于水,熔点高,也很坚固,可作耐火材料———耐火坩埚、耐高温的实验仪器(红宝石、蓝宝石的主要成分).
1、与酸反应:
Al2O3 +6HCl = 2AlCl3 + 3H2O
2、与碱反应:
Al2O3 + 2NaOH = 2NaAlO2 + H2O
两性氧化物:既能跟酸反应生成盐和水,又能跟碱反应生成盐和水的氧化物。
化学性质:
氧化铝是两性氧化物
Al2O3 +6H+ = 2Al3+ + 3H2O
Al2O3 + 2OH- = 2AlO2- + H2O
3、铝合金
纯铝的硬度和强度较小
铝合金 :向铝中加入少量合金元素,如Cu、Mg、
Si、Mn、Zn及稀土元素等,可制成合金。
硬铝:
成分:Cu4%、Mg0.5%、Mn0.5%、Si0.7%
性能:密度小、强度高、具有较强的抗腐蚀能力
用途:制飞机、宇宙飞船
三、新型合金
储氢合金
钛合金
钛被称为继铁、铝之后的第三金属,
也有人说“21世纪将是钛的世纪”。
钛的化学性质:
稳定,耐腐蚀。
未来金属—钛
民
航
飞
机
由于钛的密度小、强度高、抗腐蚀性强,是制造超音速飞机的理想材料,用于制造飞机的机翼骨架、蒙皮、机身板、机身骨架、发动机舱、起落架等。
耐热合金 钴镍合金
形状记忆合金:具有形状记忆效应(shape memory effect),以记忆合金制成的弹簧为例,把这种弹簧放在热水中,弹簧的长度立即伸长,再放到冷水中,它会立即恢复原状。利用形状记忆合金弹簧可以控制浴室水管的水温:在热水温度过高时通过记忆功能,调节或关闭供水管道,避免烫伤。
课堂小结
一、铁合金
1. 合金
2. 生铁和钢
二、铝和铝合金
1. 铝
2. 氧化铝
3. 铝合金
三、新型合金
1. 储氢合金
2. 钛合金
3. 耐热合金 钴镍合金
4. 形状记忆合金
1、下列合金的说法中,正确的是( )
A. 合金的熔点一定比各成分金属的低
B. 在我国使用最早的合金是钢
C. 生铁的含碳量为0.03%-2%
D. 稀土金属可以用于生产合金
D
课堂练习
2、下列关于铝的说法中,正确的是( )
A、铝的化学性质不活泼
B、铝不与酸、碱反应
C、常温下铝不与氧气反应
D、铝表面容易生成一层致密的氧化铝保护膜
D
3、向一个铝质易拉罐中充满CO2,然后往罐中注入足量的浓NaOH溶液,立即用胶布封严罐口。一会听到罐内发出“咔、咔”的响声,且易拉罐变瘪;再过一会儿易拉罐又鼓起来恢复原样。
(1)易拉罐变瘪的原因是 , 反应的离子方程式 .
(2)易拉罐又鼓起来的原因是 ,反应的离子方程式 .
NaOH溶液与CO2气体反应,
导致易拉罐内压强变小
CO2+2OH- =CO32- + H2O
Al与NaOH溶液产生H2 易拉罐内压强又变大
2Al+2OH- +2H2O=2AlO2- +3H2 ↑
2.氢氧化铝
(1)氢氧化铝的制备
实验方案Ⅱ: Al2(SO4)3溶液 + NaOH溶液
想一想:制备Al(OH)3 ,可选用什么试剂?
实验方案Ⅲ: Al2(SO4)3溶液 + 氨水
Al(OH)3沉淀不溶于氨水(弱碱)
实验3-7: 在试管里加入10mL 0.5mol/L Al2(SO4)3溶液 ,滴加氨水,生成白色胶状物质。继续滴加氨水,直到不再产生沉淀为止。再加入过量氨水观察沉淀是否溶解。
Al2(SO4)3+6NH3 H2O=2Al(OH)3↓ +3(NH4)2SO4
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
实验方案I: Al2O3 + 水
a.物理性质:
白色胶状物质,不溶于水,有强的吸附性,
能凝聚水中的悬浮物,并能吸附色素,可用于净水。
(2)氢氧化铝的主要性质:
氢氧化铝属于两性氢氧化物。
氢氧化铝不溶于弱酸、弱碱,能溶解在强酸、强碱中。
1.与酸反应:Al(OH)3+3HCl=AlCl3+3H2O
2.与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2O
偏铝酸钠
化学性质:
实验
两性氢氧化物:既能跟酸反应生成盐和水,
又能跟碱反应生成盐和水的氢氧化物
2Al(OH)3 = Al2O3+3H2O
Δ
请设计实验证明明矾成分和性质:
1、晶体中含有K+的实验:
2、晶体中含有水的实验:
3、晶体中含有Al3+的实验为
4、晶体中含有SO42-的实验为
5、溶液是否有胶体存在的实验为
KAl(SO4)2·12H2O(明矾)
无水硫酸铜变蓝
加入过量的氢氧化钠溶液,先有白色沉淀后消失
先加盐酸,再加氯化钡溶液,有白色沉淀生成
用激光照射,有光亮的通路(丁达尔效应)
灼烧,透过蓝色钴玻璃火焰为紫色(焰色反应)
Al
Al2O3
Al(OH)3
Al3+
AlO2
.
Al3+ Al(OH)3 :
OH- 、NH3·H2O 、AlO2-
H+ 、 CO2 、Al3+
AlO2- Al(OH)3 :
* 4.铝及其化合物的转化关系(铝三角关系):
[问题]
本转化关系的核心知识是什么
答:
氧化铝和氢氧化铝的两性。
Al3+:显弱酸性
AlO2- :显弱碱性
第二节 金属材料
第1课时 铁合金 铝和铝合金 新型合金
【阅读思考】
阅读课本78-79页,回答以下问题:
1、合金的定义、特性
2、铁合金有哪几种?
3、生铁的组成、性能、用途分别是什么?
4、钢的分为哪几类?分类依据是什么?
5、高碳钢、中碳钢、低碳钢的组成、性能、用途是怎样的?
1、合金:两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
2、特性:合金具有许多优良的物理、化学或机械性能。
◇ 硬度大于各成分金属
◇ 熔点低
一般:
◇ 强度大
◇ 抗腐蚀性能大
认识合金的常见误区
(1)误认为合金都是由金属构成的。事实上,凡是在金属中加入某些金属或非金属而得到的具有金属特性的物质都是合金;尽管合金的许多性能都优于纯金属,但并不是说其所有性能都比纯金属要好,要根据实际需要,灵活选择使用纯金属或合金。
(2)以为金属材料都是由金属单质制成的。实际上,很多金属材料都是合金,合金具有较纯金属更广阔的应用范围。
(3)合金不一定是固态。如用作原子反应堆导热剂的钠—钾合金,常温下为液态。
生铁
钢
含碳量在2%~4.3%之间,还含硅、锰及少量硫、磷
碳素钢
{
低碳钢
(含碳0.3%~0.6%)
高碳钢
(含碳<0.3%)
中碳钢
(含碳0.6%~2% )
合金钢(特种钢):在碳素钢中加入铬、锰、钨、镍、钼、钴等元素
根据含碳量
一、铁合金
不锈钢是一种常见的合金钢,合金元素主要是铬、镍
二、铝和铝合金
铝在历史上曾非常稀有,因而也极其贵重。100多年前,为了表彰门捷列夫对化学的杰出贡献,英国皇家学会不惜重金制作了一个比黄金还要贵重的奖杯──铝杯,赠送给门捷列夫。法国皇帝拿破仑三世为了显示自己的尊贵,用铝做了一顶头盔,成为轰动一时的新闻。每逢盛大国宴,别人都用银制餐具,而他独自使用一套铝制餐具。这都说明在100多年前,铝是一种极其昂贵的“稀有金属”。
铝是地壳中含量最多的金属元素
铝的原子结构示意图
+13
2
8
3
1、铝
(1)物理性质
颜色 状态 熔点 密度 导电导热性 延展性
_____色 ___体 较___ 较___ _____ _____
①与氧气反应
4Al + 3O2 = 2Al2O3
(2)化学性质
致密的保护膜
2Al +6HCl =2AlCl3 + 3H2↑
现象:气泡产生,点燃有爆鸣声(或有淡蓝色火焰)。
2Al +6HCl =2AlCl3 + 3H2↑
Al2O3 +6HCl = 2AlCl3 + 3H2O
问题:铝表面的氧化铝保护膜怎么没起保护作用?
现象:打磨过铝片的试管中立即产生气泡;未打磨过的铝片的试管中开始没有气泡,一段时间后才产生气泡。两支试管均放出可燃性气体。
结论:
2Al + 2OH- + 2H2O = 2AlO2- + 3H2 ↑
铝的两性:既能与酸反应,又能与强碱反应
①与酸反应(HNO3和浓H2SO4除外):
2Al+6HCl = 2AlCl3 + 3H2↑
2Al + 6H+ = 2Al3+ + 3H2↑
②与强碱溶液反应:
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
2Al + 2OH- + 2H2O = 2AlO2- + 3H2 ↑
2Al —6H+ —3H2
2Al —2OH- —3H2
2、三氧化二铝 Al2O3
1.铝的氧化物—Al2O3
物理性质:白色固体,难溶于水,熔点高,也很坚固,可作耐火材料———耐火坩埚、耐高温的实验仪器(红宝石、蓝宝石的主要成分).
1、与酸反应:
Al2O3 +6HCl = 2AlCl3 + 3H2O
2、与碱反应:
Al2O3 + 2NaOH = 2NaAlO2 + H2O
两性氧化物:既能跟酸反应生成盐和水,又能跟碱反应生成盐和水的氧化物。
化学性质:
氧化铝是两性氧化物
Al2O3 +6H+ = 2Al3+ + 3H2O
Al2O3 + 2OH- = 2AlO2- + H2O
3、铝合金
纯铝的硬度和强度较小
铝合金 :向铝中加入少量合金元素,如Cu、Mg、
Si、Mn、Zn及稀土元素等,可制成合金。
硬铝:
成分:Cu4%、Mg0.5%、Mn0.5%、Si0.7%
性能:密度小、强度高、具有较强的抗腐蚀能力
用途:制飞机、宇宙飞船
三、新型合金
储氢合金
钛合金
钛被称为继铁、铝之后的第三金属,
也有人说“21世纪将是钛的世纪”。
钛的化学性质:
稳定,耐腐蚀。
未来金属—钛
民
航
飞
机
由于钛的密度小、强度高、抗腐蚀性强,是制造超音速飞机的理想材料,用于制造飞机的机翼骨架、蒙皮、机身板、机身骨架、发动机舱、起落架等。
耐热合金 钴镍合金
形状记忆合金:具有形状记忆效应(shape memory effect),以记忆合金制成的弹簧为例,把这种弹簧放在热水中,弹簧的长度立即伸长,再放到冷水中,它会立即恢复原状。利用形状记忆合金弹簧可以控制浴室水管的水温:在热水温度过高时通过记忆功能,调节或关闭供水管道,避免烫伤。
课堂小结
一、铁合金
1. 合金
2. 生铁和钢
二、铝和铝合金
1. 铝
2. 氧化铝
3. 铝合金
三、新型合金
1. 储氢合金
2. 钛合金
3. 耐热合金 钴镍合金
4. 形状记忆合金
1、下列合金的说法中,正确的是( )
A. 合金的熔点一定比各成分金属的低
B. 在我国使用最早的合金是钢
C. 生铁的含碳量为0.03%-2%
D. 稀土金属可以用于生产合金
D
课堂练习
2、下列关于铝的说法中,正确的是( )
A、铝的化学性质不活泼
B、铝不与酸、碱反应
C、常温下铝不与氧气反应
D、铝表面容易生成一层致密的氧化铝保护膜
D
3、向一个铝质易拉罐中充满CO2,然后往罐中注入足量的浓NaOH溶液,立即用胶布封严罐口。一会听到罐内发出“咔、咔”的响声,且易拉罐变瘪;再过一会儿易拉罐又鼓起来恢复原样。
(1)易拉罐变瘪的原因是 , 反应的离子方程式 .
(2)易拉罐又鼓起来的原因是 ,反应的离子方程式 .
NaOH溶液与CO2气体反应,
导致易拉罐内压强变小
CO2+2OH- =CO32- + H2O
Al与NaOH溶液产生H2 易拉罐内压强又变大
2Al+2OH- +2H2O=2AlO2- +3H2 ↑
2.氢氧化铝
(1)氢氧化铝的制备
实验方案Ⅱ: Al2(SO4)3溶液 + NaOH溶液
想一想:制备Al(OH)3 ,可选用什么试剂?
实验方案Ⅲ: Al2(SO4)3溶液 + 氨水
Al(OH)3沉淀不溶于氨水(弱碱)
实验3-7: 在试管里加入10mL 0.5mol/L Al2(SO4)3溶液 ,滴加氨水,生成白色胶状物质。继续滴加氨水,直到不再产生沉淀为止。再加入过量氨水观察沉淀是否溶解。
Al2(SO4)3+6NH3 H2O=2Al(OH)3↓ +3(NH4)2SO4
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
实验方案I: Al2O3 + 水
a.物理性质:
白色胶状物质,不溶于水,有强的吸附性,
能凝聚水中的悬浮物,并能吸附色素,可用于净水。
(2)氢氧化铝的主要性质:
氢氧化铝属于两性氢氧化物。
氢氧化铝不溶于弱酸、弱碱,能溶解在强酸、强碱中。
1.与酸反应:Al(OH)3+3HCl=AlCl3+3H2O
2.与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2O
偏铝酸钠
化学性质:
实验
两性氢氧化物:既能跟酸反应生成盐和水,
又能跟碱反应生成盐和水的氢氧化物
2Al(OH)3 = Al2O3+3H2O
Δ
请设计实验证明明矾成分和性质:
1、晶体中含有K+的实验:
2、晶体中含有水的实验:
3、晶体中含有Al3+的实验为
4、晶体中含有SO42-的实验为
5、溶液是否有胶体存在的实验为
KAl(SO4)2·12H2O(明矾)
无水硫酸铜变蓝
加入过量的氢氧化钠溶液,先有白色沉淀后消失
先加盐酸,再加氯化钡溶液,有白色沉淀生成
用激光照射,有光亮的通路(丁达尔效应)
灼烧,透过蓝色钴玻璃火焰为紫色(焰色反应)
Al
Al2O3
Al(OH)3
Al3+
AlO2
.
Al3+ Al(OH)3 :
OH- 、NH3·H2O 、AlO2-
H+ 、 CO2 、Al3+
AlO2- Al(OH)3 :
* 4.铝及其化合物的转化关系(铝三角关系):
[问题]
本转化关系的核心知识是什么
答:
氧化铝和氢氧化铝的两性。
Al3+:显弱酸性
AlO2- :显弱碱性
