1.2.1电解质的电离 课件(共38张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2.1电解质的电离 课件(共38张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 8.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-19 20:37:56 | ||
图片预览








文档简介
(共38张PPT)
第一章 物质及其变化
1.2.1 电解质的电离
情境导入
导入
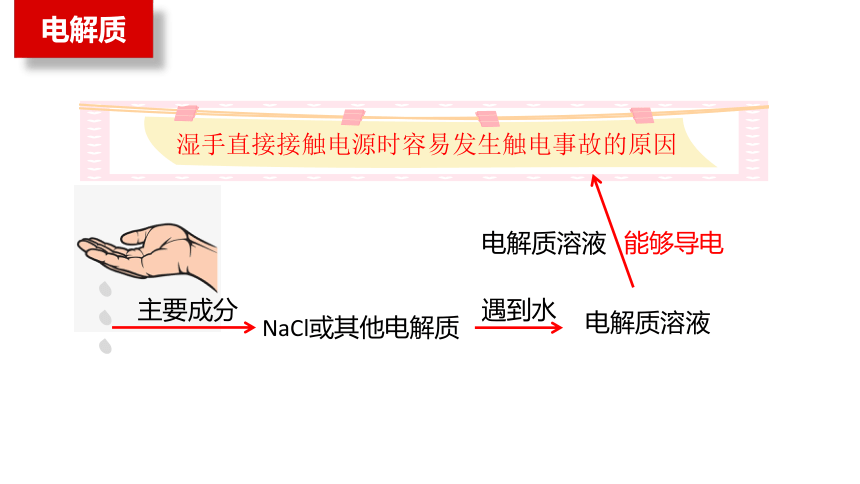
为什么湿手直接接触电源时容易发生触电事故?
只是因为有水吗?
实验1-2
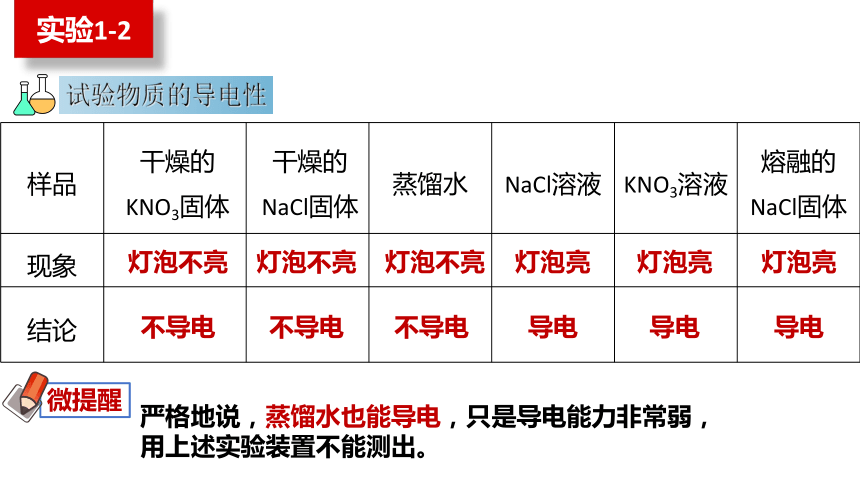
在三个烧杯中分别加入干燥的NaCl固体、KNO3固体和蒸馏水,如图所示连接装置,将石墨电极依次放入三个烧杯中,分别接通电源,观察并记录现象。
取上述烧杯中的NaCl固体、KNO3固体各少许,分别加入另外两个盛有蒸馏水的烧杯中,用玻璃棒搅拌,使固体完全溶解形成溶液。如图所示,将石墨电极依次放入NaCl溶液、 KNO3溶液,分别接通电源,观察并记录现象。
实验1-2
试验物质的导电性
样品 干燥的KNO3固体 干燥的NaCl固体 蒸馏水 NaCl溶液 KNO3溶液 熔融的NaCl固体
现象
结论
灯泡不亮
灯泡不亮
灯泡不亮
灯泡亮
灯泡亮
不导电
不导电
不导电
导电
导电
灯泡亮
导电
严格地说,蒸馏水也能导电,只是导电能力非常弱,用上述实验装置不能测出。
微提醒
1.2.1 电解质的电离
一、电解质的电离
1、电解质:
在水溶液或熔融态下能够导电的化合物。
条 件
物质类别
酸
碱
eg:HCl、H2SO4、CH3COOH等
eg:NaOH、Ba(OH)2、NH3 H2O等
eg:NaCl、BaSO4、(NH4)2SO4等
eg:Na2O、MgO、CaO等
eg:NaH、CaH2等
盐
活泼金属氧化物
活泼金属氢化物
H2O
2、非电解质:
在水溶液和熔融态下均不导电的化合物。
条 件
eg:CO2、SO3、
eg:CH4、C2H5OH、C6H12O6等
eg:NH3、N2H4等
物质类别
非金属氧化物
非金属氢化物
大部分有机物
水
熔融态
水和
熔融态
NO2等
本身
电解质
NaCl或其他电解质
主要成分
湿手直接接触电源时容易发生触电事故的原因
遇到水
电解质溶液
电解质溶液 能够导电
辨 析
1、一个物质的水溶液可以导电,那这个物质一定是电解质吗?
2、一个物质的水溶液不可以导电,那这个物质一定不是电解质吗?
3、能导电的物质一定是电解质吗?
混合物
电解质
CO2、SO2
金属、石墨、半导体
酸、碱、盐(易溶于水)的水溶液
熔融盐、熔融碱、熔融活泼金属氧化物
能导电的物质:
单质
BaSO4
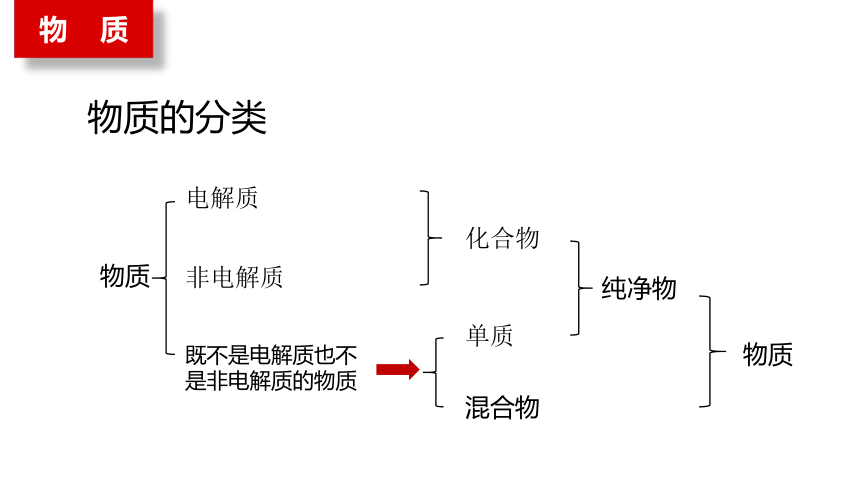
物 质
物质的分类
混合物
纯净物
化合物
单质
电解质
非电解质
物质
既不是电解质也不是非电解质的物质
物质
1.2.1 电解质的电离
一、电解质的电离
1、电解质:
在水溶液或熔融态下能够导电的化合物。
条 件
物质类别
酸
碱
eg:HCl、H2SO4、CH3COOH等
eg:NaOH、Ba(OH)2、NH3 H2O等
eg:NaCl、BaSO4、(NH4)2SO4等
eg:Na2O、MgO、CaO等
eg:NaH、CaH2等
盐
活泼金属氧化物
活泼金属氢化物
H2O
2、非电解质:
在水溶液和熔融态下均不导电的化合物。
条 件
eg:CO2、SO3、
eg:CH4、C2H5OH、C6H12O6等
eg:NH3、N2H4等
物质类别
非金属氧化物
非金属氢化物
大部分有机物
水
熔融态
水和
熔融态
NO2等
本身
思 考 1
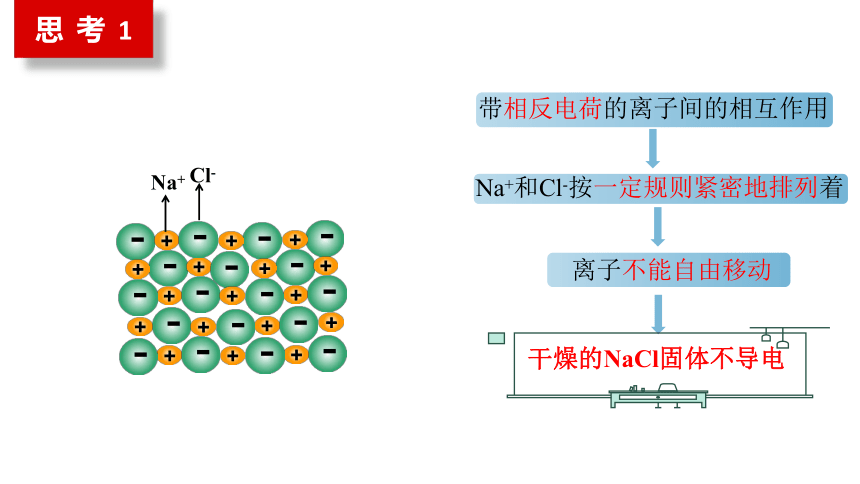
Q1:为什么NaCl、KNO3固体不导电,但它溶于水或变成熔融态之后就能导电了呢?
导 电
有能自由移动的带电微粒
实 质
碱和盐本身由离子构成
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
-
+
+
-
-
+
-
Na+
Cl-
带相反电荷的离子间的相互作用
Na+和Cl-按一定规则紧密地排列着
离子不能自由移动
干燥的NaCl固体不导电
思 考 1
NaCl、KNO3固体不导电
熔融状态的NaCl、KNO3能导电
思 考 1
NaCl、KNO3固体不导电
无自由移动离子
熔融状态的NaCl、KNO3能导电
有自由移动离子
思 考 1
Q1:为什么NaCl、KNO3固体不导电,但它溶于水或变成熔融态之后就能导电了呢?
Q2: NaCl与H2O之间到底发生了怎样的相互作用?
才使得原本不能自由移动的钠离子和氯离子可以自由移动的呢?
碱和盐本身由离子构成
思 考 1
思 考 1
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
Na+
Cl-
H2O
将NaCl固体加入水中
思 考 1
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
在水分子 的作用下
将NaCl固体加入水中
思 考 1
在水分子 的作用下
进入水中
将NaCl固体加入水中
Na+和Cl-脱离NaCl固体的表面
形成能够自由移动的水合钠离子和水合氯离子
-
+
-
-
-
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
思 考 1
NaCl、KNO3固体不导电
NaCl、KNO3溶液能导电
无自由移动离子
有自由移动离子
思 考 1
1.2.1 电解质的电离
一、电解质的电离
1、电解质:
在水溶液或熔融态下能够导电的化合物。
条 件
物质类别
酸
碱
eg:HCl、H2SO4、CH3COOH等
eg:NaOH、Ba(OH)2、NH3 H2O等
eg:NaCl、BaSO4、(NH4)2SO4等
eg:Na2O、MgO、CaO等
eg:NaH、CaH2等
盐
活泼金属氧化物
活泼金属氢化物
H2O
2、非电解质:
在水溶液和熔融态下均不导电的化合物。
条 件
eg:CO2、SO3、
eg:CH4、C2H5OH、C6H12O6等
eg:NH3、N2H4等
物质类别
非金属氧化物
非金属氢化物
大部分有机物
水
熔融态
水和
熔融态
NO2等
本身
Q3:为什么Na2O、NaH固体能在熔融态下导电呢?
活泼金属氧化物和活泼金属氢化物本身由离子构成
思 考 2
1.2.1 电解质的电离
一、电解质的电离
1、电解质:
在水溶液或熔融态下能够导电的化合物。
条 件
物质类别
酸
碱
eg:HCl、H2SO4、CH3COOH等
eg:NaOH、Ba(OH)2、NH3 H2O等
eg:NaCl、BaSO4、(NH4)2SO4等
eg:Na2O、MgO、CaO等
eg:NaH、CaH2等
盐
活泼金属氧化物
活泼金属氢化物
H2O
2、非电解质:
在水溶液和熔融态下均不导电的化合物。
条 件
eg:CO2、SO3、
eg:CH4、C2H5OH、C6H12O6等
eg:NH3、N2H4等
物质类别
非金属氧化物
非金属氢化物
大部分有机物
水
熔融态
水和
熔融态
NO2等
本身
Q4:为什么HCl能在水溶液中导电而在熔融状态下就不导电呢?
酸本身由分子构成
思 考 3
Q5: HCl与H2O之间到底发生了怎样的相互作用?
才使得原本没有带电微粒的氯化氢分子变成可以自由移动的离子呢?
思 考 3
H
Cl
H2O
将HCl加入水中
思 考 3
在水分子 的作用下
将HCl加入水中
思 考 3
在水分子 的作用下
进入水中
将HCl加入水中
H和Cl脱离HCl的表面
形成能够自由移动的水合氢离子和水合氯离子
-
+
思 考 3
1.2.1 电解质的电离
一、电解质的电离
2、电离:
电解质溶于水或受热熔化时,形成自由移动的离子的过程叫做电离。
水分子作用
破坏了离子之间的相互作用
思 考 4
Q6:先电离后导电?Or 先通电后电离?
导 电
有能自由移动的带电微粒
实 质
电 流
带电微粒的定向移动
实 质
在水分子 的作用下
进入水中
将NaCl固体加入水中
Na+和Cl-脱离NaCl固体的表面
形成能够自由移动的水合钠离子和水合氯离子
-
+
-
+
与电源正极相连的电极
与电源负极相连的电极
带正电荷的水合钠离子向与电源负极相连的电极移动
当在NaCI溶液 中插入电极并接通电源
带负电荷的水合氯离子向与电源正极相连的电极移动
思 考 4
1.2.1 电解质的电离
一、电解质的电离
2、电离:
电解质溶于水或受热熔化时,形成自由移动的离子的过程叫做电离。
先电离
后导电
有电流
通电源
水分子作用
破坏了离子之间的相互作用
方法导引
模型
在对研究对象进行实验观察和证据推理的基础上,利用简化、抽象和类比等方法,将反应研究对象的本质特征形成一种概括性的描述和认识思路,这就是模型。模型在科学认识中具有描述、解释和预测等功能,是理论发展的一种重要方式。
化学中的模型有实物模型、理论模型等,其中,理论模型应用范围最广。例如,十九世纪后期,瑞典化学家阿伦尼乌斯在前人研究的基础上,通过研究电解质稀溶液的导电性等,提出了电离模型,即电解质溶于水会自动解离成离子,而不是当时流行的说法——离子是通电后才产生的,并对电解质的电离进行了定量计算。电离模型很好地解释了酸、碱、盐溶液的某些性质,如酸、碱的强度等,因此发展成为近代的电离理论。阿伦尼乌斯也因此获得1903年诺贝尔化学奖。
1.2.1 电解质的电离
一、电解质的电离
2、电离:
电解质溶于水或受热熔化时,形成自由移动的离子的过程叫做电离。
先电离
后导电
有电流
通电源
水分子作用
破坏了离子之间的相互作用
3、电离方程式
NaCl =
Na+ + Cl-
KNO3 =
K+ + NO3-
遵循质量守恒、电荷守恒
原子团不能拆开写
任 务
H2SO4 =
HNO3 =
HCl =
2 H+ + SO42-
H+ + NO3-
H+ + Cl-
KOH =
Ba(OH)2 =
NaOH =
K+ + OH-
Ba2+ + 2OH-
Na+ + OH-
BaSO4 =
CaCl2 =
NaHSO4 =
SO42-
+ H+ +
Na+
Na2CO3 =
2Na+ + CO32-
Ba2+ + SO42-
Ca2+ + 2Cl-
请写出H2SO4、HNO3、HCl、KOH、 Ba(OH)2 、 NaOH 、 Na2CO3 、 BaSO4 、 CaCl2 、 NaHCO3的电离方程式。
1.2.1 电解质的电离
一、电解质的电离
2、电离:
电解质溶于水或受热熔化时,形成自由移动的离子的过程叫做电离。
先电离
后导电
有电流
通电源
水分子作用
破坏了离子之间的相互作用
3、电离方程式
NaCl =
Na+ + Cl-
KNO3 =
K+ + NO3-
遵循质量守恒、电荷守恒
原子团不能拆开写
酸:电离时生成的阳离子全部是氢离子的化合物
碱:电离时生成的阴离子全部是氢氧根离子的化合物
盐:电离时能够生成对应的阳离子和阴离子,且阳离子不是氢离子或不完全是氢离子,阴离子不是氢氧根离子或不全是氢氧根离子的化合物
课堂练习
1.下列哪些物质是电解质?
下列哪些物质是非电解质?
下列哪些物质既不是电解质又不是非电解质?
氯化氢、NO、氯化钠固体、氨水、H2CO3、CO2、酒精、Cl2
氯化氢、氯化钠固体、H2CO3
NO、酒精、CO2
Cl2、氨水
课堂练习
2.下列物质________________________________________能导电?
________________________________________是电解质?
________________________________________是非电解质?
(1)金属铜 (2)碳棒 (3)O2 (4)H2SO4 (5)液态HCl (6)CH3COOH
(7)葡萄糖 (8)固态NaCl (9)CaCO3固体 (10)CuSO4·5H2O
(11)熔融状态的KNO3 (12)KOH水溶液 (13)酒精水溶液
(14)盐酸 (15)CaO (16)CO2 (17)H2O (18)NH3
(1)、(2)、(11)、(12)、(14)、(17)
(4)、(5)、(6)、(8)、(9)、(10)、(11)、(15)
(7)、(16)、(18)
感谢聆听!
CHEMISTRY
第一章 物质及其变化
1.2.1 电解质的电离
情境导入
导入
为什么湿手直接接触电源时容易发生触电事故?
只是因为有水吗?
实验1-2
在三个烧杯中分别加入干燥的NaCl固体、KNO3固体和蒸馏水,如图所示连接装置,将石墨电极依次放入三个烧杯中,分别接通电源,观察并记录现象。
取上述烧杯中的NaCl固体、KNO3固体各少许,分别加入另外两个盛有蒸馏水的烧杯中,用玻璃棒搅拌,使固体完全溶解形成溶液。如图所示,将石墨电极依次放入NaCl溶液、 KNO3溶液,分别接通电源,观察并记录现象。
实验1-2
试验物质的导电性
样品 干燥的KNO3固体 干燥的NaCl固体 蒸馏水 NaCl溶液 KNO3溶液 熔融的NaCl固体
现象
结论
灯泡不亮
灯泡不亮
灯泡不亮
灯泡亮
灯泡亮
不导电
不导电
不导电
导电
导电
灯泡亮
导电
严格地说,蒸馏水也能导电,只是导电能力非常弱,用上述实验装置不能测出。
微提醒
1.2.1 电解质的电离
一、电解质的电离
1、电解质:
在水溶液或熔融态下能够导电的化合物。
条 件
物质类别
酸
碱
eg:HCl、H2SO4、CH3COOH等
eg:NaOH、Ba(OH)2、NH3 H2O等
eg:NaCl、BaSO4、(NH4)2SO4等
eg:Na2O、MgO、CaO等
eg:NaH、CaH2等
盐
活泼金属氧化物
活泼金属氢化物
H2O
2、非电解质:
在水溶液和熔融态下均不导电的化合物。
条 件
eg:CO2、SO3、
eg:CH4、C2H5OH、C6H12O6等
eg:NH3、N2H4等
物质类别
非金属氧化物
非金属氢化物
大部分有机物
水
熔融态
水和
熔融态
NO2等
本身
电解质
NaCl或其他电解质
主要成分
湿手直接接触电源时容易发生触电事故的原因
遇到水
电解质溶液
电解质溶液 能够导电
辨 析
1、一个物质的水溶液可以导电,那这个物质一定是电解质吗?
2、一个物质的水溶液不可以导电,那这个物质一定不是电解质吗?
3、能导电的物质一定是电解质吗?
混合物
电解质
CO2、SO2
金属、石墨、半导体
酸、碱、盐(易溶于水)的水溶液
熔融盐、熔融碱、熔融活泼金属氧化物
能导电的物质:
单质
BaSO4
物 质
物质的分类
混合物
纯净物
化合物
单质
电解质
非电解质
物质
既不是电解质也不是非电解质的物质
物质
1.2.1 电解质的电离
一、电解质的电离
1、电解质:
在水溶液或熔融态下能够导电的化合物。
条 件
物质类别
酸
碱
eg:HCl、H2SO4、CH3COOH等
eg:NaOH、Ba(OH)2、NH3 H2O等
eg:NaCl、BaSO4、(NH4)2SO4等
eg:Na2O、MgO、CaO等
eg:NaH、CaH2等
盐
活泼金属氧化物
活泼金属氢化物
H2O
2、非电解质:
在水溶液和熔融态下均不导电的化合物。
条 件
eg:CO2、SO3、
eg:CH4、C2H5OH、C6H12O6等
eg:NH3、N2H4等
物质类别
非金属氧化物
非金属氢化物
大部分有机物
水
熔融态
水和
熔融态
NO2等
本身
思 考 1
Q1:为什么NaCl、KNO3固体不导电,但它溶于水或变成熔融态之后就能导电了呢?
导 电
有能自由移动的带电微粒
实 质
碱和盐本身由离子构成
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
-
+
+
-
-
+
-
Na+
Cl-
带相反电荷的离子间的相互作用
Na+和Cl-按一定规则紧密地排列着
离子不能自由移动
干燥的NaCl固体不导电
思 考 1
NaCl、KNO3固体不导电
熔融状态的NaCl、KNO3能导电
思 考 1
NaCl、KNO3固体不导电
无自由移动离子
熔融状态的NaCl、KNO3能导电
有自由移动离子
思 考 1
Q1:为什么NaCl、KNO3固体不导电,但它溶于水或变成熔融态之后就能导电了呢?
Q2: NaCl与H2O之间到底发生了怎样的相互作用?
才使得原本不能自由移动的钠离子和氯离子可以自由移动的呢?
碱和盐本身由离子构成
思 考 1
思 考 1
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
Na+
Cl-
H2O
将NaCl固体加入水中
思 考 1
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
在水分子 的作用下
将NaCl固体加入水中
思 考 1
在水分子 的作用下
进入水中
将NaCl固体加入水中
Na+和Cl-脱离NaCl固体的表面
形成能够自由移动的水合钠离子和水合氯离子
-
+
-
-
-
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
思 考 1
NaCl、KNO3固体不导电
NaCl、KNO3溶液能导电
无自由移动离子
有自由移动离子
思 考 1
1.2.1 电解质的电离
一、电解质的电离
1、电解质:
在水溶液或熔融态下能够导电的化合物。
条 件
物质类别
酸
碱
eg:HCl、H2SO4、CH3COOH等
eg:NaOH、Ba(OH)2、NH3 H2O等
eg:NaCl、BaSO4、(NH4)2SO4等
eg:Na2O、MgO、CaO等
eg:NaH、CaH2等
盐
活泼金属氧化物
活泼金属氢化物
H2O
2、非电解质:
在水溶液和熔融态下均不导电的化合物。
条 件
eg:CO2、SO3、
eg:CH4、C2H5OH、C6H12O6等
eg:NH3、N2H4等
物质类别
非金属氧化物
非金属氢化物
大部分有机物
水
熔融态
水和
熔融态
NO2等
本身
Q3:为什么Na2O、NaH固体能在熔融态下导电呢?
活泼金属氧化物和活泼金属氢化物本身由离子构成
思 考 2
1.2.1 电解质的电离
一、电解质的电离
1、电解质:
在水溶液或熔融态下能够导电的化合物。
条 件
物质类别
酸
碱
eg:HCl、H2SO4、CH3COOH等
eg:NaOH、Ba(OH)2、NH3 H2O等
eg:NaCl、BaSO4、(NH4)2SO4等
eg:Na2O、MgO、CaO等
eg:NaH、CaH2等
盐
活泼金属氧化物
活泼金属氢化物
H2O
2、非电解质:
在水溶液和熔融态下均不导电的化合物。
条 件
eg:CO2、SO3、
eg:CH4、C2H5OH、C6H12O6等
eg:NH3、N2H4等
物质类别
非金属氧化物
非金属氢化物
大部分有机物
水
熔融态
水和
熔融态
NO2等
本身
Q4:为什么HCl能在水溶液中导电而在熔融状态下就不导电呢?
酸本身由分子构成
思 考 3
Q5: HCl与H2O之间到底发生了怎样的相互作用?
才使得原本没有带电微粒的氯化氢分子变成可以自由移动的离子呢?
思 考 3
H
Cl
H2O
将HCl加入水中
思 考 3
在水分子 的作用下
将HCl加入水中
思 考 3
在水分子 的作用下
进入水中
将HCl加入水中
H和Cl脱离HCl的表面
形成能够自由移动的水合氢离子和水合氯离子
-
+
思 考 3
1.2.1 电解质的电离
一、电解质的电离
2、电离:
电解质溶于水或受热熔化时,形成自由移动的离子的过程叫做电离。
水分子作用
破坏了离子之间的相互作用
思 考 4
Q6:先电离后导电?Or 先通电后电离?
导 电
有能自由移动的带电微粒
实 质
电 流
带电微粒的定向移动
实 质
在水分子 的作用下
进入水中
将NaCl固体加入水中
Na+和Cl-脱离NaCl固体的表面
形成能够自由移动的水合钠离子和水合氯离子
-
+
-
+
与电源正极相连的电极
与电源负极相连的电极
带正电荷的水合钠离子向与电源负极相连的电极移动
当在NaCI溶液 中插入电极并接通电源
带负电荷的水合氯离子向与电源正极相连的电极移动
思 考 4
1.2.1 电解质的电离
一、电解质的电离
2、电离:
电解质溶于水或受热熔化时,形成自由移动的离子的过程叫做电离。
先电离
后导电
有电流
通电源
水分子作用
破坏了离子之间的相互作用
方法导引
模型
在对研究对象进行实验观察和证据推理的基础上,利用简化、抽象和类比等方法,将反应研究对象的本质特征形成一种概括性的描述和认识思路,这就是模型。模型在科学认识中具有描述、解释和预测等功能,是理论发展的一种重要方式。
化学中的模型有实物模型、理论模型等,其中,理论模型应用范围最广。例如,十九世纪后期,瑞典化学家阿伦尼乌斯在前人研究的基础上,通过研究电解质稀溶液的导电性等,提出了电离模型,即电解质溶于水会自动解离成离子,而不是当时流行的说法——离子是通电后才产生的,并对电解质的电离进行了定量计算。电离模型很好地解释了酸、碱、盐溶液的某些性质,如酸、碱的强度等,因此发展成为近代的电离理论。阿伦尼乌斯也因此获得1903年诺贝尔化学奖。
1.2.1 电解质的电离
一、电解质的电离
2、电离:
电解质溶于水或受热熔化时,形成自由移动的离子的过程叫做电离。
先电离
后导电
有电流
通电源
水分子作用
破坏了离子之间的相互作用
3、电离方程式
NaCl =
Na+ + Cl-
KNO3 =
K+ + NO3-
遵循质量守恒、电荷守恒
原子团不能拆开写
任 务
H2SO4 =
HNO3 =
HCl =
2 H+ + SO42-
H+ + NO3-
H+ + Cl-
KOH =
Ba(OH)2 =
NaOH =
K+ + OH-
Ba2+ + 2OH-
Na+ + OH-
BaSO4 =
CaCl2 =
NaHSO4 =
SO42-
+ H+ +
Na+
Na2CO3 =
2Na+ + CO32-
Ba2+ + SO42-
Ca2+ + 2Cl-
请写出H2SO4、HNO3、HCl、KOH、 Ba(OH)2 、 NaOH 、 Na2CO3 、 BaSO4 、 CaCl2 、 NaHCO3的电离方程式。
1.2.1 电解质的电离
一、电解质的电离
2、电离:
电解质溶于水或受热熔化时,形成自由移动的离子的过程叫做电离。
先电离
后导电
有电流
通电源
水分子作用
破坏了离子之间的相互作用
3、电离方程式
NaCl =
Na+ + Cl-
KNO3 =
K+ + NO3-
遵循质量守恒、电荷守恒
原子团不能拆开写
酸:电离时生成的阳离子全部是氢离子的化合物
碱:电离时生成的阴离子全部是氢氧根离子的化合物
盐:电离时能够生成对应的阳离子和阴离子,且阳离子不是氢离子或不完全是氢离子,阴离子不是氢氧根离子或不全是氢氧根离子的化合物
课堂练习
1.下列哪些物质是电解质?
下列哪些物质是非电解质?
下列哪些物质既不是电解质又不是非电解质?
氯化氢、NO、氯化钠固体、氨水、H2CO3、CO2、酒精、Cl2
氯化氢、氯化钠固体、H2CO3
NO、酒精、CO2
Cl2、氨水
课堂练习
2.下列物质________________________________________能导电?
________________________________________是电解质?
________________________________________是非电解质?
(1)金属铜 (2)碳棒 (3)O2 (4)H2SO4 (5)液态HCl (6)CH3COOH
(7)葡萄糖 (8)固态NaCl (9)CaCO3固体 (10)CuSO4·5H2O
(11)熔融状态的KNO3 (12)KOH水溶液 (13)酒精水溶液
(14)盐酸 (15)CaO (16)CO2 (17)H2O (18)NH3
(1)、(2)、(11)、(12)、(14)、(17)
(4)、(5)、(6)、(8)、(9)、(10)、(11)、(15)
(7)、(16)、(18)
感谢聆听!
CHEMISTRY
