3.1铁及其化合物 课件(共24张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 3.1铁及其化合物 课件(共24张ppt)化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 19.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-19 00:00:00 | ||
图片预览








文档简介
(共24张PPT)
第三章 铁 金属材料
第一节 铁及其化合物
生活中的富铁食品
生活中的富铁食品
人体中的铁元素
一个成年人体内约含3-5g,血红蛋白中存在着+2价的铁。没有铁,血红蛋白就不能结合氧分子进行输氧,造成缺铁性贫血。
自然界中的铁元素
陨铁 游离态
赤铁矿
氧化铁Fe2O3
磁铁矿
四氧化三铁Fe3O4
黄铁矿
(主要成分为FeS2)
丹霞地貌的岩层因Fe2O3而呈红色。
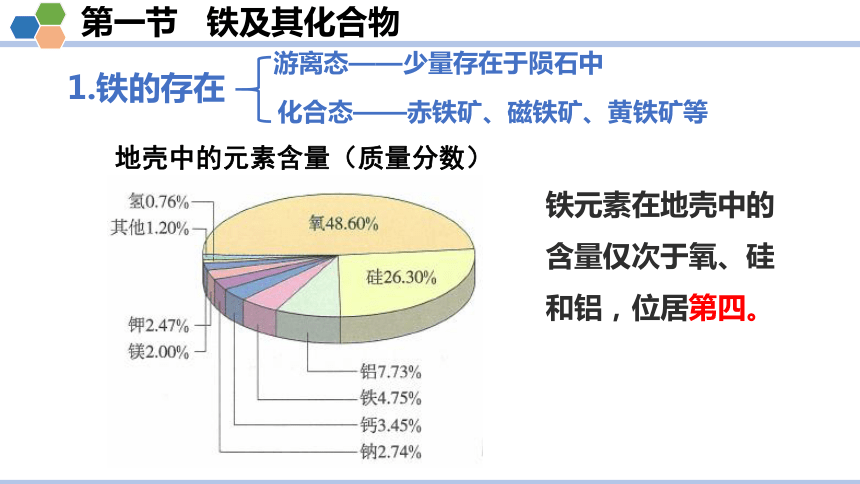
地壳中的元素含量(质量分数)
铁元素在地壳中的含量仅次于氧、硅和铝,位居第四。
第一节 铁及其化合物
1.铁的存在
游离态——少量存在于陨石中
化合态——赤铁矿、磁铁矿、黄铁矿等
第一节 铁及其化合物
我国目前发现最早的人工冶铁制品
甘肃灵台山出土的春秋初年秦国的铜柄铁剑
战国时期最大的铁器
——长方形铁炉
铁粉
(2)有延展性;导热性;能导电,但其导电性不如铜和铝。
(3)具有磁性。
2.铁的物理性质
(1)银白色金属,灰黑色粉末
3.铁的化学性质
铁是化学性质较活泼的金属单质,具有还原性,能与许多物质发生化学反应。
请大家回顾一下,我们学习过有关铁的反应有哪些?
(1)与非金属单质反应
(2)与酸反应
(3)与盐溶液反应
化学性质
1. 与非金属单质反应
2. 与酸反应
3. 与盐溶液反应
2Fe+3Cl2 == 2FeCl3
点燃
+3
Fe+2H+===Fe2++H2↑
+2
Fe+Cu2+==Fe2++Cu
Fe与较弱的氧化剂反应,得到+2价铁的化合物
Fe与较强的氧化剂反应,得到+3价铁的化合物
0
0
第一节 铁及其化合物
Fe+2Fe3+==3Fe2+
Fe+ S == FeS
点燃
+2
0
思考
【思考讨论】结合下列信息思考铁与水能否发生反应?
在钢铁厂的生产中,炙热的铁水或钢水注入模具之前,模具必须进行充分干燥处理,不得留有水。(p69)
铁制品常用作厨具、饮料包装、水壶.......
二、铁的氧化物
在高温条件下,铁能否与水蒸气反应?
作出假设
实验探究
解释和结论
提出问题
在高温条件下,铁能与水蒸气反应
在高温条件下,铁能与水蒸气反应,生成Fe3O4和H2
加热湿棉花:提供水蒸气
导入肥皂液:为了产生气泡,便于通过点燃验证产物
现象:生成黑色固体并有气体放出,并且气体可点燃
3Fe+4H2O (g)== Fe3O4+4H2
高温
第一节 铁及其化合物
二、铁的氧化物
铁红 氧化铁
第一节 铁及其化合物
3Fe+2O2 == Fe3O4(四氧化三铁)
Fe3O4
(磁性氧化铁)
Fe2O3
(铁红)
FeO
点燃
二、铁的氧化物
2. 化学性质
(1) FeO不稳定,在空气中易受热氧化成Fe3O4。
6FeO + O2 = 2Fe3O4
△
Fe2O3、Fe3O4较稳定。
二、铁的氧化物
2. 化学性质
(2) FeO和Fe2O3属于碱性氧化物,具有碱性氧化物的通性。
FeO + 2H+ = Fe2+ + H2O
Fe2O3 + 6H+ = 2Fe3+ + 3H2O
Fe3O4 + 8H+ ══ Fe2+ + 2Fe3+ + 4H2O
注:Fe3O4 是纯净物,但它的组成可理解为FeO·Fe2O3。
二、铁的氧化物
3. 化学性质
(3) 与CO等还原剂反应
Fe2O3+3CO === 2Fe+3CO2
高温
Fe3O4+4CO === 3Fe+4CO2
高温
高温时,都能与C、CO、H2反应,被还原生成Fe(炼铁原理)
化学式 FeO Fe2O3 Fe3O4
俗名 —— 铁红 磁性氧化铁
色态
铁的价态
水溶性
稳定性
与非氧化性强酸反应
氧化性 黑色粉末
红棕色粉末
黑色晶体
+2价
+3价
+2价、+3价(2个)
不溶
不溶
不溶
易受热氧化为Fe3O4
较稳定
稳定
FeO + 2H+ = Fe2+ + H2O
Fe3O4 + 8H+ =Fe2+ + 2Fe3+ + 4H2O
高温时,都能与C、CO、H2反应,被还原生成Fe(炼铁原理)
Fe2O3 + 6H+=2Fe3+ + 3H2O
二、铁的氧化物
FeO和Fe2O3对应的碱分别是哪一个 ?
如何制备Fe(OH)2和Fe(OH)3?
【实验3-1 】(课本p71)
FeCl3溶液
验证FeSO4与碱的反应
FeSO4溶液
NaOH溶液
验证FeCl3与碱的反应
NaOH溶液
三、铁的氢氧化物
—NaOH溶液
—FeCl3溶液
在两支试管中分别加入少量的FeCl3溶液和FeCl2溶液,然后各滴入NaOH溶液。观察并描述发生的现象。
白色沉淀
灰绿色沉淀
红褐色沉淀
三、铁的氢氧化物
在两支试管中分别加入少量的FeCl3溶液和FeCl2溶液,然后各滴入NaOH溶液。观察并描述发生的现象。
FeCl3溶液 FeCl2溶液
加NaOH 溶液现象
离子 方程式
生成红褐色沉淀
先生成白色絮状沉淀,之后迅速变为灰绿色,最后变为红褐色沉淀。
Fe3+ + 3OH- ══ Fe(OH)3↓
Fe2+ + 2OH- ══ Fe(OH)2↓
4Fe(OH)2 + O2 + 2H2O ══ 4Fe(OH)3
三、铁的氢氧化物
【思考】Fe(OH)2是白色的固体,但在实验中很难观察到它的白色,如何使生成白色的Fe(OH)2保持较长时间以便于观察?
三、铁的氢氧化物
除去试管和溶液中氧气,创造无氧环境
1. 用煮沸过的蒸馏水新配制FeSO4溶液和NaOH溶液;
2. 滴加NaOH溶液的胶头滴管的尖端插入FeSO4溶液液面以下;
3. 还可以在试管中FeSO4溶液液面上预先加一层植物油、苯等。
某溶液中有Fe3+、Mg2+、Fe2+和Na+四种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( )
Fe3+
Mg2+
Fe2+
Na+
C
练习
THANKS
第三章 铁 金属材料
第一节 铁及其化合物
生活中的富铁食品
生活中的富铁食品
人体中的铁元素
一个成年人体内约含3-5g,血红蛋白中存在着+2价的铁。没有铁,血红蛋白就不能结合氧分子进行输氧,造成缺铁性贫血。
自然界中的铁元素
陨铁 游离态
赤铁矿
氧化铁Fe2O3
磁铁矿
四氧化三铁Fe3O4
黄铁矿
(主要成分为FeS2)
丹霞地貌的岩层因Fe2O3而呈红色。
地壳中的元素含量(质量分数)
铁元素在地壳中的含量仅次于氧、硅和铝,位居第四。
第一节 铁及其化合物
1.铁的存在
游离态——少量存在于陨石中
化合态——赤铁矿、磁铁矿、黄铁矿等
第一节 铁及其化合物
我国目前发现最早的人工冶铁制品
甘肃灵台山出土的春秋初年秦国的铜柄铁剑
战国时期最大的铁器
——长方形铁炉
铁粉
(2)有延展性;导热性;能导电,但其导电性不如铜和铝。
(3)具有磁性。
2.铁的物理性质
(1)银白色金属,灰黑色粉末
3.铁的化学性质
铁是化学性质较活泼的金属单质,具有还原性,能与许多物质发生化学反应。
请大家回顾一下,我们学习过有关铁的反应有哪些?
(1)与非金属单质反应
(2)与酸反应
(3)与盐溶液反应
化学性质
1. 与非金属单质反应
2. 与酸反应
3. 与盐溶液反应
2Fe+3Cl2 == 2FeCl3
点燃
+3
Fe+2H+===Fe2++H2↑
+2
Fe+Cu2+==Fe2++Cu
Fe与较弱的氧化剂反应,得到+2价铁的化合物
Fe与较强的氧化剂反应,得到+3价铁的化合物
0
0
第一节 铁及其化合物
Fe+2Fe3+==3Fe2+
Fe+ S == FeS
点燃
+2
0
思考
【思考讨论】结合下列信息思考铁与水能否发生反应?
在钢铁厂的生产中,炙热的铁水或钢水注入模具之前,模具必须进行充分干燥处理,不得留有水。(p69)
铁制品常用作厨具、饮料包装、水壶.......
二、铁的氧化物
在高温条件下,铁能否与水蒸气反应?
作出假设
实验探究
解释和结论
提出问题
在高温条件下,铁能与水蒸气反应
在高温条件下,铁能与水蒸气反应,生成Fe3O4和H2
加热湿棉花:提供水蒸气
导入肥皂液:为了产生气泡,便于通过点燃验证产物
现象:生成黑色固体并有气体放出,并且气体可点燃
3Fe+4H2O (g)== Fe3O4+4H2
高温
第一节 铁及其化合物
二、铁的氧化物
铁红 氧化铁
第一节 铁及其化合物
3Fe+2O2 == Fe3O4(四氧化三铁)
Fe3O4
(磁性氧化铁)
Fe2O3
(铁红)
FeO
点燃
二、铁的氧化物
2. 化学性质
(1) FeO不稳定,在空气中易受热氧化成Fe3O4。
6FeO + O2 = 2Fe3O4
△
Fe2O3、Fe3O4较稳定。
二、铁的氧化物
2. 化学性质
(2) FeO和Fe2O3属于碱性氧化物,具有碱性氧化物的通性。
FeO + 2H+ = Fe2+ + H2O
Fe2O3 + 6H+ = 2Fe3+ + 3H2O
Fe3O4 + 8H+ ══ Fe2+ + 2Fe3+ + 4H2O
注:Fe3O4 是纯净物,但它的组成可理解为FeO·Fe2O3。
二、铁的氧化物
3. 化学性质
(3) 与CO等还原剂反应
Fe2O3+3CO === 2Fe+3CO2
高温
Fe3O4+4CO === 3Fe+4CO2
高温
高温时,都能与C、CO、H2反应,被还原生成Fe(炼铁原理)
化学式 FeO Fe2O3 Fe3O4
俗名 —— 铁红 磁性氧化铁
色态
铁的价态
水溶性
稳定性
与非氧化性强酸反应
氧化性 黑色粉末
红棕色粉末
黑色晶体
+2价
+3价
+2价、+3价(2个)
不溶
不溶
不溶
易受热氧化为Fe3O4
较稳定
稳定
FeO + 2H+ = Fe2+ + H2O
Fe3O4 + 8H+ =Fe2+ + 2Fe3+ + 4H2O
高温时,都能与C、CO、H2反应,被还原生成Fe(炼铁原理)
Fe2O3 + 6H+=2Fe3+ + 3H2O
二、铁的氧化物
FeO和Fe2O3对应的碱分别是哪一个 ?
如何制备Fe(OH)2和Fe(OH)3?
【实验3-1 】(课本p71)
FeCl3溶液
验证FeSO4与碱的反应
FeSO4溶液
NaOH溶液
验证FeCl3与碱的反应
NaOH溶液
三、铁的氢氧化物
—NaOH溶液
—FeCl3溶液
在两支试管中分别加入少量的FeCl3溶液和FeCl2溶液,然后各滴入NaOH溶液。观察并描述发生的现象。
白色沉淀
灰绿色沉淀
红褐色沉淀
三、铁的氢氧化物
在两支试管中分别加入少量的FeCl3溶液和FeCl2溶液,然后各滴入NaOH溶液。观察并描述发生的现象。
FeCl3溶液 FeCl2溶液
加NaOH 溶液现象
离子 方程式
生成红褐色沉淀
先生成白色絮状沉淀,之后迅速变为灰绿色,最后变为红褐色沉淀。
Fe3+ + 3OH- ══ Fe(OH)3↓
Fe2+ + 2OH- ══ Fe(OH)2↓
4Fe(OH)2 + O2 + 2H2O ══ 4Fe(OH)3
三、铁的氢氧化物
【思考】Fe(OH)2是白色的固体,但在实验中很难观察到它的白色,如何使生成白色的Fe(OH)2保持较长时间以便于观察?
三、铁的氢氧化物
除去试管和溶液中氧气,创造无氧环境
1. 用煮沸过的蒸馏水新配制FeSO4溶液和NaOH溶液;
2. 滴加NaOH溶液的胶头滴管的尖端插入FeSO4溶液液面以下;
3. 还可以在试管中FeSO4溶液液面上预先加一层植物油、苯等。
某溶液中有Fe3+、Mg2+、Fe2+和Na+四种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( )
Fe3+
Mg2+
Fe2+
Na+
C
练习
THANKS
