2.1.1钠及其化合物 课件(共33张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 2.1.1钠及其化合物 课件(共33张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 30.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-20 08:55:01 | ||
图片预览











文档简介
(共33张PPT)
人教版2019必修第一册
第二章 海水中的重要元素——钠和氯
第1节 钠及其化合物
01
02
03
04
教学分析
学情分析
教学目标
教学重难点
目录
CONTENTS
05
教学过程
0 1
教学分析
分析教材与课标,本节课要求学生能根据钠及其化合物的物质类别和元素化合价列举相应的典型代表物,并辨识、描述钠及其化合物的重要物理性质、化学性质及实验现象,能利用化学方程式、离子方程式正确表示这些典型物质的主要化学性质。感受钠及其化合物的应用对社会发展的价值、对环境的影响。
学情分析
学生在此前已经学习物质的分类及转化、离子反应、氧化还原反应等基础必备知识,具备一定的实验操作能力和实验探究能力,能够书写离子方程式,具备一定的结构决定性质的观念。
0 2
能够应用物质分类、氧化还原反应等知识分析钠的化学性质,正确钠与氧气、钠与水反应的化学方程式。
通过探究钠与水的反应,形成实验探究、分析推理的能力,深化结构决定性质的观念。
通过了解钠的储存方式、用途,感受化学在生产生活中的用途。
0 3
教学目标
教学重难点
钠的化学性质
钠与水反应的实验探究
教学重点
教学难点
0 4
钠的化学性质
钠与水反应的实验探究
教学过程
钠及其化合物分两个课时,第一课时侧重强调从钠的原子结构理解其性质,领悟结构决定性质的观念,运用POE教学策略引导学生掌握科学探究钠与水反应的方法。
第二课时强调探究碳酸钠和碳酸氢钠的性质,进一步引导学生感受科学探究的过程,提高学生的实验能力和分析问题的能力,并能够运用定性与定量结合的思想设计简单的实验。
0 5
第1节 钠及其化合物
第1课时 活泼的金属单质——钠
海水中的主要成分是什么?
钠元素在自然界中以什么形式存在?
钠元素在自然界中都是以化合物的形式存在,如NaCl、Na2CO3、Na2SO4等。
实验室的钠单质储存在煤油中
为什么要放在煤油中呢?
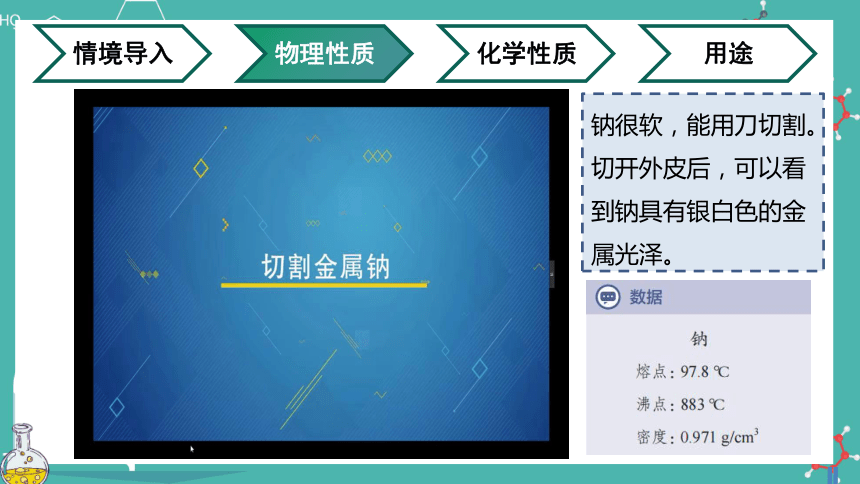
观看实验视频,思考钠具有哪些物理性质?
钠很软,能用刀切割。切开外皮后,可以看到钠具有银白色的金属光泽。
归纳
物理性质
硬度
质软
色态
具有银白色金属光泽的固体
密度
<ρ水
ρ=0.971g/cm3 ,ρ煤油<ρ钠
熔沸点
较低 (熔点97.8℃ ,沸点883℃)
导电、热
电和热的良导体
钠具有什么化学性质呢?
结构
性质
钠具有还原性,可以和氧气等氧化剂反应。
预测
失电子
钠具有什么化学性质呢?
物质类别
金属共性
钠可以和非金属单质反应
钠可以与酸反应
钠可以与盐溶液反应
预测
金属特性
K Ca Na Mg Al Zn Fe……
金属活动性顺序
新切开的钠的光亮的表面很快变暗了,这是因为钠与氧气发生反应,在钠的表面生成了一薄层氧化物。
资料卡片
实验室中,要把钠保存在煤油中,以隔绝空气。
常温:4Na + O2 = 2Na2O (白色)
Q:在加热的条件下,钠又会发生什么变化呢?观察并描述实验现象。
【实验2-2】将一小块钠放在坩埚加热至燃烧,观察现象。
剧烈反应
(过氧化钠)
熔化
生成淡黄色固体
发出黄色火焰
△
2Na + O2 Na2O2
-1
钠与氧气反应
①常温下,钠被氧化
②钠在空气中燃烧
反应物相同,反应条件不同,产物不同!
4Na + O2 = 2Na2O (白色)
△
2Na + O2 Na2O2(淡黄色)
①钠与非金属单质反应
钠是一种很活泼的金属,有很强的还原性,能与非金属如氧气、氯气和硫等反应。
反应:
2Na + S = Na2S(爆炸)
研磨
反应:2Na+Cl2 = 2NaCl (白烟)
△
钠在氯气在燃烧,会产生白烟
钠与硫反应,火星四射,发生爆炸
归纳
钠与氧气反应,条件不同,现象不同
Q:钠会与酸反应吗?
钠可以和非金属单质反应
钠可以与酸反应
钠可以与盐溶液反应
预测
2Na + H2SO4 == H2↑+ Na2SO4
2Na + 2H+ == H2↑+ 2Na+
H2O == H+ + OH-
K Ca Na Mg Al Zn Fe Sn Pb H ….
金属活动性顺序
本质
Q:钠会与水反应吗?
钠可以和非金属单质反应
钠可以与酸反应
钠可以与盐溶液反应
钠可以与水反应
预测
向一只盛有水的烧杯中滴加几滴酚酞溶液,然后投入绿豆大小的金属钠
实验探究
物质组成
氧化还原反应
Q:预测钠与水反应会生成什么?
钠与水反应会有什么实验现象呢?
实验现象 相应的分析解释
钠浮在水面
熔化成液态小球
钠在水面游动
溶液变红
钠的密度比水的小
反应放热,钠的熔点低
有气体生成
生成碱性物质
发出嘶嘶的响声
有气体生成,反应剧烈
钠与水反应
请推测该气体是什么?如何证明你的推测
元素守恒
物质组成
碱性物质是NaOH
气体可能是H2 或者O2
用燃烧的火柴,使火柴燃烧更旺是氧气,有蓝色火焰是氢气
氧化还原反应
实验验证
还原剂
氧化剂
2Na + 2H2O = 2NaOH + H2↑
0 +1 -2 +1 0
钠与水反应的化学方程式
钠与水反应的离子方程式
2Na + 2H2O = 2NaOH + H2↑
2Na + 2H2O = 2Na+ + 2OH- + H2↑
归纳
钠和水反应,实质上是与水中少量的H+反应。
Q:钠与水和酸的反应,哪个更剧烈?
当火灾现场存放有大量活泼金属时,不能用水,应用干燥的沙土来灭火。
钠可以和非金属单质反应
钠可以与酸反应
钠可以与盐溶液反应
钠可以与水反应
预测
思考:把一小块金属钠投入到硫酸铜溶液中,将看到什么现象?
钠与硫酸铜溶液反应
实验现象:钠浮在水面上,熔成小球 ,向四处游动,有氢气生成且生成蓝色沉淀。
浮、熔、游、响、蓝
Q:发生了什么反应?写出相应的化学方程式。
反应方程式(分两步):
总反应式: 2Na+CuSO4+2H2O == Cu(OH)2↓+Na2SO4+H2 ↑
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
2Na + 2H2O = 2NaOH + H2↑
性质
用途
1、制取钠的化合物,如过氧化钠;
钠的用途
2Na+O2=Na2O2
△
2、作除水剂;
2Na+2H2O=2NaOH+H2↑
3、还原钛、锆、铌、 钽等贵重金属;
4Na+TiCl4(熔融)=4NaCl+Ti
4、核反应堆冷却剂
Na的导热性
5、高压钠灯
课堂小结
C
课堂小练
1. 下列关于金属钠物理性质的叙述中,不正确的是( )
A.金属钠很软,可用刀切割
B.金属钠是热和电的良导体
C.金属钠的密度比煤油的小
D.金属钠是银白色的
B
课堂小练
2.下列反应的离子方程式不正确的是 ( )
A.钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+
C.钠与盐酸反应:2Na+2H+=2Na++H2↑
D.钠与氯化钾溶液反应:2Na+2H2O=2Na++2OH-+H2↑
下节课见!
人教版2019必修第一册
第二章 海水中的重要元素——钠和氯
第1节 钠及其化合物
01
02
03
04
教学分析
学情分析
教学目标
教学重难点
目录
CONTENTS
05
教学过程
0 1
教学分析
分析教材与课标,本节课要求学生能根据钠及其化合物的物质类别和元素化合价列举相应的典型代表物,并辨识、描述钠及其化合物的重要物理性质、化学性质及实验现象,能利用化学方程式、离子方程式正确表示这些典型物质的主要化学性质。感受钠及其化合物的应用对社会发展的价值、对环境的影响。
学情分析
学生在此前已经学习物质的分类及转化、离子反应、氧化还原反应等基础必备知识,具备一定的实验操作能力和实验探究能力,能够书写离子方程式,具备一定的结构决定性质的观念。
0 2
能够应用物质分类、氧化还原反应等知识分析钠的化学性质,正确钠与氧气、钠与水反应的化学方程式。
通过探究钠与水的反应,形成实验探究、分析推理的能力,深化结构决定性质的观念。
通过了解钠的储存方式、用途,感受化学在生产生活中的用途。
0 3
教学目标
教学重难点
钠的化学性质
钠与水反应的实验探究
教学重点
教学难点
0 4
钠的化学性质
钠与水反应的实验探究
教学过程
钠及其化合物分两个课时,第一课时侧重强调从钠的原子结构理解其性质,领悟结构决定性质的观念,运用POE教学策略引导学生掌握科学探究钠与水反应的方法。
第二课时强调探究碳酸钠和碳酸氢钠的性质,进一步引导学生感受科学探究的过程,提高学生的实验能力和分析问题的能力,并能够运用定性与定量结合的思想设计简单的实验。
0 5
第1节 钠及其化合物
第1课时 活泼的金属单质——钠
海水中的主要成分是什么?
钠元素在自然界中以什么形式存在?
钠元素在自然界中都是以化合物的形式存在,如NaCl、Na2CO3、Na2SO4等。
实验室的钠单质储存在煤油中
为什么要放在煤油中呢?
观看实验视频,思考钠具有哪些物理性质?
钠很软,能用刀切割。切开外皮后,可以看到钠具有银白色的金属光泽。
归纳
物理性质
硬度
质软
色态
具有银白色金属光泽的固体
密度
<ρ水
ρ=0.971g/cm3 ,ρ煤油<ρ钠
熔沸点
较低 (熔点97.8℃ ,沸点883℃)
导电、热
电和热的良导体
钠具有什么化学性质呢?
结构
性质
钠具有还原性,可以和氧气等氧化剂反应。
预测
失电子
钠具有什么化学性质呢?
物质类别
金属共性
钠可以和非金属单质反应
钠可以与酸反应
钠可以与盐溶液反应
预测
金属特性
K Ca Na Mg Al Zn Fe……
金属活动性顺序
新切开的钠的光亮的表面很快变暗了,这是因为钠与氧气发生反应,在钠的表面生成了一薄层氧化物。
资料卡片
实验室中,要把钠保存在煤油中,以隔绝空气。
常温:4Na + O2 = 2Na2O (白色)
Q:在加热的条件下,钠又会发生什么变化呢?观察并描述实验现象。
【实验2-2】将一小块钠放在坩埚加热至燃烧,观察现象。
剧烈反应
(过氧化钠)
熔化
生成淡黄色固体
发出黄色火焰
△
2Na + O2 Na2O2
-1
钠与氧气反应
①常温下,钠被氧化
②钠在空气中燃烧
反应物相同,反应条件不同,产物不同!
4Na + O2 = 2Na2O (白色)
△
2Na + O2 Na2O2(淡黄色)
①钠与非金属单质反应
钠是一种很活泼的金属,有很强的还原性,能与非金属如氧气、氯气和硫等反应。
反应:
2Na + S = Na2S(爆炸)
研磨
反应:2Na+Cl2 = 2NaCl (白烟)
△
钠在氯气在燃烧,会产生白烟
钠与硫反应,火星四射,发生爆炸
归纳
钠与氧气反应,条件不同,现象不同
Q:钠会与酸反应吗?
钠可以和非金属单质反应
钠可以与酸反应
钠可以与盐溶液反应
预测
2Na + H2SO4 == H2↑+ Na2SO4
2Na + 2H+ == H2↑+ 2Na+
H2O == H+ + OH-
K Ca Na Mg Al Zn Fe Sn Pb H ….
金属活动性顺序
本质
Q:钠会与水反应吗?
钠可以和非金属单质反应
钠可以与酸反应
钠可以与盐溶液反应
钠可以与水反应
预测
向一只盛有水的烧杯中滴加几滴酚酞溶液,然后投入绿豆大小的金属钠
实验探究
物质组成
氧化还原反应
Q:预测钠与水反应会生成什么?
钠与水反应会有什么实验现象呢?
实验现象 相应的分析解释
钠浮在水面
熔化成液态小球
钠在水面游动
溶液变红
钠的密度比水的小
反应放热,钠的熔点低
有气体生成
生成碱性物质
发出嘶嘶的响声
有气体生成,反应剧烈
钠与水反应
请推测该气体是什么?如何证明你的推测
元素守恒
物质组成
碱性物质是NaOH
气体可能是H2 或者O2
用燃烧的火柴,使火柴燃烧更旺是氧气,有蓝色火焰是氢气
氧化还原反应
实验验证
还原剂
氧化剂
2Na + 2H2O = 2NaOH + H2↑
0 +1 -2 +1 0
钠与水反应的化学方程式
钠与水反应的离子方程式
2Na + 2H2O = 2NaOH + H2↑
2Na + 2H2O = 2Na+ + 2OH- + H2↑
归纳
钠和水反应,实质上是与水中少量的H+反应。
Q:钠与水和酸的反应,哪个更剧烈?
当火灾现场存放有大量活泼金属时,不能用水,应用干燥的沙土来灭火。
钠可以和非金属单质反应
钠可以与酸反应
钠可以与盐溶液反应
钠可以与水反应
预测
思考:把一小块金属钠投入到硫酸铜溶液中,将看到什么现象?
钠与硫酸铜溶液反应
实验现象:钠浮在水面上,熔成小球 ,向四处游动,有氢气生成且生成蓝色沉淀。
浮、熔、游、响、蓝
Q:发生了什么反应?写出相应的化学方程式。
反应方程式(分两步):
总反应式: 2Na+CuSO4+2H2O == Cu(OH)2↓+Na2SO4+H2 ↑
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
2Na + 2H2O = 2NaOH + H2↑
性质
用途
1、制取钠的化合物,如过氧化钠;
钠的用途
2Na+O2=Na2O2
△
2、作除水剂;
2Na+2H2O=2NaOH+H2↑
3、还原钛、锆、铌、 钽等贵重金属;
4Na+TiCl4(熔融)=4NaCl+Ti
4、核反应堆冷却剂
Na的导热性
5、高压钠灯
课堂小结
C
课堂小练
1. 下列关于金属钠物理性质的叙述中,不正确的是( )
A.金属钠很软,可用刀切割
B.金属钠是热和电的良导体
C.金属钠的密度比煤油的小
D.金属钠是银白色的
B
课堂小练
2.下列反应的离子方程式不正确的是 ( )
A.钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+
C.钠与盐酸反应:2Na+2H+=2Na++H2↑
D.钠与氯化钾溶液反应:2Na+2H2O=2Na++2OH-+H2↑
下节课见!
