4.3化学键 课件(共22张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 4.3化学键 课件(共22张ppt)化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 795.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-20 00:00:00 | ||
图片预览



文档简介
(共22张PPT)
第四章 物质结构 元素周期律
第三节 化学键
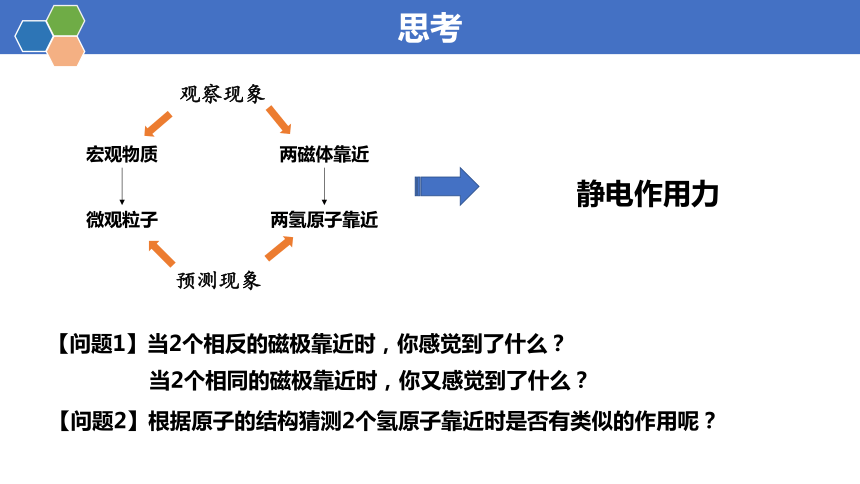
思考
观察现象
宏观物质
两磁体靠近
微观粒子
两氢原子靠近
预测现象
静电作用力
【问题1】当2个相反的磁极靠近时,你感觉到了什么?
当2个相同的磁极靠近时,你又感觉到了什么?
【问题2】根据原子的结构猜测2个氢原子靠近时是否有类似的作用呢?
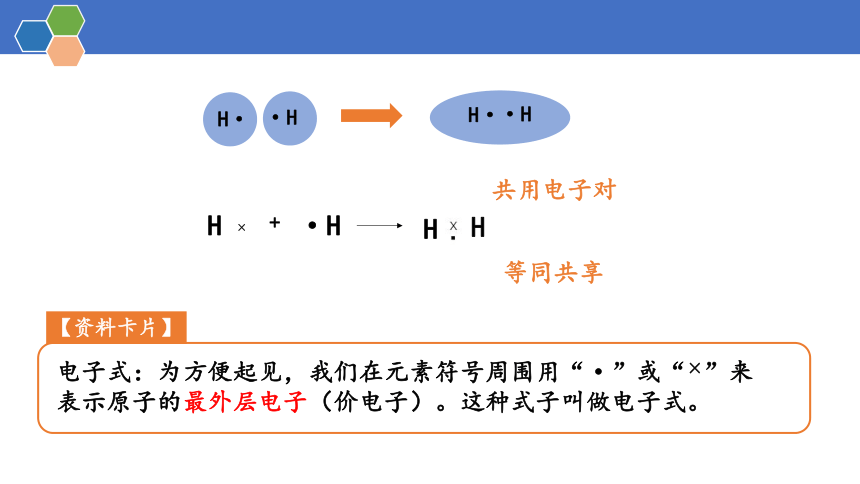
H·
·H
H·
·H
共用电子对
H ×
+
·H
H
H
等同共享
【资料卡片】
电子式:为方便起见,我们在元素符号周围用“·”或“×”来表示原子的最外层电子(价电子)。这种式子叫做电子式。
美国的路易斯(Lewis)提出经典理论,认为分子中的原子可以通过共用电子对使每一个原子达到稳定的稀有气体电子结构,Lewis八隅体规则初步解释了很多元素化合物的形成。
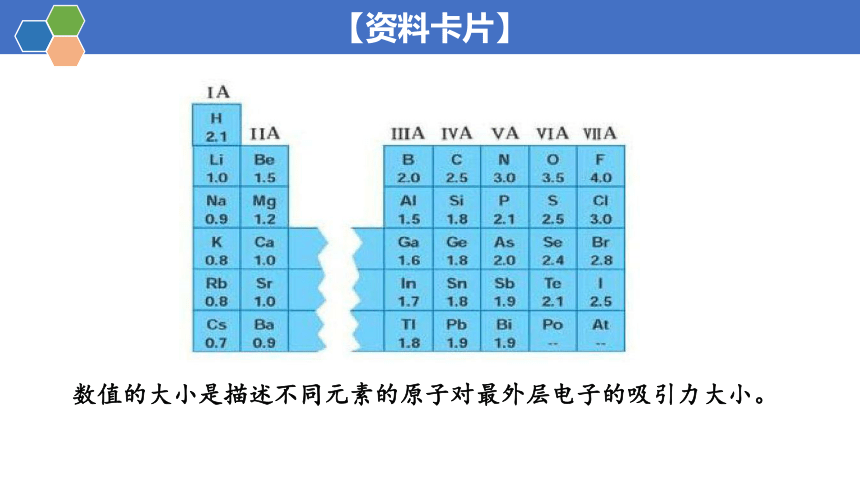
【资料卡片】
数值的大小是描述不同元素的原子对最外层电子的吸引力大小。
【讨论分析】如果把H中的一个H原子换成Cl原子会是怎样的情形?和H2的
形成有什么相同之处,又有哪些不同?
H
ⅹ
+
Cl
∶
∶
∶
·
H
Cl
∶
∶
∶
·
ⅹ
共用电子对
不等同共享(偏移)
离子键
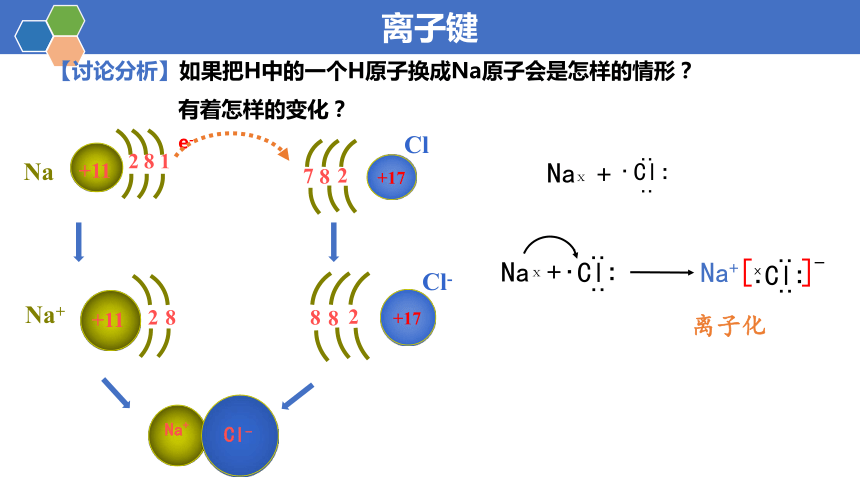
【讨论分析】如果把H中的一个H原子换成Na原子会是怎样的情形?
有着怎样的变化?
离子化
Na
ⅹ
Cl
∶
∶
∶
·
+
Na
ⅹ
Cl
∶
∶
∶
·
Na+
Cl
∶
∶
∶
·
ⅹ
[
]
-
e-
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
+11
8
2
Na+
Cl-
Cl-
+17
8
8
2
+
化学键
H ×
+
·H
H
H
H
ⅹ
+
Cl
∶
∶
∶
·
H
Cl
∶
∶
∶
·
ⅹ
Na
ⅹ
Cl
∶
∶
∶
·
Na+
Cl
∶
∶
∶
·
ⅹ
[
]
-
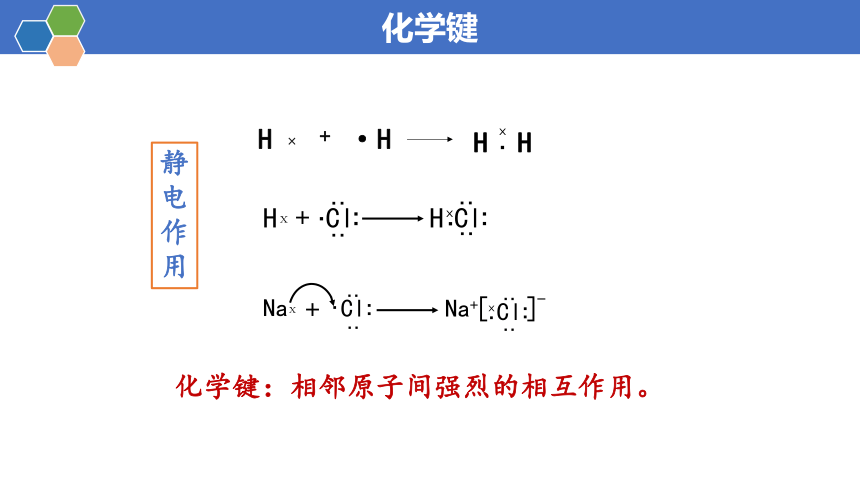
静电作用
化学键:相邻原子间强烈的相互作用。
ⅹ
·
+
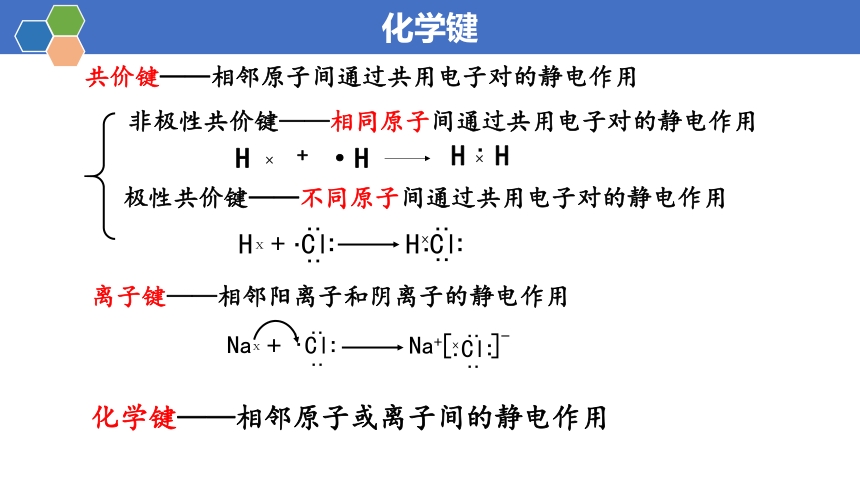
化学键
共价键——相邻原子间通过共用电子对的静电作用
非极性共价键——相同原子间通过共用电子对的静电作用
极性共价键——不同原子间通过共用电子对的静电作用
离子键——相邻阳离子和阴离子的静电作用
化学键——相邻原子或离子间的静电作用
H ×
+
·H
H
H
H
ⅹ
+
Cl
∶
∶
∶
·
H
Cl
∶
∶
∶
·
ⅹ
Na
ⅹ
Cl
∶
∶
∶
·
Na+
Cl
∶
∶
∶
·
ⅹ
[
]
-
·
×
+
离子键
1、定义
阴、阳离子
静电作用(静电引力和静电排斥力)
成键微粒:
成键本质:
阴、阳离子接近到某一定距离时,吸引力和排斥力达到平衡,就形成了离子键。
成键过程:
离子键——相邻阳离子和阴离子的静电作用
离子键
KCl
CaBr2
Na2S
Na2O
NaOH
Na2CO3
Na2SO4
NH4Cl
判断下列物质是否含有离子键。
【思考】如何简单判断物质是否有离子键?
从元素种类的角度
从物质类别的角度
离子键
2、含有离子键的物质有:
如:KCl、Na2O、 Na2O2、 Na2S、MgCl2等
从元素种类的角度来看:
从组成元素来看:
如:NaOH、K2SO4、 NH4Cl 、Na2CO3、Mg(NO3)2 、Na2O等
强碱、大多数的盐(含铵盐)、活泼金属氧化物
活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)之间形成的化合物
练习
a.H2O b.CaCl2 c.NaOH d.H2SO4
e.Na2O f.CO2 g.Na2O2 h.NH4Cl
bcegh
例2、下列各数值表示有关元素的原子序数,能以离子键相互结合成稳定化合物的是 ( )
A.10与19 B.6与16 C.11与17 D.14与8
C
例1、下列物质中含有离子键的是 ( )
离子化合物
强碱: NaOH、 Ba(OH)2
活泼金属氧化物:MgO、Na2O
(1)定义:含有离子键的化合物称为离子化合物
注意:
①离子化合物不一定含金属元素
如:铵盐 NH4Cl
如:BeCl2 AlCl3
大多数盐:NaCl、 MgSO4、NH4Cl
(2)类别
②含金属元素的化合物不一定是离子化合物
练习
例3、正误判断:
(1)含有离子键的化合物一定是离子化合物。
(2)离子化合物中一定含有阴离子和阳离子。
(3)含有金属元素的化合物一定是离子化合物。
(4)阴、阳离子通过静电引力所形成的化学键叫做离子键。
(5)由非金属元素组成的化合物一定不是离子化合物。
√
√
×
例4、下列物质中不属于离子化合物的是 ( )
A.NH4NO3 B. NaOH C.MgCl2 D.H2SO4
D
×
×
电子式
【资料卡片】
电子式:为方便起见,我们在元素符号周围用“·”或“×”来表示原子的最外层电子(价电子)。这种式子叫做电子式。
⑴原子的电子式:
H
O
Cl
Mg
Na
⑵离子的电子式:
① 阴离子的电子式
一般用 表示
R
n-
Cl
O
2-
O
H
-
② 阳离子的电子式
即离子符号
如:Mg
2
离子化合物的电子式
离子化合物的电子式由阳离子的电子式和阴离子的电子式组合而成.
【注意】相同的离子不能写在一起,一般对称排列如:
Mg
2
Br
Br
AB型
AB2型
A2B型
NaCl
Na2O
MgCl2
‥
‥
‥
‥
A.Ca2+[∶Cl∶]-2 B.Na+[∶S∶]2-Na+
C. [Mg2+][∶O∶]2- D. Na+[∶F∶]-
‥
‥
‥
‥
例题5、下列化合物电子式书写正确的是 ( )
BD
例题6、写出下列物质的电子式:
氧原子,氧离子, CaF2 CaO
·O·
··
··
[∶O∶]2-
‥
‥
Ca2+
[ F ]-
··
··
:
:
[ F ]-
··
··
:
:
Ca2+
[ O ]2-
··
··
:
:
用电子式表示离子化合物的形成过程
用电子式表示氯化钠的形成过程
用电子式表示溴化钙(CaBr2)的形成过程
.Cl
··
··
··
Na ·
+
→
[ Cl ]-
··
··
:
:
Na+
注意:
1、相同的原子可以合并写,相同的离子要单个写;
2、不能把“→”写成“=”;
3、用箭头标明电子转移方向。
Br ·
··
··
:
·Ca·
· Br
··
··
:
+
+
→
Ca2+
[ Br ]-
··
··
:
:
[ Br ]-
··
··
:
:
练习
1、下列用电子式表示的化合物的形成过程正确的是( )
A.
B.
C.
D.
B
练习
2、用电子式表示下列物质的形成过程
· O ·
··
··
[ O ]2-
··
··
:
:
· Mg ·
→
Mg2+
··
··
+
[ S ]2-
· S ·
··
··
2K·
→
K+
:
:
K+
MgO K2S NaF
.F
··
··
··
Na ·
+
→
[ F ]-
··
··
:
:
Na+
THANKS
第四章 物质结构 元素周期律
第三节 化学键
思考
观察现象
宏观物质
两磁体靠近
微观粒子
两氢原子靠近
预测现象
静电作用力
【问题1】当2个相反的磁极靠近时,你感觉到了什么?
当2个相同的磁极靠近时,你又感觉到了什么?
【问题2】根据原子的结构猜测2个氢原子靠近时是否有类似的作用呢?
H·
·H
H·
·H
共用电子对
H ×
+
·H
H
H
等同共享
【资料卡片】
电子式:为方便起见,我们在元素符号周围用“·”或“×”来表示原子的最外层电子(价电子)。这种式子叫做电子式。
美国的路易斯(Lewis)提出经典理论,认为分子中的原子可以通过共用电子对使每一个原子达到稳定的稀有气体电子结构,Lewis八隅体规则初步解释了很多元素化合物的形成。
【资料卡片】
数值的大小是描述不同元素的原子对最外层电子的吸引力大小。
【讨论分析】如果把H中的一个H原子换成Cl原子会是怎样的情形?和H2的
形成有什么相同之处,又有哪些不同?
H
ⅹ
+
Cl
∶
∶
∶
·
H
Cl
∶
∶
∶
·
ⅹ
共用电子对
不等同共享(偏移)
离子键
【讨论分析】如果把H中的一个H原子换成Na原子会是怎样的情形?
有着怎样的变化?
离子化
Na
ⅹ
Cl
∶
∶
∶
·
+
Na
ⅹ
Cl
∶
∶
∶
·
Na+
Cl
∶
∶
∶
·
ⅹ
[
]
-
e-
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
+11
8
2
Na+
Cl-
Cl-
+17
8
8
2
+
化学键
H ×
+
·H
H
H
H
ⅹ
+
Cl
∶
∶
∶
·
H
Cl
∶
∶
∶
·
ⅹ
Na
ⅹ
Cl
∶
∶
∶
·
Na+
Cl
∶
∶
∶
·
ⅹ
[
]
-
静电作用
化学键:相邻原子间强烈的相互作用。
ⅹ
·
+
化学键
共价键——相邻原子间通过共用电子对的静电作用
非极性共价键——相同原子间通过共用电子对的静电作用
极性共价键——不同原子间通过共用电子对的静电作用
离子键——相邻阳离子和阴离子的静电作用
化学键——相邻原子或离子间的静电作用
H ×
+
·H
H
H
H
ⅹ
+
Cl
∶
∶
∶
·
H
Cl
∶
∶
∶
·
ⅹ
Na
ⅹ
Cl
∶
∶
∶
·
Na+
Cl
∶
∶
∶
·
ⅹ
[
]
-
·
×
+
离子键
1、定义
阴、阳离子
静电作用(静电引力和静电排斥力)
成键微粒:
成键本质:
阴、阳离子接近到某一定距离时,吸引力和排斥力达到平衡,就形成了离子键。
成键过程:
离子键——相邻阳离子和阴离子的静电作用
离子键
KCl
CaBr2
Na2S
Na2O
NaOH
Na2CO3
Na2SO4
NH4Cl
判断下列物质是否含有离子键。
【思考】如何简单判断物质是否有离子键?
从元素种类的角度
从物质类别的角度
离子键
2、含有离子键的物质有:
如:KCl、Na2O、 Na2O2、 Na2S、MgCl2等
从元素种类的角度来看:
从组成元素来看:
如:NaOH、K2SO4、 NH4Cl 、Na2CO3、Mg(NO3)2 、Na2O等
强碱、大多数的盐(含铵盐)、活泼金属氧化物
活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)之间形成的化合物
练习
a.H2O b.CaCl2 c.NaOH d.H2SO4
e.Na2O f.CO2 g.Na2O2 h.NH4Cl
bcegh
例2、下列各数值表示有关元素的原子序数,能以离子键相互结合成稳定化合物的是 ( )
A.10与19 B.6与16 C.11与17 D.14与8
C
例1、下列物质中含有离子键的是 ( )
离子化合物
强碱: NaOH、 Ba(OH)2
活泼金属氧化物:MgO、Na2O
(1)定义:含有离子键的化合物称为离子化合物
注意:
①离子化合物不一定含金属元素
如:铵盐 NH4Cl
如:BeCl2 AlCl3
大多数盐:NaCl、 MgSO4、NH4Cl
(2)类别
②含金属元素的化合物不一定是离子化合物
练习
例3、正误判断:
(1)含有离子键的化合物一定是离子化合物。
(2)离子化合物中一定含有阴离子和阳离子。
(3)含有金属元素的化合物一定是离子化合物。
(4)阴、阳离子通过静电引力所形成的化学键叫做离子键。
(5)由非金属元素组成的化合物一定不是离子化合物。
√
√
×
例4、下列物质中不属于离子化合物的是 ( )
A.NH4NO3 B. NaOH C.MgCl2 D.H2SO4
D
×
×
电子式
【资料卡片】
电子式:为方便起见,我们在元素符号周围用“·”或“×”来表示原子的最外层电子(价电子)。这种式子叫做电子式。
⑴原子的电子式:
H
O
Cl
Mg
Na
⑵离子的电子式:
① 阴离子的电子式
一般用 表示
R
n-
Cl
O
2-
O
H
-
② 阳离子的电子式
即离子符号
如:Mg
2
离子化合物的电子式
离子化合物的电子式由阳离子的电子式和阴离子的电子式组合而成.
【注意】相同的离子不能写在一起,一般对称排列如:
Mg
2
Br
Br
AB型
AB2型
A2B型
NaCl
Na2O
MgCl2
‥
‥
‥
‥
A.Ca2+[∶Cl∶]-2 B.Na+[∶S∶]2-Na+
C. [Mg2+][∶O∶]2- D. Na+[∶F∶]-
‥
‥
‥
‥
例题5、下列化合物电子式书写正确的是 ( )
BD
例题6、写出下列物质的电子式:
氧原子,氧离子, CaF2 CaO
·O·
··
··
[∶O∶]2-
‥
‥
Ca2+
[ F ]-
··
··
:
:
[ F ]-
··
··
:
:
Ca2+
[ O ]2-
··
··
:
:
用电子式表示离子化合物的形成过程
用电子式表示氯化钠的形成过程
用电子式表示溴化钙(CaBr2)的形成过程
.Cl
··
··
··
Na ·
+
→
[ Cl ]-
··
··
:
:
Na+
注意:
1、相同的原子可以合并写,相同的离子要单个写;
2、不能把“→”写成“=”;
3、用箭头标明电子转移方向。
Br ·
··
··
:
·Ca·
· Br
··
··
:
+
+
→
Ca2+
[ Br ]-
··
··
:
:
[ Br ]-
··
··
:
:
练习
1、下列用电子式表示的化合物的形成过程正确的是( )
A.
B.
C.
D.
B
练习
2、用电子式表示下列物质的形成过程
· O ·
··
··
[ O ]2-
··
··
:
:
· Mg ·
→
Mg2+
··
··
+
[ S ]2-
· S ·
··
··
2K·
→
K+
:
:
K+
MgO K2S NaF
.F
··
··
··
Na ·
+
→
[ F ]-
··
··
:
:
Na+
THANKS
