2.3.3气体的摩尔体积 课件(共29张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 2.3.3气体的摩尔体积 课件(共29张ppt)化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-20 00:00:00 | ||
图片预览





文档简介
(共29张PPT)
小结
1、物质的量(n)的单位,符号mol
2、阿伏伽德罗常数(NA)
数值:6.02×1023(近似值)
单位:mol-1
3、摩尔质量(M)
摩尔质量数值 = 相对原子(分子)质量
单位:g/mol
n =
NA
N
=
M
m
化学方程式的质量与物质的量
2H2 + O2 = 2H2O
微粒个数比
2mol :
1mol :
2mol
质量
2g/mol ×2mol
= 4g
32g/mol ×1mol
= 32g
18g/mol ×2mol
= 36g
物质的量架起宏观质量与微观粒子数之间的桥梁。
气体的摩尔体积
第三节 物质的量
海洋、冰川和云朵
实际生活中气体常见的计量方式
第三节 物质的量
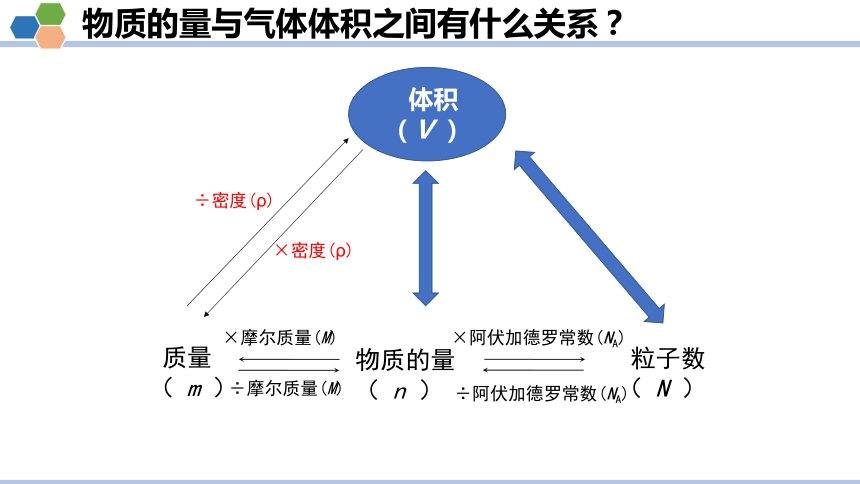
物质的量与气体体积之间有什么关系?
质量
( m )
物质的量
( n )
粒子数
( N )
×摩尔质量(M)
÷摩尔质量(M)
÷阿伏加德罗常数(NA)
×阿伏加德罗常数(NA)
体积
(V )
÷密度(ρ)
×密度(ρ)
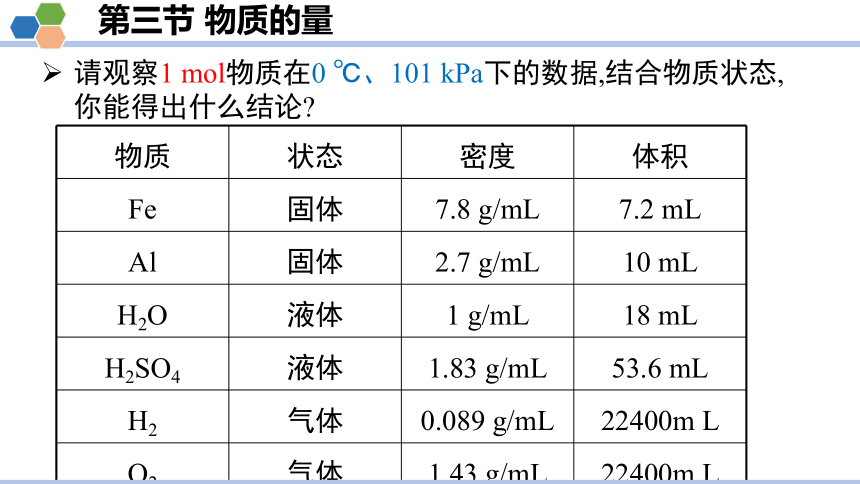
请观察1 mol物质在0 ℃、101 kPa下的数据,结合物质状态,你能得出什么结论
物质 状态 密度 体积
Fe 固体 7.8 g/mL 7.2 mL
Al 固体 2.7 g/mL 10 mL
H2O 液体 1 g/mL 18 mL
H2SO4 液体 1.83 g/mL 53.6 mL
H2 气体 0.089 g/mL 22400m L
O2 气体 1.43 g/mL 22400m L
第三节 物质的量
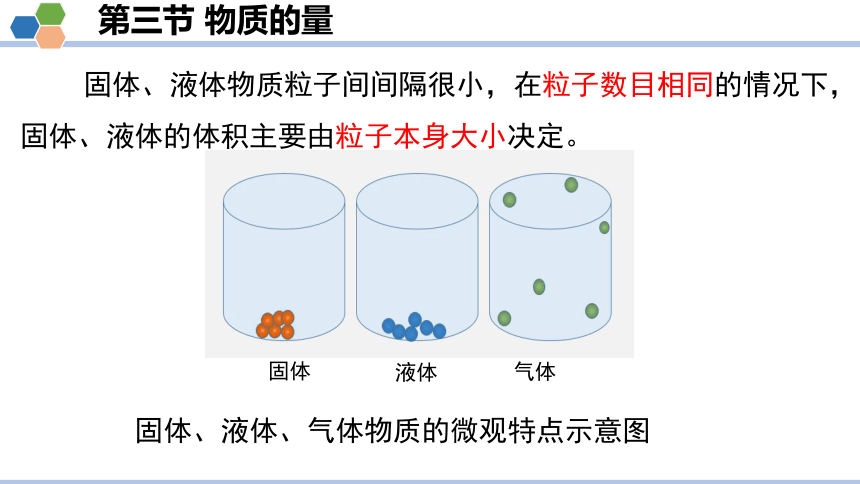
固体、液体、气体物质的微观特点示意图
固体
液体
气体
固体、液体物质粒子间间隔很小,在粒子数目相同的情况下,固体、液体的体积主要由粒子本身大小决定。
第三节 物质的量
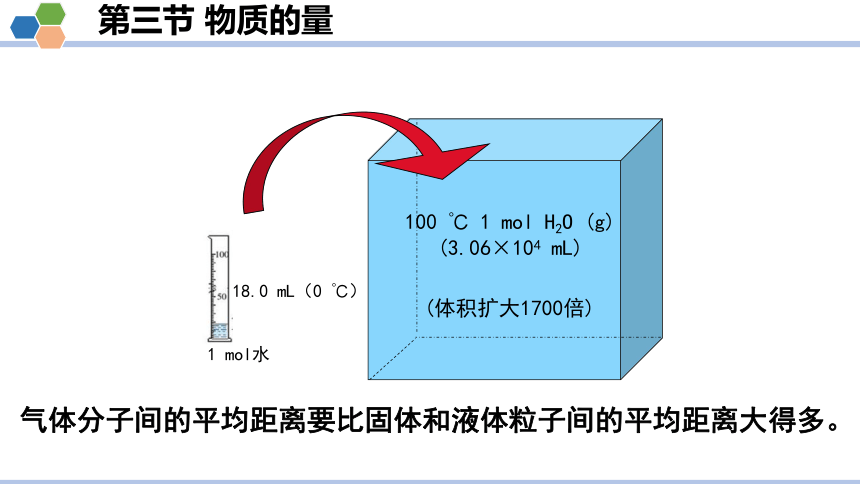
气体分子间的平均距离要比固体和液体粒子间的平均距离大得多。
18.0 mL(0 ℃)
100 ℃ 1 mol H2O (g) (3.06×104 mL)
(体积扩大1700倍)
1 mol水
第三节 物质的量
不同状态的物质,体积大小跟哪些因素有关呢?
物质的体积
粒子数目
粒子间距
粒子大小
第三节 物质的量
固体、液体的体积
物质的
体积
气体的
体积
粒子
的大小
粒子
的数目
粒子间
的距离
决定于
影响物质体积的因素
影响物质体积的因素
影响气体体积的因素有哪些?
压强
影响气体体积的因素有哪些?
温度
气体的体积与压强、温度、物质的量的关系
P/Pa
V/cm3
图1 温度不变时,压强与体积的关系
图2 检验p与线性关系
cm3
P/Pa
o
V/m3
t/℃
o
V/m3
t/℃
-273.15
t/℃
V/m3
273.15
气体的体积与压强、温度、物质的量的关系
压强不变时体积与温度的关系
V∝T
气体的体积物质的量的关系
V∝n
气体的体积与压强、温度、物质的量的关系
V∝n
V∝T
V∝
(n, T一定)
(n, P一定)
(P,T一定)
理想气体状态方程
请观察1 mol物质在0 ℃、101 kPa下的数据,结合物质状态,你能得出什么结论
物质 状态 密度 体积
Fe 固体 7.8 g/mL 7.2 mL
Al 固体 2.7 g/mL 10 mL
H2O 液体 1 g/mL 18 mL
H2SO4 液体 1.83 g/mL 53.6 mL
H2 气体 0.089 g/mL 22400m L
O2 气体 1.43 g/mL 22400 mL
在相同条件下,具有相同粒子数的不同气体具有相同的体积。
第三节 物质的量
气体摩尔体积:
概念:单位物质的量的气体所占的体积。
符号:Vm
公式:
常用单位有L/mol(L·mol-1)或m3/mol。
在0℃和101kpa的条件下,Vm=22.4L/mol
在标准状况即0℃和101kpa下,1mol任何气体所占的体
积都约为22.4L
条件:标准状况
( 0 ℃,101 kPa )
对象:任何气体
物质的量:1 mol
体积约占
22.4 L
22.4 L
(标准状况)
6.02×1023分子
标准状况下的气体摩尔体积示意图
标准状况下气体摩尔体积
第三节 物质的量
物质 气体摩尔体积 /(L·mol-1) 0 ℃ 101 kPa 25 ℃ 101 kPa 0 ℃
202 kPa
H2 22.4 24.5 11.2
O2 22.4 24.5 11.2
CO2 22.4 24.5 11.2
不同温度、压强下的气体摩尔体积
【思考】气体摩尔体积(Vm)的数值是否固定不变呢?
第三节 物质的量
【练习】请判断正误,并进行分析
(1)标准状况下,1 mol任何物质的体积都约为22.4 L。
(2) 1 mol气体的体积约为22.4 L。
(4)22.4 L气体所含分子数一定大于11.2 L气体所含的分子数。
(3)标准状况下,1 mol的O2和N2混合气(任意比),其体积约为22.4 L。
(5)任何条件下,气体摩尔体积都是22.4 L。
错误,物质应是气体
错误,未指明条件——标准状况
错误,未指明气体体积是否在相同温度和压强下测定
正确,气体体积与分子种类无关
错误,未指明温度和压强;气体摩尔体积的单位是L/mol
(1)33.6 L H2的物质的量是多少 (标况)
(2)16 g O2的体积是多少?(标况)
(3)44.8 L N2中含有的N2分子数是多少?(标况)
练习
同温、同压、同体积的气体
理想气体状态方程的应用
同物质的量、同分子个数
——阿伏伽德罗定律
解释:相同条件下的气体,体积相同时,分子数必相同;反之,分子数相同时,体积也必相同,但原子数不一定相同。
阿伏伽德罗定律及其推论
推论
同温同压下,气体物质的量与气体体积的关系
同温同压下,气体的密度与气体摩尔质量的关系
同温同体积下,压强与物质的量的关系
(气体/液体/固体)
(气体/液体/固体)
(气体/液体/固体)
(气体)
× NA
×M
×Vm
小结
气体的体积物质的量的关系
气体的体积物质的量的关系
THANKS
小结
1、物质的量(n)的单位,符号mol
2、阿伏伽德罗常数(NA)
数值:6.02×1023(近似值)
单位:mol-1
3、摩尔质量(M)
摩尔质量数值 = 相对原子(分子)质量
单位:g/mol
n =
NA
N
=
M
m
化学方程式的质量与物质的量
2H2 + O2 = 2H2O
微粒个数比
2mol :
1mol :
2mol
质量
2g/mol ×2mol
= 4g
32g/mol ×1mol
= 32g
18g/mol ×2mol
= 36g
物质的量架起宏观质量与微观粒子数之间的桥梁。
气体的摩尔体积
第三节 物质的量
海洋、冰川和云朵
实际生活中气体常见的计量方式
第三节 物质的量
物质的量与气体体积之间有什么关系?
质量
( m )
物质的量
( n )
粒子数
( N )
×摩尔质量(M)
÷摩尔质量(M)
÷阿伏加德罗常数(NA)
×阿伏加德罗常数(NA)
体积
(V )
÷密度(ρ)
×密度(ρ)
请观察1 mol物质在0 ℃、101 kPa下的数据,结合物质状态,你能得出什么结论
物质 状态 密度 体积
Fe 固体 7.8 g/mL 7.2 mL
Al 固体 2.7 g/mL 10 mL
H2O 液体 1 g/mL 18 mL
H2SO4 液体 1.83 g/mL 53.6 mL
H2 气体 0.089 g/mL 22400m L
O2 气体 1.43 g/mL 22400m L
第三节 物质的量
固体、液体、气体物质的微观特点示意图
固体
液体
气体
固体、液体物质粒子间间隔很小,在粒子数目相同的情况下,固体、液体的体积主要由粒子本身大小决定。
第三节 物质的量
气体分子间的平均距离要比固体和液体粒子间的平均距离大得多。
18.0 mL(0 ℃)
100 ℃ 1 mol H2O (g) (3.06×104 mL)
(体积扩大1700倍)
1 mol水
第三节 物质的量
不同状态的物质,体积大小跟哪些因素有关呢?
物质的体积
粒子数目
粒子间距
粒子大小
第三节 物质的量
固体、液体的体积
物质的
体积
气体的
体积
粒子
的大小
粒子
的数目
粒子间
的距离
决定于
影响物质体积的因素
影响物质体积的因素
影响气体体积的因素有哪些?
压强
影响气体体积的因素有哪些?
温度
气体的体积与压强、温度、物质的量的关系
P/Pa
V/cm3
图1 温度不变时,压强与体积的关系
图2 检验p与线性关系
cm3
P/Pa
o
V/m3
t/℃
o
V/m3
t/℃
-273.15
t/℃
V/m3
273.15
气体的体积与压强、温度、物质的量的关系
压强不变时体积与温度的关系
V∝T
气体的体积物质的量的关系
V∝n
气体的体积与压强、温度、物质的量的关系
V∝n
V∝T
V∝
(n, T一定)
(n, P一定)
(P,T一定)
理想气体状态方程
请观察1 mol物质在0 ℃、101 kPa下的数据,结合物质状态,你能得出什么结论
物质 状态 密度 体积
Fe 固体 7.8 g/mL 7.2 mL
Al 固体 2.7 g/mL 10 mL
H2O 液体 1 g/mL 18 mL
H2SO4 液体 1.83 g/mL 53.6 mL
H2 气体 0.089 g/mL 22400m L
O2 气体 1.43 g/mL 22400 mL
在相同条件下,具有相同粒子数的不同气体具有相同的体积。
第三节 物质的量
气体摩尔体积:
概念:单位物质的量的气体所占的体积。
符号:Vm
公式:
常用单位有L/mol(L·mol-1)或m3/mol。
在0℃和101kpa的条件下,Vm=22.4L/mol
在标准状况即0℃和101kpa下,1mol任何气体所占的体
积都约为22.4L
条件:标准状况
( 0 ℃,101 kPa )
对象:任何气体
物质的量:1 mol
体积约占
22.4 L
22.4 L
(标准状况)
6.02×1023分子
标准状况下的气体摩尔体积示意图
标准状况下气体摩尔体积
第三节 物质的量
物质 气体摩尔体积 /(L·mol-1) 0 ℃ 101 kPa 25 ℃ 101 kPa 0 ℃
202 kPa
H2 22.4 24.5 11.2
O2 22.4 24.5 11.2
CO2 22.4 24.5 11.2
不同温度、压强下的气体摩尔体积
【思考】气体摩尔体积(Vm)的数值是否固定不变呢?
第三节 物质的量
【练习】请判断正误,并进行分析
(1)标准状况下,1 mol任何物质的体积都约为22.4 L。
(2) 1 mol气体的体积约为22.4 L。
(4)22.4 L气体所含分子数一定大于11.2 L气体所含的分子数。
(3)标准状况下,1 mol的O2和N2混合气(任意比),其体积约为22.4 L。
(5)任何条件下,气体摩尔体积都是22.4 L。
错误,物质应是气体
错误,未指明条件——标准状况
错误,未指明气体体积是否在相同温度和压强下测定
正确,气体体积与分子种类无关
错误,未指明温度和压强;气体摩尔体积的单位是L/mol
(1)33.6 L H2的物质的量是多少 (标况)
(2)16 g O2的体积是多少?(标况)
(3)44.8 L N2中含有的N2分子数是多少?(标况)
练习
同温、同压、同体积的气体
理想气体状态方程的应用
同物质的量、同分子个数
——阿伏伽德罗定律
解释:相同条件下的气体,体积相同时,分子数必相同;反之,分子数相同时,体积也必相同,但原子数不一定相同。
阿伏伽德罗定律及其推论
推论
同温同压下,气体物质的量与气体体积的关系
同温同压下,气体的密度与气体摩尔质量的关系
同温同体积下,压强与物质的量的关系
(气体/液体/固体)
(气体/液体/固体)
(气体/液体/固体)
(气体)
× NA
×M
×Vm
小结
气体的体积物质的量的关系
气体的体积物质的量的关系
THANKS
