2.3.4物质的量浓度 课件(共28张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 2.3.4物质的量浓度 课件(共28张ppt)化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-20 00:00:00 | ||
图片预览







文档简介
(共28张PPT)
第二章 海水中的重要元素—钠和氯
第三节 物质的量
生活中常见的浓度表示方式
20%硫酸溶液
1:4的硫酸溶液
啤酒 酒精度3.6% vol
物质的量浓度
m(溶质):m(溶液)
V(H2SO4):V(水)
V(溶质):V(溶液)
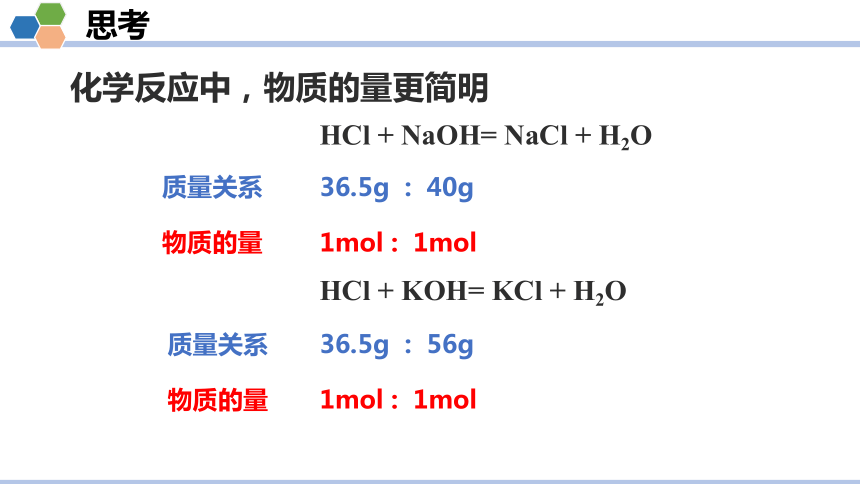
化学反应中,物质的量更简明
思考
HCl + NaOH= NaCl + H2O
HCl + KOH= KCl + H2O
36.5g : 40g
1mol : 1mol
质量关系
物质的量
36.5g : 56g
1mol : 1mol
质量关系
物质的量
液体量取体积更方便
量取溶液还是溶剂的体积?
量取溶液的体积更方便、更实用!
1. 概念:表示单位体积的溶液里所含溶质B的物质的量
也称为B的物质的量浓度
2.符号:CB
3.表达式:
4.单位: mol/L (或mol·L-1)
注意:V是溶液的体积,而非溶剂体积
【思考】常温下,某氢氧化钠溶液的cB = 2.0 mol/ L ,其表示什么意义?
1L的氢氧化钠溶液中含2mol的NaOH。
一、物质的量浓度
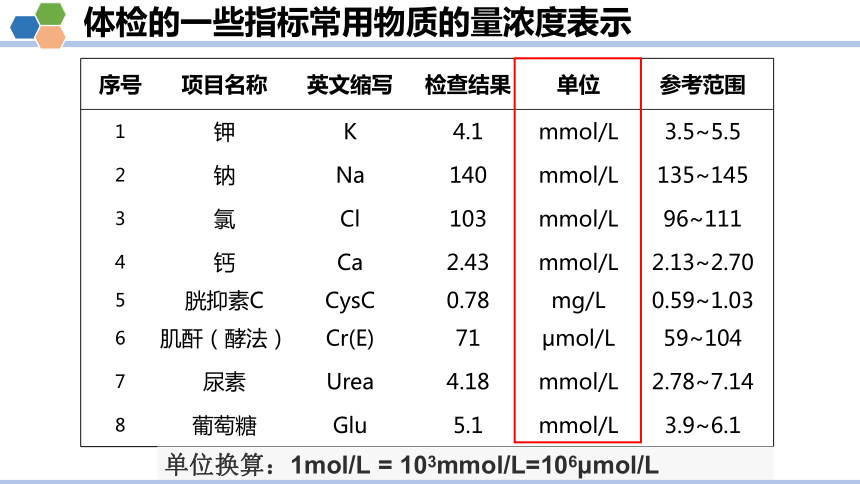
体检的一些指标常用物质的量浓度表示
序号 项目名称 英文缩写 检查结果 单位 参考范围
1 钾 K 4.1 mmol/L 3.5~5.5
2 钠 Na 140 mmol/L 135~145
3 氯 Cl 103 mmol/L 96~111
4 钙 Ca 2.43 mmol/L 2.13~2.70
5 胱抑素C CysC 0.78 mg/L 0.59~1.03
6 肌酐(酵法) Cr(E) 71 μmol/L 59~104
7 尿素 Urea 4.18 mmol/L 2.78~7.14
8 葡萄糖 Glu 5.1 mmol/L 3.9~6.1
单位换算:1mol/L = 103mmol/L=106μmol/L
(1)所有物质都有浓度吗?比如MnO2与浓盐酸制氯气中的MnO2固体。
(2)物质的量浓度为1 mol/L的NaCl溶液取出一半,其浓度会变成0.5 mol/L吗?
不会。根据溶液的均一性,溶液各处溶质的物质的量浓度相同。
固体或纯液体不讨论物质的量浓度。
(3)将1molNaCl溶于水制成1L的溶液,则c=1mol/L
正确。
(4)将1molNaCl溶于1L水中,则c=1mol/L
错误。溶液的体积并不为1L。
思考
溶液中离子的物质的量浓度
如何理解250mL 1.6mol/L NaCl溶液?
溶液总体积?
NaCl=Na++ Cl-
C(Na+) =1.6mol/L
C(Cl-) =1.6mol/L
C(NaCl) =1.6mol/L
1.6mol/L MgCl2溶液?
溶液中离子的物质的量浓度
例1 下列溶液中Cl-浓度分别是?
A. 200mL 2mol/LMgCl2溶液
B. 1000mL 2.5mol/L NaCl溶液
C. 250mL 1mol/LAlCl3溶液
D. 300mL 5mol/L KClO3溶液
Cl-浓度最大的是?
与体积无关
溶液中离子的物质的量浓度
例2 将2.0mol/L CuSO4溶液和1.0mol/LH2SO4溶液等体积混合,混合溶液中?
c(CuSO4)
c(H2SO4)
c(H+)
c(SO42-)
溶液中离子的物质的量浓度
例3 在 VL Al2(SO4)3溶液中,含Al3+的质量为ag,则SO42-的物质的量浓度为多少?
已知相对原子质量:O-16、Al-27、S-32
2.与其他浓度表达的换算
例4 98%浓硫酸,已知溶液密度为1.84g/mL,
则物质的量浓度?
已知相对原子质量:H-1、O-16、S-32
与其他浓度表达的换算
例5 配制500mL 1mol/L硫酸溶液,需量取密度为1.84g/mL,质量分数为98%的浓硫酸多少mL?
稀释前后,溶质的物质的量相等
c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液)
n(浓溶液)=n(稀溶液)
已知相对原子质量:H-1、O-16、S-32
二、配制一定物质的量浓度的溶液
用NaCl固体配制100mL 1.0mol/L NaCl溶液
取0.1mol NaCl溶液
加水至溶液为100mL?
用天平称取质量
仪器?
【思考】实验室中,怎样配制一定物质的量浓度的溶液?
刻线
容积
温度
标识
构造:细颈、梨形的平底玻璃瓶,瓶口配有磨口玻璃塞或塑料塞。
常用规格:50ml、100ml、250ml、500ml和1000ml。
容量瓶
注意事项:
①使用前:
——检查是否漏水。
②使用时:
——不能在容量瓶中进行溶解、稀释的操作或进
行化学反应,不能加热。
③使用后:
——不能长期存放溶液。及时转移,洗净晾干。
④谈及容量瓶:
——应该指明规格大小!如100ml容量瓶
容量瓶的使用
任务目标:配制100ml 1.00mol/L 的NaCl溶液
(1)计算
需要NaCl固体的质量为:mB=nBM=cBV
mB=1.00mol/L×0.10L×58.5g/mol=5.85g
(2)称量
可用托盘天平称量需要的NaCl固体5.9g
将称量好的NaCl固体放入烧杯中,加适量蒸馏水并用玻璃棒搅拌,促使溶质全部溶解(并冷却至室温)。
(3)溶解
为什么称取的是5.9g?
配制一定物质的量浓度的溶液
(4)移液
将烧杯中的溶液用玻璃棒引流并注入100mL容量瓶中。
(5)洗涤
将蒸馏水注入容量瓶 ,当液面距瓶颈刻度线1-2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切。盖好瓶塞,摇匀。
(6)定容
用少量蒸馏水洗涤烧杯内壁及玻璃棒2-3次,并将洗涤液转移到容量瓶中,轻轻摇动容量瓶,使溶液混合均匀。
(7)装瓶
将配制好的溶液倒入洁净试剂瓶中并贴标签。
配制一定物质的量浓度的溶液
配制过程图示
配制一定物质的量浓度的溶液
配制一定物质的量浓度的溶液
用98%浓硫酸配制100ml 1mol/L的稀硫酸溶液
步骤?
【思考】是向水中加入浓硫酸进行稀释还是向浓硫酸中加入水?
实验反思:下列操作会使配制的溶液浓度偏大、偏小还是无影响?判断依据是什么?
①如果转移时将烧杯中的溶液不慎洒到容量瓶外
②如果定容读数时俯视容量瓶上的刻度线
③如果容量瓶未晾干,内部有少量蒸馏水
偏小
偏大
无影响
误差分析
练习
用“偏大”、“偏小”或“无影响”填空。
能引起误差的一些操作 c/
mol·L-1
托盘 天平 (1)药品、砝码左右位置颠倒(移动游码) ______
(2)称量易潮解的物质(如NaOH)时间过长 ______
量筒 (3)用量筒量取液体(溶质)时,仰视读数 ______
(4)用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中 ______
偏小
偏小
偏大
偏大
练习
用“偏大”、“偏小”或“无影响”填空。
容量瓶 (9)未冷却到室温就注入容量瓶定容 ______
(10)向容量瓶转移溶液时有少量液体流出 ______
(11)定容时,水加多了,用滴管吸出 ______
(12)定容后,经振荡、摇匀、静置,液面下降再加水 ______
(13)定容时,仰视读刻度数 ______
(14)定容时,俯视读刻度数 ______
(15)配好的溶液装入干净的试剂瓶时,不慎溅出部分溶液 ________
偏大
偏小
偏小
偏小
偏小
偏大
无影响
练习
如图是某学校从化学试剂商店买回来的盐酸试剂标签上的部分内容。
(1)该盐酸的物质的量浓度是 mol·L-1。
(2)配制240mL3mol·L-1的稀盐酸,操作
步骤如下:(浓盐酸溶于水时会放出热量):
①所需实验用品有:烧杯、玻璃棒、100mL
量筒、 、胶头滴管、空试剂瓶、
标签纸
②经计算,需用量筒量取 mL的该浓盐酸
③将量好的浓盐酸缓慢倒入盛有适量蒸馏水的烧杯中,并不断用玻璃棒搅拌,待 ,(填写后续实验操作)再用玻璃棒引流至容量瓶中,……
④向上述容量瓶中继续加入蒸馏水……
⑤将配制好的溶液转移至空试剂瓶中,贴好标签
12
250mL容量瓶
62.5
溶液冷却至室温后
小结
(3)下列实验操作对所配制溶液的浓度是否有影响,请填写“偏大”“偏小”或“无影响”
①量取浓盐酸时俯视刻度线 。
②定容时俯视刻度线 。
③洗净后的容量瓶内残留有水就将稀释后的盐酸转移到容量瓶中 。
偏大
偏小
无影响
小结
THANKS
第二章 海水中的重要元素—钠和氯
第三节 物质的量
生活中常见的浓度表示方式
20%硫酸溶液
1:4的硫酸溶液
啤酒 酒精度3.6% vol
物质的量浓度
m(溶质):m(溶液)
V(H2SO4):V(水)
V(溶质):V(溶液)
化学反应中,物质的量更简明
思考
HCl + NaOH= NaCl + H2O
HCl + KOH= KCl + H2O
36.5g : 40g
1mol : 1mol
质量关系
物质的量
36.5g : 56g
1mol : 1mol
质量关系
物质的量
液体量取体积更方便
量取溶液还是溶剂的体积?
量取溶液的体积更方便、更实用!
1. 概念:表示单位体积的溶液里所含溶质B的物质的量
也称为B的物质的量浓度
2.符号:CB
3.表达式:
4.单位: mol/L (或mol·L-1)
注意:V是溶液的体积,而非溶剂体积
【思考】常温下,某氢氧化钠溶液的cB = 2.0 mol/ L ,其表示什么意义?
1L的氢氧化钠溶液中含2mol的NaOH。
一、物质的量浓度
体检的一些指标常用物质的量浓度表示
序号 项目名称 英文缩写 检查结果 单位 参考范围
1 钾 K 4.1 mmol/L 3.5~5.5
2 钠 Na 140 mmol/L 135~145
3 氯 Cl 103 mmol/L 96~111
4 钙 Ca 2.43 mmol/L 2.13~2.70
5 胱抑素C CysC 0.78 mg/L 0.59~1.03
6 肌酐(酵法) Cr(E) 71 μmol/L 59~104
7 尿素 Urea 4.18 mmol/L 2.78~7.14
8 葡萄糖 Glu 5.1 mmol/L 3.9~6.1
单位换算:1mol/L = 103mmol/L=106μmol/L
(1)所有物质都有浓度吗?比如MnO2与浓盐酸制氯气中的MnO2固体。
(2)物质的量浓度为1 mol/L的NaCl溶液取出一半,其浓度会变成0.5 mol/L吗?
不会。根据溶液的均一性,溶液各处溶质的物质的量浓度相同。
固体或纯液体不讨论物质的量浓度。
(3)将1molNaCl溶于水制成1L的溶液,则c=1mol/L
正确。
(4)将1molNaCl溶于1L水中,则c=1mol/L
错误。溶液的体积并不为1L。
思考
溶液中离子的物质的量浓度
如何理解250mL 1.6mol/L NaCl溶液?
溶液总体积?
NaCl=Na++ Cl-
C(Na+) =1.6mol/L
C(Cl-) =1.6mol/L
C(NaCl) =1.6mol/L
1.6mol/L MgCl2溶液?
溶液中离子的物质的量浓度
例1 下列溶液中Cl-浓度分别是?
A. 200mL 2mol/LMgCl2溶液
B. 1000mL 2.5mol/L NaCl溶液
C. 250mL 1mol/LAlCl3溶液
D. 300mL 5mol/L KClO3溶液
Cl-浓度最大的是?
与体积无关
溶液中离子的物质的量浓度
例2 将2.0mol/L CuSO4溶液和1.0mol/LH2SO4溶液等体积混合,混合溶液中?
c(CuSO4)
c(H2SO4)
c(H+)
c(SO42-)
溶液中离子的物质的量浓度
例3 在 VL Al2(SO4)3溶液中,含Al3+的质量为ag,则SO42-的物质的量浓度为多少?
已知相对原子质量:O-16、Al-27、S-32
2.与其他浓度表达的换算
例4 98%浓硫酸,已知溶液密度为1.84g/mL,
则物质的量浓度?
已知相对原子质量:H-1、O-16、S-32
与其他浓度表达的换算
例5 配制500mL 1mol/L硫酸溶液,需量取密度为1.84g/mL,质量分数为98%的浓硫酸多少mL?
稀释前后,溶质的物质的量相等
c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液)
n(浓溶液)=n(稀溶液)
已知相对原子质量:H-1、O-16、S-32
二、配制一定物质的量浓度的溶液
用NaCl固体配制100mL 1.0mol/L NaCl溶液
取0.1mol NaCl溶液
加水至溶液为100mL?
用天平称取质量
仪器?
【思考】实验室中,怎样配制一定物质的量浓度的溶液?
刻线
容积
温度
标识
构造:细颈、梨形的平底玻璃瓶,瓶口配有磨口玻璃塞或塑料塞。
常用规格:50ml、100ml、250ml、500ml和1000ml。
容量瓶
注意事项:
①使用前:
——检查是否漏水。
②使用时:
——不能在容量瓶中进行溶解、稀释的操作或进
行化学反应,不能加热。
③使用后:
——不能长期存放溶液。及时转移,洗净晾干。
④谈及容量瓶:
——应该指明规格大小!如100ml容量瓶
容量瓶的使用
任务目标:配制100ml 1.00mol/L 的NaCl溶液
(1)计算
需要NaCl固体的质量为:mB=nBM=cBV
mB=1.00mol/L×0.10L×58.5g/mol=5.85g
(2)称量
可用托盘天平称量需要的NaCl固体5.9g
将称量好的NaCl固体放入烧杯中,加适量蒸馏水并用玻璃棒搅拌,促使溶质全部溶解(并冷却至室温)。
(3)溶解
为什么称取的是5.9g?
配制一定物质的量浓度的溶液
(4)移液
将烧杯中的溶液用玻璃棒引流并注入100mL容量瓶中。
(5)洗涤
将蒸馏水注入容量瓶 ,当液面距瓶颈刻度线1-2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切。盖好瓶塞,摇匀。
(6)定容
用少量蒸馏水洗涤烧杯内壁及玻璃棒2-3次,并将洗涤液转移到容量瓶中,轻轻摇动容量瓶,使溶液混合均匀。
(7)装瓶
将配制好的溶液倒入洁净试剂瓶中并贴标签。
配制一定物质的量浓度的溶液
配制过程图示
配制一定物质的量浓度的溶液
配制一定物质的量浓度的溶液
用98%浓硫酸配制100ml 1mol/L的稀硫酸溶液
步骤?
【思考】是向水中加入浓硫酸进行稀释还是向浓硫酸中加入水?
实验反思:下列操作会使配制的溶液浓度偏大、偏小还是无影响?判断依据是什么?
①如果转移时将烧杯中的溶液不慎洒到容量瓶外
②如果定容读数时俯视容量瓶上的刻度线
③如果容量瓶未晾干,内部有少量蒸馏水
偏小
偏大
无影响
误差分析
练习
用“偏大”、“偏小”或“无影响”填空。
能引起误差的一些操作 c/
mol·L-1
托盘 天平 (1)药品、砝码左右位置颠倒(移动游码) ______
(2)称量易潮解的物质(如NaOH)时间过长 ______
量筒 (3)用量筒量取液体(溶质)时,仰视读数 ______
(4)用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中 ______
偏小
偏小
偏大
偏大
练习
用“偏大”、“偏小”或“无影响”填空。
容量瓶 (9)未冷却到室温就注入容量瓶定容 ______
(10)向容量瓶转移溶液时有少量液体流出 ______
(11)定容时,水加多了,用滴管吸出 ______
(12)定容后,经振荡、摇匀、静置,液面下降再加水 ______
(13)定容时,仰视读刻度数 ______
(14)定容时,俯视读刻度数 ______
(15)配好的溶液装入干净的试剂瓶时,不慎溅出部分溶液 ________
偏大
偏小
偏小
偏小
偏小
偏大
无影响
练习
如图是某学校从化学试剂商店买回来的盐酸试剂标签上的部分内容。
(1)该盐酸的物质的量浓度是 mol·L-1。
(2)配制240mL3mol·L-1的稀盐酸,操作
步骤如下:(浓盐酸溶于水时会放出热量):
①所需实验用品有:烧杯、玻璃棒、100mL
量筒、 、胶头滴管、空试剂瓶、
标签纸
②经计算,需用量筒量取 mL的该浓盐酸
③将量好的浓盐酸缓慢倒入盛有适量蒸馏水的烧杯中,并不断用玻璃棒搅拌,待 ,(填写后续实验操作)再用玻璃棒引流至容量瓶中,……
④向上述容量瓶中继续加入蒸馏水……
⑤将配制好的溶液转移至空试剂瓶中,贴好标签
12
250mL容量瓶
62.5
溶液冷却至室温后
小结
(3)下列实验操作对所配制溶液的浓度是否有影响,请填写“偏大”“偏小”或“无影响”
①量取浓盐酸时俯视刻度线 。
②定容时俯视刻度线 。
③洗净后的容量瓶内残留有水就将稀释后的盐酸转移到容量瓶中 。
偏大
偏小
无影响
小结
THANKS
