2.4化学反应的调控 课件(共37张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.4化学反应的调控 课件(共37张ppt)化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 14.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-21 14:44:48 | ||
图片预览








文档简介
(共37张PPT)
第四节 化学反应的调控
第二章
化学反应速率与化学反应平衡
合成氨生产的工艺流程
2
合成氨反应条件与原理分析
1
本节重难点
化工生产中调控反应的一般思路
3
鼓风加快物质燃烧
降温延长食物储存时间
降低温度以此灭火
生活中我们对化学反应的调控示例
化工生产中,对化学反应的调控,应该注意哪些问题呢?
下面我们以工业合成氨生产条件的选择为例,研究化学反应的调控问题。
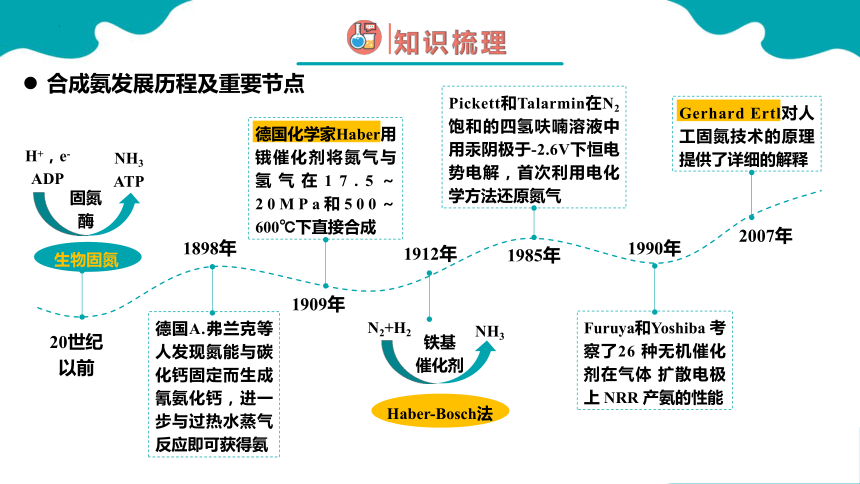
合成氨发展历程及重要节点
20世纪
以前
生物固氮
H+,e-
ADP
固氮
酶
NH3
ATP
1898年
1909年
德国A.弗兰克等人发现氮能与碳化钙固定而生成氰氨化钙,进一步与过热水蒸气反应即可获得氨
德国化学家Haber用锇催化剂将氮气与氢气在17.5~20MPa和500~600℃下直接合成
1912年
1985年
1990年
Furuya和Yoshiba 考察了26 种无机催化剂在气体 扩散电极上 NRR 产氨的性能
2007年
Gerhard Ertl对人工固氮技术的原理提供了详细的解释
Haber-Bosch法
铁基
催化剂
N2+H2
NH3
Pickett和Talarmin在N2饱和的四氢呋喃溶液中用汞阴极于-2.6V下恒电势电解,首次利用电化学方法还原氮气
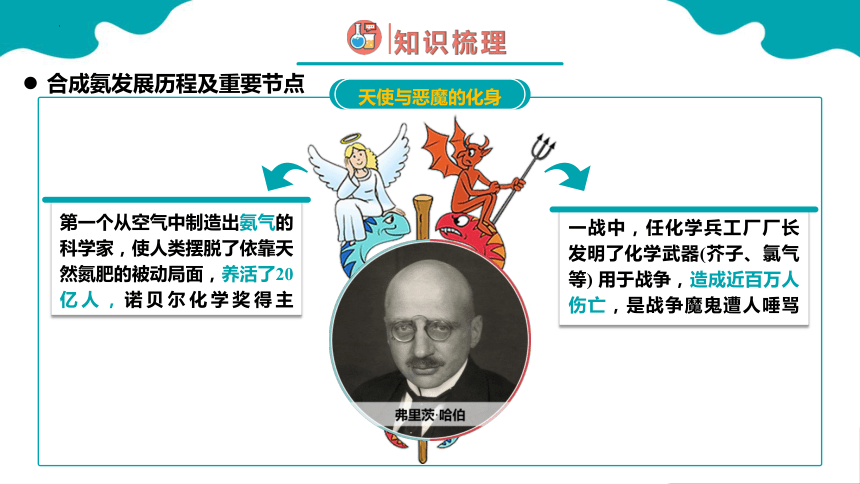
天使与恶魔的化身
第一个从空气中制造出氨气的科学家,使人类摆脱了依靠天然氮肥的被动局面,养活了20亿人,诺贝尔化学奖得主
一战中,任化学兵工厂厂长发明了化学武器(芥子、氯气等) 用于战争,造成近百万人伤亡,是战争魔鬼遭人唾骂
合成氨发展历程及重要节点
1908年7月,哈伯在实验室用氮气和氢气在600 ℃、20 MPa下得到了氨,但是产率极低,只有6%
合成氨开端
哈伯合成氨所用装置
合成氨发展历程及重要节点
1874年,卡尔·博施生于德国科隆。24岁时毕业于莱比锡大学,获有机化学博士学位。1908年~1913年,卡尔·博施改进哈伯首创的高压合成氨催化方法,利用氧化铁型催化剂,使合成氨生产工业化,化学上称为"哈伯——博施法"。1940年,因找到合适的催化剂,使合成氨反应成为工业化,也因此获得诺贝尔化学奖。
合成氨工业之父
合成氨发展历程及重要节点
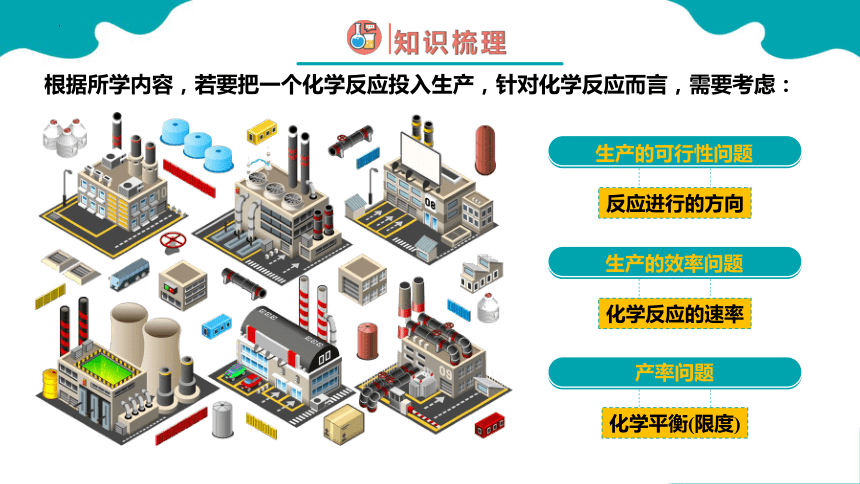
从合成氨发展历程来看,合成氨过程非常不易,请根据所学内容来思考工业合成氨生产条件的选择?
反应进行的方向
化学反应的速率
化学平衡(限度)
根据所学内容,若要把一个化学反应投入生产,针对化学反应而言,需要考虑:
生产的效率问题
产率问题
生产的可行性问题
自然固氮
雷电/大气/高能固氮
N2+O2 2NO
放电或高温
H=+180.5 kJ/mol
S=+247.7 kJ/mol
工业合成氨
人工固氮
N2+3H2 2NH3
高温、高压
催化剂
H=-92.2 kJ/mol
S=-198.2 kJ/mol
合成氨反应条件与原理分析
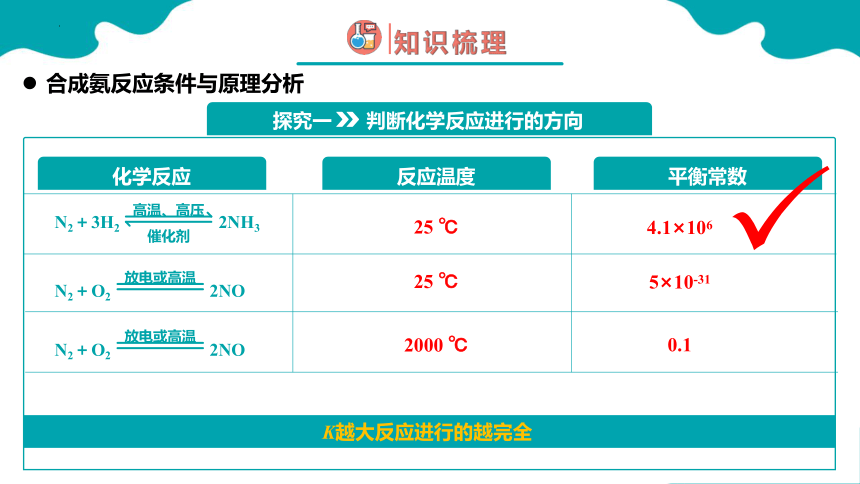
探究一 判断化学反应进行的方向
高温下反应能自发进行
ΔH>0
ΔS>0
低温下反应能自发进行
ΔH<0
ΔS<0
合成氨反应条件与原理分析
探究一 判断化学反应进行的方向
N2+3H2 2NH3
高温、高压
催化剂
N2+O2 2NO
放电或高温
N2+O2 2NO
放电或高温
化学反应
反应温度
平衡常数
25 ℃
25 ℃
2000 ℃
4.1×106
5×10-31
0.1
K越大反应进行的越完全
合成氨反应条件与原理分析
探究一 判断化学反应进行的方向
人工固氮
(合成氨法)
从反应进行方向看
G= H-T S < 0
从反应限度看
K值较大,反应进行的完全
方案可行
从理论出发,科学家在实验室模拟该实验,研究发现:室温下将氮气、氢气混合,即使在实验允许的最大压强下也几乎得不到氨气。
合成氨反应条件与原理分析
反应速率过慢且产氨率较低
如何改进上述所遇的问题呢?
从理论出发,科学家在实验室模拟该实验,研究发现:室温下将氮气、氢气混合,即使在实验允许的最大压强下也几乎得不到氨气。
合成氨反应条件与原理分析
反应速率过慢且产氨率较低
反应速率
化学平衡
外界条件
改变
增大合成氨的反应速率
提高平衡混合物中氨的含量
合成氨反应条件与原理分析
探究二 合成氨条件的选择
对合成氨反应的影响 影响因素 浓度 温度 压强 催化剂
增大合成氨的反应速率
提高平衡混合物中氨的含量
原理分析
ΔH=-92.4 kJ/mol
增大
升高
增大
加入铁触媒
降低
无影响
增大
增大
根据合成氨反应的特点,应如何选择反应条件,以增大合成氨的反应速率、提高平衡混合物中氨的含量?
N2+3H2 2NH3
高温、高压
催化剂
合成氨反应条件与原理分析
探究二 合成氨条件的选择
数据分析
分析表中数据,结合合成氨反应的特点,讨论应如何选择反应条件,以增大合成氨的反应速率、提高平衡混合物中氨的含量。
不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数) 温度/℃ 氨的含量/% 0.1 MPa 10 MPa 20 MPa 30 MPa 60 MPa 100 MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.10 13.8 23.1 31.4
(初始时氮气和氢气的体积比是1∶ 3)
合成氨反应条件与原理分析
探究二 合成氨条件的选择
数据分析
分析表中数据,可知:温度一定,随着压强越大,反应速率增大,氨的含量升高
不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数) 温度/℃ 氨的含量/% 0.1 MPa 10 MPa 20 MPa 30 MPa 60 MPa 100 MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.10 13.8 23.1 31.4
(初始时氮气和氢气的体积比是1∶ 3)
合成氨反应条件与原理分析
探究二 合成氨条件的选择
数据分析
分析表中数据,可知:压强一定,随着温度升高,反应速率增大,氨的含量逐渐降低
不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数) 温度/℃ 氨的含量/% 0.1 MPa 10 MPa 20 MPa 30 MPa 60 MPa 100 MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.10 13.8 23.1 31.4
(初始时氮气和氢气的体积比是1∶ 3)
合成氨反应条件与原理分析
探究二 合成氨条件的选择
数据分析
不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数) 温度/℃ 氨的含量/% 0.1 MPa 10 MPa 20 MPa 30 MPa 60 MPa 100 MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.10 13.8 23.1 31.4
(初始时氮气和氢气的体积比是1∶ 3)
升高温度、增大压强可以使合成氨的反应速率增大
降低温度、增大压强有利于提高平衡混合物中氨的含量
结论
那么,在实际生产中到底选择哪些适宜的条件呢?
压强越大,对材料的强度和设备的制造要求就越高,需要的动力也越大
合成氨反应条件与原理分析
探究二 合成氨条件的选择
图像分析
——压强
大大增加生产投资,并可能降低综合经济效益
原理分析
实验数据
表明
合成氨时压强越大越好
20%~40%
我国的合成氨厂一般采用的压强为10 MPa~30 MPa
合成氨反应条件与原理分析
探究二 合成氨条件的选择
图像分析
——温度
实际生产中一般采用的温度为400~500 ℃
平衡移动原理
温度降低会使化学反应速率减小,达到平衡所需时间变长,这在工业生产中是很不经济
采用低温
提高平衡转化率
10%~30%
合成氨反应条件与原理分析
探究二 合成氨条件的选择
图像分析
——浓度
NH3的体积分数/%
0
1
2
3
4
5
6
10
20
30
40
50
60
氢气和氮气的体积比
初始时氮气和氢气的体积比是1∶ 3
增大
氮气浓度
液化氨气及时从混合物中分离出去
从原料成本来看,氢气的价格要比氮气的价格高,思考:如何提高氨气的产量?
促使化学平衡正向移动,提高氨的产量
NH3的体积分数最大
2NH3
N2 + 3H2
催化剂
高温、高压
归纳总结
温度:400~500℃
合成氨的适宜条件
压强:10 MPa~ 30 MPa
催化剂:铁触媒
浓度:增大氮气浓度、液化氨气
(反应速率较快、催化剂活性较大)
(反应速率较快、平衡正向移动)
(反应速率较快,缩短到达平衡时间)
(反应速率较快、提高氢气的转化率)
合成氨生产的工艺流程
原料气的制备
氮气
液化
空气
氮气
N2
减压蒸发
压强降低,物质的沸点降低
氢气
C+H2O(g) CO+H2
高温
CO+H2O(g) CO2+H2
高温
催化剂
工业上用水蒸气与焦炭在高温下反应,吸收CO2后制得
——生产成本低
——生产成本高
物质、能量交换
合成氨生产的工艺流程
生产流程
制气→净化除杂→压缩→合成→冷却分离→循环压缩
液态NH3
干燥
净化
N2+H2
N2+H2
防止催化剂中毒
增加原料利用率
N2+H2经过循环反应,可全部转化为NH3
压缩机加压
10MPa~30MPa
N2+H2
热交换
N2+H2
铁触媒
400~500℃
N2+H2
NH3+N2+H2
NH3+N2+H2
冷却
合成氨发展历程及重要节点
20世纪
以前
生物固氮
H+,e-
ADP
固氮
酶
NH3
ATP
1898年
1909年
德国A.弗兰克等人发现氮能与碳化钙固定而生成氰氨化钙,进一步与过热水蒸气反应即可获得氨
德国化学家Haber用锇催化剂将氮气与氢气在17.5~20MPa和500~600℃下直接合成
1912年
1985年
1990年
Furuya和Yoshiba 考察了26 种无机催化剂在气体 扩散电极上 NRR 产氨的性能
2007年
Gerhard Ertl对人工固氮技术的原理提供了详细的解释
Haber-Bosch法
铁基
催化剂
N2+H2
NH3
Pickett和Talarmin在N2饱和的四氢呋喃溶液中用汞阴极于-2.6V下恒电势电解,首次利用电化学方法还原氮气
更加节能、降低成本
合成氨发展历程及重要节点
中科院大连化学物理研究所研究团队研制合成了一种新型催化剂,将合成氨的温度、压强分别降到了350 ℃、1 MPa
2016年
化工生产中调控反应的一般思路
可行性
化学平衡
反应速率
设备可行
成本核算
反应条件
确定反应
原理分析
实验摸索
明确目的
热力学第三定律描述的是:热力学系统的熵在温度趋近于绝对零度时趋于定值。而对于完整晶体(所谓“完美晶体”是指没有任何缺陷的规则晶体),这个定值为零。
该定律认为,当系统趋近于绝对温度零度时,系统等温可逆过程的熵变化趋近于零。
热力学第三定律
瓦尔特·能斯特
1.下列有关合成氨工业的说法正确的是( )
A.工业合成氨的反应是熵减小的放热反应,在低温或常温时可自发进行
B.恒容条件下充入稀有气体有利于NH3的合成
C.合成氨厂一般采用的压强为10 MPa~30 Mpa,因为该压强下铁触媒的活性最高
D.N2的量越多,H2的转化率越大,因此,充入的N2越多越有利于NH3的合成
A
2.某工业生产中发生反应:2A(g)+B(g) M(g) ΔH<0。下列有关该工业生产的说法正确的是( )
A.工业上合成M时,一定采用高压条件,因为高压有利于M的生成
B.若物质B廉价易得,工业上一般采用加入过量的B的方式来提高A和B的转化率
C.工业上一般采用较高温度合成M,因温度越高,反应物的转化率越高
D.工业生产中使用催化剂可提高M的日产量
D
3.如图所示为接触法制硫酸的设备和工艺流程,其中关键步骤是SO2的催化氧化:2SO2(g)+O2(g) 2SO3(g) ΔH<0。下列说法正确的是( )
A.反应后气体分子数减少,增大反应容器内压强一定有利于提高生产效益
B.反应放热,为提高SO2转化率,应尽可能在较低温度下反应
C.工业生产要求高效,为加快反应速率,应使用催化剂并尽可能提高体系温度
D.沸腾炉流出的气体必须经过净化,并补充适量空气,再进入接触室
D
4.中国科学家在合成氨[N2(g)+3H2(g) 2NH3(g) ΔH<0]反应机理的研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理,如图所示。下列说法不正确的是( )
A.转化过程中有非极性键的断裂与形成
B.复合催化剂降低了反应的活化能
C.复合催化剂能降低合成氨反应的焓变
D.低温下合成氨,能提高原料的平衡转化率
C
5.常压下羰基化法精炼镍的原理为Ni(s)+4CO(g) Ni(CO)4(g)。230 ℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2 ℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230 ℃制得高纯镍。
下列判断不正确的是( )
A.该反应达到平衡时,v分解[Ni(CO)4]=4v消耗(CO)
B.第一阶段应选择稍高于42.2 ℃的反应温度
C.第二阶段,230 ℃时Ni(CO)4分解率较高
D.其他条件不变,增大c(CO),平衡正向移动,该反应的平衡常数不变
A
第四节
化学反应的调控
化工生产中调控反应的一般思路
合成氨反应条件与原理分析
原料气的制备
合成氨发展历程及重要节点
探究一: 判断化学反应进行的方向
探究二:合成氨条件的选择
探究二:合成氨条件的选择
合成氨生产的工艺流程
生产流程
THANKS
谢谢聆听
第四节 化学反应的调控
第二章
化学反应速率与化学反应平衡
合成氨生产的工艺流程
2
合成氨反应条件与原理分析
1
本节重难点
化工生产中调控反应的一般思路
3
鼓风加快物质燃烧
降温延长食物储存时间
降低温度以此灭火
生活中我们对化学反应的调控示例
化工生产中,对化学反应的调控,应该注意哪些问题呢?
下面我们以工业合成氨生产条件的选择为例,研究化学反应的调控问题。
合成氨发展历程及重要节点
20世纪
以前
生物固氮
H+,e-
ADP
固氮
酶
NH3
ATP
1898年
1909年
德国A.弗兰克等人发现氮能与碳化钙固定而生成氰氨化钙,进一步与过热水蒸气反应即可获得氨
德国化学家Haber用锇催化剂将氮气与氢气在17.5~20MPa和500~600℃下直接合成
1912年
1985年
1990年
Furuya和Yoshiba 考察了26 种无机催化剂在气体 扩散电极上 NRR 产氨的性能
2007年
Gerhard Ertl对人工固氮技术的原理提供了详细的解释
Haber-Bosch法
铁基
催化剂
N2+H2
NH3
Pickett和Talarmin在N2饱和的四氢呋喃溶液中用汞阴极于-2.6V下恒电势电解,首次利用电化学方法还原氮气
天使与恶魔的化身
第一个从空气中制造出氨气的科学家,使人类摆脱了依靠天然氮肥的被动局面,养活了20亿人,诺贝尔化学奖得主
一战中,任化学兵工厂厂长发明了化学武器(芥子、氯气等) 用于战争,造成近百万人伤亡,是战争魔鬼遭人唾骂
合成氨发展历程及重要节点
1908年7月,哈伯在实验室用氮气和氢气在600 ℃、20 MPa下得到了氨,但是产率极低,只有6%
合成氨开端
哈伯合成氨所用装置
合成氨发展历程及重要节点
1874年,卡尔·博施生于德国科隆。24岁时毕业于莱比锡大学,获有机化学博士学位。1908年~1913年,卡尔·博施改进哈伯首创的高压合成氨催化方法,利用氧化铁型催化剂,使合成氨生产工业化,化学上称为"哈伯——博施法"。1940年,因找到合适的催化剂,使合成氨反应成为工业化,也因此获得诺贝尔化学奖。
合成氨工业之父
合成氨发展历程及重要节点
从合成氨发展历程来看,合成氨过程非常不易,请根据所学内容来思考工业合成氨生产条件的选择?
反应进行的方向
化学反应的速率
化学平衡(限度)
根据所学内容,若要把一个化学反应投入生产,针对化学反应而言,需要考虑:
生产的效率问题
产率问题
生产的可行性问题
自然固氮
雷电/大气/高能固氮
N2+O2 2NO
放电或高温
H=+180.5 kJ/mol
S=+247.7 kJ/mol
工业合成氨
人工固氮
N2+3H2 2NH3
高温、高压
催化剂
H=-92.2 kJ/mol
S=-198.2 kJ/mol
合成氨反应条件与原理分析
探究一 判断化学反应进行的方向
高温下反应能自发进行
ΔH>0
ΔS>0
低温下反应能自发进行
ΔH<0
ΔS<0
合成氨反应条件与原理分析
探究一 判断化学反应进行的方向
N2+3H2 2NH3
高温、高压
催化剂
N2+O2 2NO
放电或高温
N2+O2 2NO
放电或高温
化学反应
反应温度
平衡常数
25 ℃
25 ℃
2000 ℃
4.1×106
5×10-31
0.1
K越大反应进行的越完全
合成氨反应条件与原理分析
探究一 判断化学反应进行的方向
人工固氮
(合成氨法)
从反应进行方向看
G= H-T S < 0
从反应限度看
K值较大,反应进行的完全
方案可行
从理论出发,科学家在实验室模拟该实验,研究发现:室温下将氮气、氢气混合,即使在实验允许的最大压强下也几乎得不到氨气。
合成氨反应条件与原理分析
反应速率过慢且产氨率较低
如何改进上述所遇的问题呢?
从理论出发,科学家在实验室模拟该实验,研究发现:室温下将氮气、氢气混合,即使在实验允许的最大压强下也几乎得不到氨气。
合成氨反应条件与原理分析
反应速率过慢且产氨率较低
反应速率
化学平衡
外界条件
改变
增大合成氨的反应速率
提高平衡混合物中氨的含量
合成氨反应条件与原理分析
探究二 合成氨条件的选择
对合成氨反应的影响 影响因素 浓度 温度 压强 催化剂
增大合成氨的反应速率
提高平衡混合物中氨的含量
原理分析
ΔH=-92.4 kJ/mol
增大
升高
增大
加入铁触媒
降低
无影响
增大
增大
根据合成氨反应的特点,应如何选择反应条件,以增大合成氨的反应速率、提高平衡混合物中氨的含量?
N2+3H2 2NH3
高温、高压
催化剂
合成氨反应条件与原理分析
探究二 合成氨条件的选择
数据分析
分析表中数据,结合合成氨反应的特点,讨论应如何选择反应条件,以增大合成氨的反应速率、提高平衡混合物中氨的含量。
不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数) 温度/℃ 氨的含量/% 0.1 MPa 10 MPa 20 MPa 30 MPa 60 MPa 100 MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.10 13.8 23.1 31.4
(初始时氮气和氢气的体积比是1∶ 3)
合成氨反应条件与原理分析
探究二 合成氨条件的选择
数据分析
分析表中数据,可知:温度一定,随着压强越大,反应速率增大,氨的含量升高
不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数) 温度/℃ 氨的含量/% 0.1 MPa 10 MPa 20 MPa 30 MPa 60 MPa 100 MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.10 13.8 23.1 31.4
(初始时氮气和氢气的体积比是1∶ 3)
合成氨反应条件与原理分析
探究二 合成氨条件的选择
数据分析
分析表中数据,可知:压强一定,随着温度升高,反应速率增大,氨的含量逐渐降低
不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数) 温度/℃ 氨的含量/% 0.1 MPa 10 MPa 20 MPa 30 MPa 60 MPa 100 MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.10 13.8 23.1 31.4
(初始时氮气和氢气的体积比是1∶ 3)
合成氨反应条件与原理分析
探究二 合成氨条件的选择
数据分析
不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数) 温度/℃ 氨的含量/% 0.1 MPa 10 MPa 20 MPa 30 MPa 60 MPa 100 MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.10 13.8 23.1 31.4
(初始时氮气和氢气的体积比是1∶ 3)
升高温度、增大压强可以使合成氨的反应速率增大
降低温度、增大压强有利于提高平衡混合物中氨的含量
结论
那么,在实际生产中到底选择哪些适宜的条件呢?
压强越大,对材料的强度和设备的制造要求就越高,需要的动力也越大
合成氨反应条件与原理分析
探究二 合成氨条件的选择
图像分析
——压强
大大增加生产投资,并可能降低综合经济效益
原理分析
实验数据
表明
合成氨时压强越大越好
20%~40%
我国的合成氨厂一般采用的压强为10 MPa~30 MPa
合成氨反应条件与原理分析
探究二 合成氨条件的选择
图像分析
——温度
实际生产中一般采用的温度为400~500 ℃
平衡移动原理
温度降低会使化学反应速率减小,达到平衡所需时间变长,这在工业生产中是很不经济
采用低温
提高平衡转化率
10%~30%
合成氨反应条件与原理分析
探究二 合成氨条件的选择
图像分析
——浓度
NH3的体积分数/%
0
1
2
3
4
5
6
10
20
30
40
50
60
氢气和氮气的体积比
初始时氮气和氢气的体积比是1∶ 3
增大
氮气浓度
液化氨气及时从混合物中分离出去
从原料成本来看,氢气的价格要比氮气的价格高,思考:如何提高氨气的产量?
促使化学平衡正向移动,提高氨的产量
NH3的体积分数最大
2NH3
N2 + 3H2
催化剂
高温、高压
归纳总结
温度:400~500℃
合成氨的适宜条件
压强:10 MPa~ 30 MPa
催化剂:铁触媒
浓度:增大氮气浓度、液化氨气
(反应速率较快、催化剂活性较大)
(反应速率较快、平衡正向移动)
(反应速率较快,缩短到达平衡时间)
(反应速率较快、提高氢气的转化率)
合成氨生产的工艺流程
原料气的制备
氮气
液化
空气
氮气
N2
减压蒸发
压强降低,物质的沸点降低
氢气
C+H2O(g) CO+H2
高温
CO+H2O(g) CO2+H2
高温
催化剂
工业上用水蒸气与焦炭在高温下反应,吸收CO2后制得
——生产成本低
——生产成本高
物质、能量交换
合成氨生产的工艺流程
生产流程
制气→净化除杂→压缩→合成→冷却分离→循环压缩
液态NH3
干燥
净化
N2+H2
N2+H2
防止催化剂中毒
增加原料利用率
N2+H2经过循环反应,可全部转化为NH3
压缩机加压
10MPa~30MPa
N2+H2
热交换
N2+H2
铁触媒
400~500℃
N2+H2
NH3+N2+H2
NH3+N2+H2
冷却
合成氨发展历程及重要节点
20世纪
以前
生物固氮
H+,e-
ADP
固氮
酶
NH3
ATP
1898年
1909年
德国A.弗兰克等人发现氮能与碳化钙固定而生成氰氨化钙,进一步与过热水蒸气反应即可获得氨
德国化学家Haber用锇催化剂将氮气与氢气在17.5~20MPa和500~600℃下直接合成
1912年
1985年
1990年
Furuya和Yoshiba 考察了26 种无机催化剂在气体 扩散电极上 NRR 产氨的性能
2007年
Gerhard Ertl对人工固氮技术的原理提供了详细的解释
Haber-Bosch法
铁基
催化剂
N2+H2
NH3
Pickett和Talarmin在N2饱和的四氢呋喃溶液中用汞阴极于-2.6V下恒电势电解,首次利用电化学方法还原氮气
更加节能、降低成本
合成氨发展历程及重要节点
中科院大连化学物理研究所研究团队研制合成了一种新型催化剂,将合成氨的温度、压强分别降到了350 ℃、1 MPa
2016年
化工生产中调控反应的一般思路
可行性
化学平衡
反应速率
设备可行
成本核算
反应条件
确定反应
原理分析
实验摸索
明确目的
热力学第三定律描述的是:热力学系统的熵在温度趋近于绝对零度时趋于定值。而对于完整晶体(所谓“完美晶体”是指没有任何缺陷的规则晶体),这个定值为零。
该定律认为,当系统趋近于绝对温度零度时,系统等温可逆过程的熵变化趋近于零。
热力学第三定律
瓦尔特·能斯特
1.下列有关合成氨工业的说法正确的是( )
A.工业合成氨的反应是熵减小的放热反应,在低温或常温时可自发进行
B.恒容条件下充入稀有气体有利于NH3的合成
C.合成氨厂一般采用的压强为10 MPa~30 Mpa,因为该压强下铁触媒的活性最高
D.N2的量越多,H2的转化率越大,因此,充入的N2越多越有利于NH3的合成
A
2.某工业生产中发生反应:2A(g)+B(g) M(g) ΔH<0。下列有关该工业生产的说法正确的是( )
A.工业上合成M时,一定采用高压条件,因为高压有利于M的生成
B.若物质B廉价易得,工业上一般采用加入过量的B的方式来提高A和B的转化率
C.工业上一般采用较高温度合成M,因温度越高,反应物的转化率越高
D.工业生产中使用催化剂可提高M的日产量
D
3.如图所示为接触法制硫酸的设备和工艺流程,其中关键步骤是SO2的催化氧化:2SO2(g)+O2(g) 2SO3(g) ΔH<0。下列说法正确的是( )
A.反应后气体分子数减少,增大反应容器内压强一定有利于提高生产效益
B.反应放热,为提高SO2转化率,应尽可能在较低温度下反应
C.工业生产要求高效,为加快反应速率,应使用催化剂并尽可能提高体系温度
D.沸腾炉流出的气体必须经过净化,并补充适量空气,再进入接触室
D
4.中国科学家在合成氨[N2(g)+3H2(g) 2NH3(g) ΔH<0]反应机理的研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理,如图所示。下列说法不正确的是( )
A.转化过程中有非极性键的断裂与形成
B.复合催化剂降低了反应的活化能
C.复合催化剂能降低合成氨反应的焓变
D.低温下合成氨,能提高原料的平衡转化率
C
5.常压下羰基化法精炼镍的原理为Ni(s)+4CO(g) Ni(CO)4(g)。230 ℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2 ℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230 ℃制得高纯镍。
下列判断不正确的是( )
A.该反应达到平衡时,v分解[Ni(CO)4]=4v消耗(CO)
B.第一阶段应选择稍高于42.2 ℃的反应温度
C.第二阶段,230 ℃时Ni(CO)4分解率较高
D.其他条件不变,增大c(CO),平衡正向移动,该反应的平衡常数不变
A
第四节
化学反应的调控
化工生产中调控反应的一般思路
合成氨反应条件与原理分析
原料气的制备
合成氨发展历程及重要节点
探究一: 判断化学反应进行的方向
探究二:合成氨条件的选择
探究二:合成氨条件的选择
合成氨生产的工艺流程
生产流程
THANKS
谢谢聆听
