2.3化学反应的方向 课件(共31张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.3化学反应的方向 课件(共31张ppt)化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 23.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-21 14:45:45 | ||
图片预览









文档简介
(共31张PPT)
第三节 化学反应的方向
第1课时
第二章
化学反应速率与化学反应平衡
化学反应能否自发进行的判据
2
自发过程与自发反应
1
本节重点
本节难点
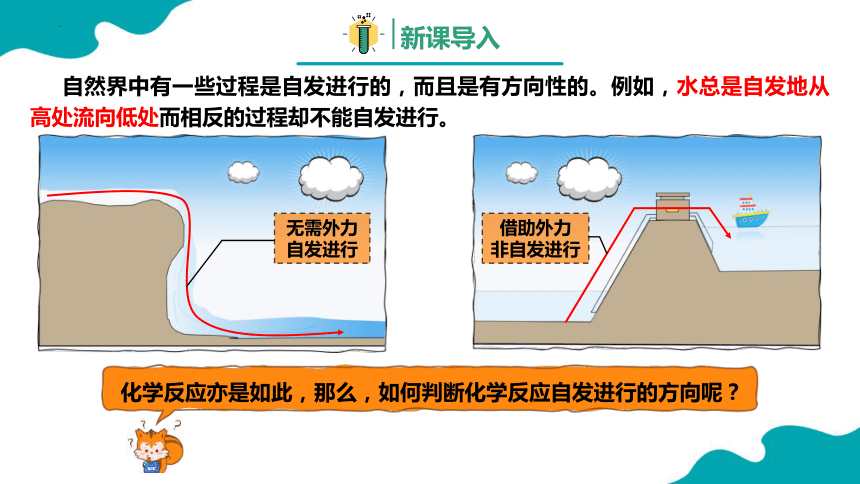
自然界中有一些过程是自发进行的,而且是有方向性的。例如,水总是自发地从高处流向低处而相反的过程却不能自发进行。
化学反应亦是如此,那么,如何判断化学反应自发进行的方向呢?
无需外力
自发进行
借助外力
非自发进行
自发过程与自发反应
在一定的条件下,不需要借助外力作用就能自动进行的过程称为自发过程
自发过程
定义
烟由低处向高处
固体溶解
油墨扩散
能够自发进行的反应在常温下不一定能够发生。自发性只能用于判断过程的方向,不能确定过程是否一定会发生和过程发生的速率
自发过程与自发反应
自发过程
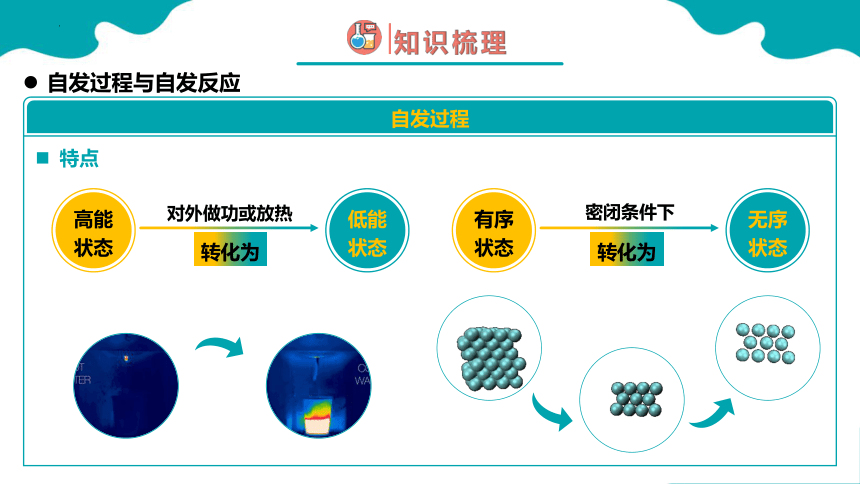
特点
高能
状态
低能
状态
对外做功或放热
转化为
有序
状态
无序
状态
转化为
密闭条件下
自发过程与自发反应
在一定条件下,反应可以自发进行到显著程度,称为自发反应
自发反应
定义
不能自发地进行,必须借助某种外力才能进行的反应称之为非自发反应
钢铁生锈
湿法炼铜
木材燃烧
自发过程与自发反应
自发反应
区分
例如:铁在海水中被腐蚀是自发反应,如果通直流电使铁充当阴极,此时反应就不能进行
自发进行的反应需要一定的反应条件才能进行,实际上不一定能够发生
01
02
非自发反应在一定的条件下也可能发生
(系统外部输入能量可以阻止自发反应)
例如:石灰石的分解反应,在常温下是非自发反应,但在高温时,这一反应就能自发进行
探究一 化学反应方向与焓变的关系
自发过程与自发反应
H2(g) + F2(g) = 2HF(g) H = -546.6 kJ·mol-1
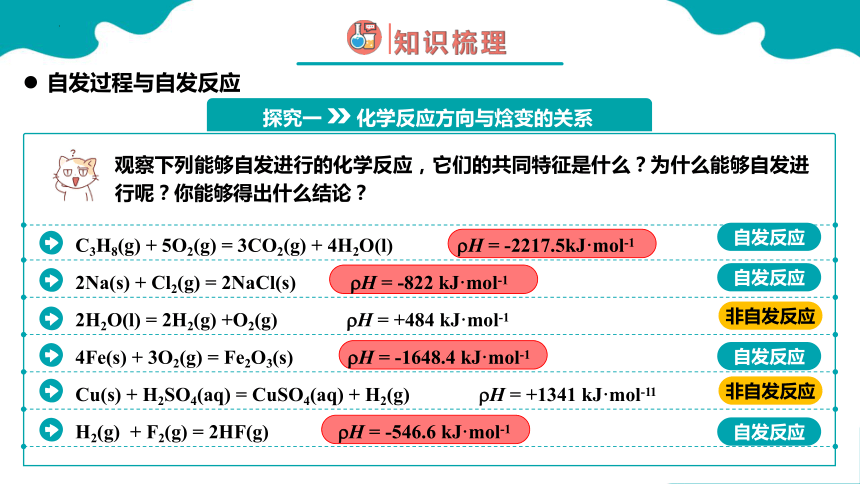
观察下列能够自发进行的化学反应,它们的共同特征是什么?为什么能够自发进行呢?你能够得出什么结论?
C3H8(g) + 5O2(g) = 3CO2(g) + 4H2O(l) H = -2217.5kJ·mol-1
2Na(s) + Cl2(g) = 2NaCl(s) H = -822 kJ·mol-1
2H2O(l) = 2H2(g) +O2(g) H = +484 kJ·mol-1
4Fe(s) + 3O2(g) = Fe2O3(s) H = -1648.4 kJ·mol-1
Cu(s) + H2SO4(aq) = CuSO4(aq) + H2(g) H = +1341 kJ·mol-11
自发反应
自发反应
非自发反应
自发反应
自发反应
非自发反应
放热反应使体系能量降低,能量越低越稳定
放热反应( H < 0),是有利于反应自发进行的条件
探究一 化学反应方向与焓变的关系
自发过程与自发反应
H < 0 即放热反应
共同特点
发生原因
结论
所有自发进行的化学反应都是放热吗?
反应焓变是与反应能否自发进行有关的一个因素,但不是唯一的因素
2NH4Cl(s) + Ca(OH)2(s)=2CaCl2(s) + NH3(g) + 2H2O(l)
室温下能自发进行的吸热反应
较高温度下能自发进行的吸热反应
NH4Br(s) =NH3(g) +HBr(g)
CaCO3(s)=CaO(s)+CO2(g)
NaHCO3(aq) + HCl(aq)=NaCl(aq) + H2O(l) + CO2(g)
什么因素促使了吸热反应的自发进行?
混乱度大
探究二 化学反应方向与熵变的关系
自发过程与自发反应
自发过程进行的方向还与“混乱度”有关
两瓶中气体的颜色相同
不需要外界的任何作用,气体通过分子的扩散自发地混合均匀
有序
状态
无序
状态
自发地转化为
密闭条件下
混乱度小
熵(S)
探究二 化学反应方向与熵变的关系
自发过程与自发反应
熵是度量体系混乱程度的物理量,符号:S
混乱度越大,体系越无序,体系的熵值就越大
熵
特点
积木的混乱程度从大到小,熵减过程
积木的混乱程度从小到大,熵增过程
探究二 化学反应方向与熵变的关系
自发过程与自发反应
影响熵大小的因素
相同条件下,物质不同熵不同
(相同条件下的不同物质,分子结构越复杂,熵越大)
CH3CH2OH(乙醇)的熵就大于CH3OCH3(甲醚)的熵
乙醇
甲醚
因为后者有对称性,比较有序,而前者则无对称性,更加无序、混乱
探究二 化学反应方向与熵变的关系
自发过程与自发反应
影响熵大小的因素
同一物质:S(高温) > S(低温) S(g) > S(l) > S(s)
探究二 化学反应方向与熵变的关系
自发过程与自发反应
影响熵大小的因素
反应中无状态变化:S(化学计量数大) > S(化学计量数小)
2N2O5 (g) = 4NO2(g)+O2(g) H= + 56.7 kJ/mol
N2(g)+O2(g) = 2NO(g) H= + 180.5 kJ/mol
反应中无状态变化、化学计量数变化:S(种类多) > S(种类少)
2
5
2
1
反应产物总熵与反应物总熵之差
探究二 化学反应方向与熵变的关系
自发过程与自发反应
熵变
S =S(反应产物) -S(反应物)
计算公式
判断依据
2N2O5 (g) = 4NO2(g)+O2(g) H= + 56.7 kJ/mol
气体体积增大的反应,熵变通常都是正值,是熵增加的反应
S >0
气体体积减小的反应,熵变通常都是负值,是熵减小的反应
2NO(g) + 2CO(g) = N2(g) + 2CO2(g) H= - 746.5 kJ/mol
S < 0
探究二 化学反应方向与熵变的关系
自发过程与自发反应
熵变与反应方向
熵增加有利于反应的自发进行
熵增加,物质的状态由有序变为无序了,比如从整齐到不整齐很容易,而从混乱变回整齐则并不容易。反应物总能量降低即是一个从高到低的过程,这样的自然过程是易于发生的
某些熵减小的反应在一定条件下也能自发进行
NH3(g)+HCl(g)= NH4Cl(s) S<0
熵变是与反应能否自发进行有关的一个因素,但不是唯一因素
【例1】“熵”表示体系的混乱度,的符号是“S”。下列变化中,ΔS<0的是( )
A.3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)
B.2NO2(g)=N2O4(l)
C.2IBr(l)=I2(s)+Br2(g)
D.(NH4)2CO3(s)=2NH3(g)+CO2(g)+H2O(g)
B
自发反应的方向与焓变和熵变有关,但焓变和熵变又都不能单独作为判断反应自发进行方向的依据。怎么办?
大量事实告诉我们,综合考虑焓变和熵变可以判断反应自发进行的方向。
吉布斯确立了定量描述焓变和熵变在判断反应的自发性过程中的地位。吉布斯自由能的出现,完美地从定量角度揭示了变化过程中焓变与熵变之间的协调与抗衡。
约西亚·威拉德·吉布斯
探究三 判断化学反应方向的复合判据
自发过程与自发反应
体系自由能变化(符号为 G,单位为kJ/mol)综合考虑了焓变和熵变对体系的影响,用来定量评价焓变和熵变在反应过程中作用的关系称之为吉布斯公式:
G= H-T S,G为吉布斯自由能
反应不能自发进行
ΔG > 0
ΔG = 0
反应处于平衡状态
反应能自发进行
ΔG < 0
探究三 判断化学反应方向的复合判据
自发过程与自发反应
体系自由能变化(符号为 G,单位为kJ/mol)综合考虑了焓变和熵变对体系的影响,用来定量评价焓变和熵变在反应过程中作用的关系称之为吉布斯公式:
G= H-T S,G为吉布斯自由能
熵变
( S)
反应
温度
焓变
( H)
影响化学反应进行的方向的因素
请同学们结合公式 G= H-T S,分析讨论反应进行的方向与温度的关系
探究三 判断化学反应方向的复合判据
自发过程与自发反应
ΔH
ΔS
O
ΔH>0
ΔS>0
ΔH<0
ΔS>0
ΔH<0
ΔS<0
ΔH>0
ΔS<0
所有温度下反应都能自发进行
低温下反应能自发进行
高温下反应能自发进行
所有温度下反应都不能自发进行
根据所学内容,思考:假如你是一名化工厂工程师,需要把一个化学反应投入生产,针对化学反应而言,你需要考虑哪些问题?
生产的效率问题
产率问题
反应进行的方向
化学反应的速率
化学平衡(限度)
生产的可行性问题
热力学第二定律说明:热量可以自发地从较热的物体传递到较冷的物体,但不可能自发地从较冷的物体传递到较热的物体(克劳修斯表述);也可表述为:两物体相互摩擦的结果使功转变为热,但却不可能将这摩擦热重新转变为功而不产生其他影响。热力学第一定律未解决能量转换过程中的方向、条件和限度问题,这恰恰是由热力学第二定律所规定的。
热力学第二定律
鲁道夫·克劳修斯
1.下列关于自发过程的叙述中,正确的是( )
A.只有不需要任何条件就能够自动进行的过程才是自发过程
B.需要加热才能进行的过程肯定不是自发过程
C.同一可逆反应的正、逆反应在不同条件下都有自发的可能
D.非自发过程在任何条件下都不可能变为自发过程
C
2.下列过程的方向可用焓判据判断的是( )
A.硝酸铵溶于水
B.2N2O5(g) 4NO2(g)+O2(g) ΔH=+56.7 kJ·mol-1
C.(NH4)2CO3(s) NH4HCO3(s)+NH3(g) ΔH=+74.9 kJ·mol-1
D.2H2(g)+O2(g) 2H2O(l) ΔH=-572 kJ·mol-1
D
3.下列说法正确的是( )
A.自发进行的反应均是ΔH<0的反应
B.ΔS<0的反应一定不能自发进行
C.物质的量增加的反应,其ΔS为正值
D.CaCO3(s)受热分解为CaO(s)和CO2(g),其ΔS>0
D
4.反应CH3OH(l)+NH3(g) CH3NH2(g)+H2O(g)在某温度下才能自发进行,若反应的|ΔH|=17 kJ·mol-1,该温度下|ΔH-TΔS|=17 kJ·mol-1,则下列选项正确的是( )
A.ΔH>0,该温度下ΔH-TΔS<0
B.ΔH<0,该温度下ΔH-TΔS>0
C.ΔH>0,该温度下ΔH-TΔS>0
D.ΔH<0,该温度下ΔH-TΔS<0
A
5.(2022河南郑州中原名校联考)焦炭常用于冶炼工业。已知反应①:2C(s)+O2(g) 2CO(g);反应②:2CO(g)+O2(g) 2CO2(g)。反应①、②的反应趋势与温度关系如图所示,下列说法错误的是( )
A.反应②2CO(g)+O2(g) 2CO2(g)的ΔS<0,ΔH<0
B.983 K是两个反应主次趋势变化的转折点
C.L1对应反应①
D.当温度低于983 K时,过量焦炭的氧化产物以反应②生成CO2为主
D
第三节
化学反应的方向
焓判据
自发过程与自发反应
放热过程( H﹤0)常常是容易自发进行
熵判据
熵增过程( S﹥0)常常是容易自发进行
复合判据
G= H-T S
G﹤0 反应能自发进行
G =0 反应达到平衡状态
G﹥0 反应不能自发进行
第三节 化学反应的方向
第1课时
第二章
化学反应速率与化学反应平衡
化学反应能否自发进行的判据
2
自发过程与自发反应
1
本节重点
本节难点
自然界中有一些过程是自发进行的,而且是有方向性的。例如,水总是自发地从高处流向低处而相反的过程却不能自发进行。
化学反应亦是如此,那么,如何判断化学反应自发进行的方向呢?
无需外力
自发进行
借助外力
非自发进行
自发过程与自发反应
在一定的条件下,不需要借助外力作用就能自动进行的过程称为自发过程
自发过程
定义
烟由低处向高处
固体溶解
油墨扩散
能够自发进行的反应在常温下不一定能够发生。自发性只能用于判断过程的方向,不能确定过程是否一定会发生和过程发生的速率
自发过程与自发反应
自发过程
特点
高能
状态
低能
状态
对外做功或放热
转化为
有序
状态
无序
状态
转化为
密闭条件下
自发过程与自发反应
在一定条件下,反应可以自发进行到显著程度,称为自发反应
自发反应
定义
不能自发地进行,必须借助某种外力才能进行的反应称之为非自发反应
钢铁生锈
湿法炼铜
木材燃烧
自发过程与自发反应
自发反应
区分
例如:铁在海水中被腐蚀是自发反应,如果通直流电使铁充当阴极,此时反应就不能进行
自发进行的反应需要一定的反应条件才能进行,实际上不一定能够发生
01
02
非自发反应在一定的条件下也可能发生
(系统外部输入能量可以阻止自发反应)
例如:石灰石的分解反应,在常温下是非自发反应,但在高温时,这一反应就能自发进行
探究一 化学反应方向与焓变的关系
自发过程与自发反应
H2(g) + F2(g) = 2HF(g) H = -546.6 kJ·mol-1
观察下列能够自发进行的化学反应,它们的共同特征是什么?为什么能够自发进行呢?你能够得出什么结论?
C3H8(g) + 5O2(g) = 3CO2(g) + 4H2O(l) H = -2217.5kJ·mol-1
2Na(s) + Cl2(g) = 2NaCl(s) H = -822 kJ·mol-1
2H2O(l) = 2H2(g) +O2(g) H = +484 kJ·mol-1
4Fe(s) + 3O2(g) = Fe2O3(s) H = -1648.4 kJ·mol-1
Cu(s) + H2SO4(aq) = CuSO4(aq) + H2(g) H = +1341 kJ·mol-11
自发反应
自发反应
非自发反应
自发反应
自发反应
非自发反应
放热反应使体系能量降低,能量越低越稳定
放热反应( H < 0),是有利于反应自发进行的条件
探究一 化学反应方向与焓变的关系
自发过程与自发反应
H < 0 即放热反应
共同特点
发生原因
结论
所有自发进行的化学反应都是放热吗?
反应焓变是与反应能否自发进行有关的一个因素,但不是唯一的因素
2NH4Cl(s) + Ca(OH)2(s)=2CaCl2(s) + NH3(g) + 2H2O(l)
室温下能自发进行的吸热反应
较高温度下能自发进行的吸热反应
NH4Br(s) =NH3(g) +HBr(g)
CaCO3(s)=CaO(s)+CO2(g)
NaHCO3(aq) + HCl(aq)=NaCl(aq) + H2O(l) + CO2(g)
什么因素促使了吸热反应的自发进行?
混乱度大
探究二 化学反应方向与熵变的关系
自发过程与自发反应
自发过程进行的方向还与“混乱度”有关
两瓶中气体的颜色相同
不需要外界的任何作用,气体通过分子的扩散自发地混合均匀
有序
状态
无序
状态
自发地转化为
密闭条件下
混乱度小
熵(S)
探究二 化学反应方向与熵变的关系
自发过程与自发反应
熵是度量体系混乱程度的物理量,符号:S
混乱度越大,体系越无序,体系的熵值就越大
熵
特点
积木的混乱程度从大到小,熵减过程
积木的混乱程度从小到大,熵增过程
探究二 化学反应方向与熵变的关系
自发过程与自发反应
影响熵大小的因素
相同条件下,物质不同熵不同
(相同条件下的不同物质,分子结构越复杂,熵越大)
CH3CH2OH(乙醇)的熵就大于CH3OCH3(甲醚)的熵
乙醇
甲醚
因为后者有对称性,比较有序,而前者则无对称性,更加无序、混乱
探究二 化学反应方向与熵变的关系
自发过程与自发反应
影响熵大小的因素
同一物质:S(高温) > S(低温) S(g) > S(l) > S(s)
探究二 化学反应方向与熵变的关系
自发过程与自发反应
影响熵大小的因素
反应中无状态变化:S(化学计量数大) > S(化学计量数小)
2N2O5 (g) = 4NO2(g)+O2(g) H= + 56.7 kJ/mol
N2(g)+O2(g) = 2NO(g) H= + 180.5 kJ/mol
反应中无状态变化、化学计量数变化:S(种类多) > S(种类少)
2
5
2
1
反应产物总熵与反应物总熵之差
探究二 化学反应方向与熵变的关系
自发过程与自发反应
熵变
S =S(反应产物) -S(反应物)
计算公式
判断依据
2N2O5 (g) = 4NO2(g)+O2(g) H= + 56.7 kJ/mol
气体体积增大的反应,熵变通常都是正值,是熵增加的反应
S >0
气体体积减小的反应,熵变通常都是负值,是熵减小的反应
2NO(g) + 2CO(g) = N2(g) + 2CO2(g) H= - 746.5 kJ/mol
S < 0
探究二 化学反应方向与熵变的关系
自发过程与自发反应
熵变与反应方向
熵增加有利于反应的自发进行
熵增加,物质的状态由有序变为无序了,比如从整齐到不整齐很容易,而从混乱变回整齐则并不容易。反应物总能量降低即是一个从高到低的过程,这样的自然过程是易于发生的
某些熵减小的反应在一定条件下也能自发进行
NH3(g)+HCl(g)= NH4Cl(s) S<0
熵变是与反应能否自发进行有关的一个因素,但不是唯一因素
【例1】“熵”表示体系的混乱度,的符号是“S”。下列变化中,ΔS<0的是( )
A.3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)
B.2NO2(g)=N2O4(l)
C.2IBr(l)=I2(s)+Br2(g)
D.(NH4)2CO3(s)=2NH3(g)+CO2(g)+H2O(g)
B
自发反应的方向与焓变和熵变有关,但焓变和熵变又都不能单独作为判断反应自发进行方向的依据。怎么办?
大量事实告诉我们,综合考虑焓变和熵变可以判断反应自发进行的方向。
吉布斯确立了定量描述焓变和熵变在判断反应的自发性过程中的地位。吉布斯自由能的出现,完美地从定量角度揭示了变化过程中焓变与熵变之间的协调与抗衡。
约西亚·威拉德·吉布斯
探究三 判断化学反应方向的复合判据
自发过程与自发反应
体系自由能变化(符号为 G,单位为kJ/mol)综合考虑了焓变和熵变对体系的影响,用来定量评价焓变和熵变在反应过程中作用的关系称之为吉布斯公式:
G= H-T S,G为吉布斯自由能
反应不能自发进行
ΔG > 0
ΔG = 0
反应处于平衡状态
反应能自发进行
ΔG < 0
探究三 判断化学反应方向的复合判据
自发过程与自发反应
体系自由能变化(符号为 G,单位为kJ/mol)综合考虑了焓变和熵变对体系的影响,用来定量评价焓变和熵变在反应过程中作用的关系称之为吉布斯公式:
G= H-T S,G为吉布斯自由能
熵变
( S)
反应
温度
焓变
( H)
影响化学反应进行的方向的因素
请同学们结合公式 G= H-T S,分析讨论反应进行的方向与温度的关系
探究三 判断化学反应方向的复合判据
自发过程与自发反应
ΔH
ΔS
O
ΔH>0
ΔS>0
ΔH<0
ΔS>0
ΔH<0
ΔS<0
ΔH>0
ΔS<0
所有温度下反应都能自发进行
低温下反应能自发进行
高温下反应能自发进行
所有温度下反应都不能自发进行
根据所学内容,思考:假如你是一名化工厂工程师,需要把一个化学反应投入生产,针对化学反应而言,你需要考虑哪些问题?
生产的效率问题
产率问题
反应进行的方向
化学反应的速率
化学平衡(限度)
生产的可行性问题
热力学第二定律说明:热量可以自发地从较热的物体传递到较冷的物体,但不可能自发地从较冷的物体传递到较热的物体(克劳修斯表述);也可表述为:两物体相互摩擦的结果使功转变为热,但却不可能将这摩擦热重新转变为功而不产生其他影响。热力学第一定律未解决能量转换过程中的方向、条件和限度问题,这恰恰是由热力学第二定律所规定的。
热力学第二定律
鲁道夫·克劳修斯
1.下列关于自发过程的叙述中,正确的是( )
A.只有不需要任何条件就能够自动进行的过程才是自发过程
B.需要加热才能进行的过程肯定不是自发过程
C.同一可逆反应的正、逆反应在不同条件下都有自发的可能
D.非自发过程在任何条件下都不可能变为自发过程
C
2.下列过程的方向可用焓判据判断的是( )
A.硝酸铵溶于水
B.2N2O5(g) 4NO2(g)+O2(g) ΔH=+56.7 kJ·mol-1
C.(NH4)2CO3(s) NH4HCO3(s)+NH3(g) ΔH=+74.9 kJ·mol-1
D.2H2(g)+O2(g) 2H2O(l) ΔH=-572 kJ·mol-1
D
3.下列说法正确的是( )
A.自发进行的反应均是ΔH<0的反应
B.ΔS<0的反应一定不能自发进行
C.物质的量增加的反应,其ΔS为正值
D.CaCO3(s)受热分解为CaO(s)和CO2(g),其ΔS>0
D
4.反应CH3OH(l)+NH3(g) CH3NH2(g)+H2O(g)在某温度下才能自发进行,若反应的|ΔH|=17 kJ·mol-1,该温度下|ΔH-TΔS|=17 kJ·mol-1,则下列选项正确的是( )
A.ΔH>0,该温度下ΔH-TΔS<0
B.ΔH<0,该温度下ΔH-TΔS>0
C.ΔH>0,该温度下ΔH-TΔS>0
D.ΔH<0,该温度下ΔH-TΔS<0
A
5.(2022河南郑州中原名校联考)焦炭常用于冶炼工业。已知反应①:2C(s)+O2(g) 2CO(g);反应②:2CO(g)+O2(g) 2CO2(g)。反应①、②的反应趋势与温度关系如图所示,下列说法错误的是( )
A.反应②2CO(g)+O2(g) 2CO2(g)的ΔS<0,ΔH<0
B.983 K是两个反应主次趋势变化的转折点
C.L1对应反应①
D.当温度低于983 K时,过量焦炭的氧化产物以反应②生成CO2为主
D
第三节
化学反应的方向
焓判据
自发过程与自发反应
放热过程( H﹤0)常常是容易自发进行
熵判据
熵增过程( S﹥0)常常是容易自发进行
复合判据
G= H-T S
G﹤0 反应能自发进行
G =0 反应达到平衡状态
G﹥0 反应不能自发进行
