7.3.1乙醇 课件(共31张ppt)化学人教版(2019)必修第二册
文档属性
| 名称 | 7.3.1乙醇 课件(共31张ppt)化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-21 00:00:00 | ||
图片预览






文档简介
(共31张PPT)
第七章 第3节 课时1
乙醇
乙醇
教学过程
设计
教学背景
分析
教学重点、
难点分析
教学目标的确定
说课
内容
1.本节课从学生的生活经验出发,以学生初中所学的有机物常识为基础,在介绍了有机物甲烷、乙烯等烃的基础之上引入的第一个烃的衍生物;
2.通过本节课的探究学习,既巩固前面所学的知识,也为后面学习乙酸等学习做了铺垫,因此,它既是本章的重点,也是高中有机化学的重点。
3.乙醇这节课的学习,进一步巩固深化对结构决定性质的认识。
教材的地位
和作用
乙醇
已有认知基础
Title
Add your text
学生情况分析
现有认知障碍
A
教学背景分析
1.学生对于烃的衍生物认识较为肤浅,对于官能团决定物质的特殊性质还不了解。
2.学生还没有建立起“结构—性质—用途”这样一个有机物的学习模型。
1.学生根据生活经验以及对初中化学的学习,只了解了一些关于乙醇的用途,没有从分子结构的角度进行系统地学习。
2.学生已经学完烃的基本知识,对有机物的学习有了一定的认识,所以对于进一步学习乙醇的组成和性质,有着较强的求知欲。
A
教学背景分析
教学准备
为顺利完成教学任务,实现教学目标,帮助学生突破教学难点,我制作了多媒体课件,准备了实验、球棍模型。
Company Logo
知识与技能
过程与方法
情感态度
与价值观
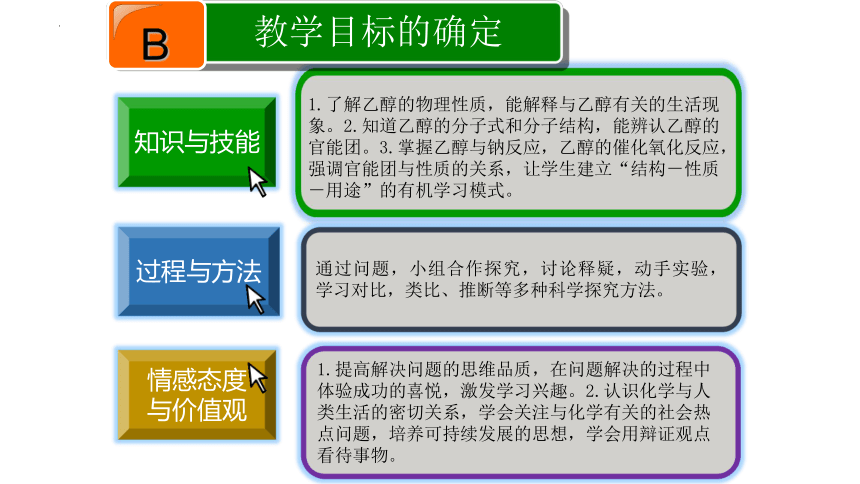
1.了解乙醇的物理性质,能解释与乙醇有关的生活现象。2.知道乙醇的分子式和分子结构,能辨认乙醇的官能团。3.掌握乙醇与钠反应,乙醇的催化氧化反应,强调官能团与性质的关系,让学生建立“结构-性质-用途”的有机学习模式。
通过问题,小组合作探究,讨论释疑,动手实验,学习对比,类比、推断等多种科学探究方法。
1.提高解决问题的思维品质,在问题解决的过程中体验成功的喜悦,激发学习兴趣。2.认识化学与人类生活的密切关系,学会关注与化学有关的社会热点问题,培养可持续发展的思想,学会用辩证观点看待事物。
B
教学目标的确定
教学重点
教学难点
乙醇结构的推断
乙醇与钠反应、乙醇的催化氧化反应
建立乙醇的立体结构模型,从结构角度初步认识乙醇的催化氧化的原理和实质。
C
教学重点和难点分析
教学方式和手段
根据教学内容、教学目标和
学生的认知水平,主要采取教师
以问题呈现方式进行引导,学生
通过动脑、动手进行实践、探究。
D
教学过程的设计与实施
创设情境 引入新课
1
质疑探究 加深理解
2
梳理总结 内化提高
4
课堂练习 巩固新知
3
布置作业 延拓课堂
5
1
创设情境 引入新课
1
创设情境 引入新课
通过对生活图片的放映,引入本节课的学习主题——生活中常见的有机物乙醇,进而让学生通过已有的生活经验,自己归纳乙醇的物理性质。
2
质疑探究 加深理解
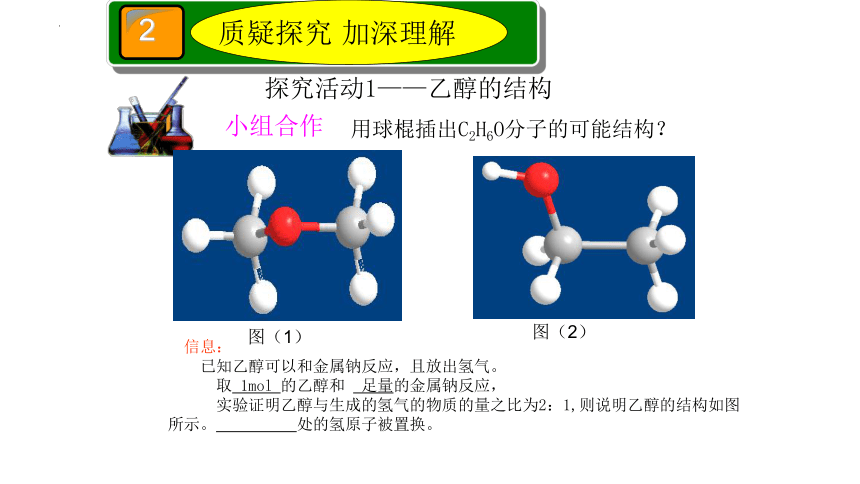
信息:
已知乙醇可以和金属钠反应,且放出氢气。
取 1mol 的乙醇和 足量的金属钠反应,
实验证明乙醇与生成的氢气的物质的量之比为2:1,则说明乙醇的结构如图 所示。 处的氢原子被置换。
图(1)
图(2)
用球棍插出C2H6O分子的可能结构?
探究一
探究活动1——乙醇的结构
小组合作
C—C—O—H
H
H
H
H
H
结构式:
CH3CH2OH
或 C2H5OH
羟基-OH
分子式:
乙醇的分子结构
C2H6O
结构简式:
2
质疑探究 加深理解
探究一
设计意图
①组装C2H6O的同分异构体的球棍模型:
培养学生的动手能力,以及将微观分子模型化。
学生明辨有机分子式和化学物质的对应关系。
②定量数据对探究乙醇的结构式的研究
学生明辨结构决定性质,性质反映结构。
2
质疑探究 加深理解
探究一
在盛有少量无水乙醇的试管中加入一小块金属钠,迅速塞上配有医用注射针头的单孔塞。
(1)收集气体验纯并点燃。
(2)把干燥的小烧杯罩在火焰上,观察现象。
(3)迅速倒转小烧杯,向其中加入少量澄清石灰水,观察现象。
温馨提示
注意操作安全
2
质疑探究 加深理解
探究二
探究活动2——乙醇与钠的反应
小组合作
1.钠浮在水面上,而沉在乙醇中
对比钠与水反应实验现象,思考并回答下列问题。
3.煤油(烃类)可以保存钠,而乙醇却与钠反应说明乙醇的性质是由它的 决定的
2.钠与乙醇的反应速率比钠与水的反应速率慢,
说明羟基中的H原子的活泼性:
2
质疑探究 加深理解
探究二
4.写出乙醇与水反应的化学方程式:
设计意图
乙醇和水都可以跟钠反应
通过实验让学生明辨官能团的性质,结构相似性质相似,以及基团间相互影响的关系
培养学生的动手操作能力,观察现象的能力,知识的对比、迁移能力。
培养学生透过现象看本质的思维能力
,
2
质疑探究 加深理解
探究二
,
2
质疑探究 加深理解
探究三
探究活动3——乙醇的氧化反应
1.可燃性
乙醇汽油由90%的普通汽油与10%的燃料乙醇调和而成。
请你预测乙醇汽油的应用前景,与石油相比,它具有哪些优越性呢?并写出乙醇燃烧的化学方程式
回归生活一
,
教师将铜丝放在酒精灯的外焰上灼烧,慢慢的移向内焰,上下重复做几次,那么同学们可以直接观察铜丝变化的现象,让学生们去思考,到底内焰和外焰的区别在哪里?请同学们进一步自己来探究实验。
2
质疑探究 加深理解
探究四
探究活动3——乙醇的氧化反应
2.乙醇的催化氧化
(1)点燃酒精灯,拿一根洁净的铜丝在酒精灯的外焰上灼烧至红热。
(2)移开火焰迅速将铜丝放入盛有3mL乙醇的试管中。
(3)重复操作步骤(1)(2) 2-3次,观察铜丝变化并闻液体的气味。
(4)闻气味(方法)注意与乙醇对比
注意操作安全
2
质疑探究 加深理解
温馨提示
探究活动3
探究四
小组合作
1.分析整个反应过程中铜丝的颜色变化?
2.铜丝在整个反应中起什么作用?
3.完成乙醇的催化氧化的方程式并找出乙醇的断键位置:
2
质疑探究 加深理解
根据实验,思考并回答下列问题
探究四
信息:乙醛无色,具有刺激性气味的液体,结构式
C—C—H
H
H
H
O
2
质疑探究 加深理解
探究四
回归生活二
酒精在人体中,不需经消化作用即可直接被肠胃吸收,并很快扩散进入血液并分布至全身各器官,主要是在肝脏和大脑中。酒精在体内的代谢作用,绝大部分发生在肝脏中,在肝脏中一种酶的作用下,酒精先转化成乙醛(对人体有毒),很快又在另一种酶的作用下,变成乙酸最终分解成二氧化碳和水。
乙醛的毒性是乙醇的十倍以上,所以常喝酒会伤肝
2
质疑探究 加深理解
探究五
回归生活三
Cr2(SO4)3
K2Cr2O7
酒精的快速检测
实验:乙醇被酸性KMnO4、K2Cr2O7 (重铬酸钾)氧化
设计意图
乙醇的氧化反应
渗透条件不同,产物不同的学科思想
学会用辩证的思想分析事物
化学反应的实质是旧键的断裂和新键的形成过程
让学生意识到化学来源于生活,服务于生活和人们的生活息息相关。
,
2
质疑探究 加深理解
探究三——五
3
课堂练习 巩固新知
1.下列有关乙醇的物理性质应用中不正确的是( )
A.由于乙醇的密度比较小,所以乙醇中的水可以通过分液的方法除去。
B.由于乙醇可以溶解很多的有机物和无机物,所以可以用乙醇提取中草药的有效成分。
C.由于乙醇可以以任意比溶解在水中,所以酒厂可以勾兑各种浓度的酒。
D.由于乙醇容易挥发,所以才有俗语“酒好不怕巷子深”的说法。
2.将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻,铜片质量不变的( ) A.硝酸 B.无水乙醇 C.石灰水 D.盐酸
3
课堂练习 巩固新知
3 .乙醇与钠反应时断( )键,催化氧化反应时断( )键
A: ① B: ②
C: ③ D: ④
C—C—O—H
H
H
H
H
H
①
②
④
③
设计意图
加深学生对乙醇结构、性质的理解
3
课堂练习 巩固新知
4
梳理总结 内化提高
一、乙醇
1.物理性质:
2.乙醇的分子结构
结构简式:CH3CH2OH或C2H5OH 官能团:羟基
3.化学性质:
(1)与Na反应
2CH3CH2OH+2Na → 2CH3CH2ONa+H2↑
(2)氧化反应
①可燃性:C2H5OH+3O2 → 2CO2+3H2O
②催化氧化: 2C2H5OH+O2 → 2CH3CHO+2H2O
③被强氧化剂氧化:酸性KMnO4、K2Cr2O7
点燃
Cu
加热
5
布置作业 延拓课堂
课后作业:
习题1.2.3题;
酒的度数是如何确定的?
3. 制作一张海报,宣传酗酒或酒后驾车的危害
教学设计的说明
根据学生已有的生活经验和对初中化学的学习,在教学设计时,我再次放映跟乙醇性质有关的图片,让学生自己总结乙醇的物理性质;以问题或实验或生活实践呈现的方式,让学生对乙醇的结构、性质产生一种求知的欲望,通过学生动脑分析、动手实践,让学生自己亲身感悟获得新知的过程,在头脑中构建新的知识网络,学会合作学习,从而发挥他们的潜能,形成基本的科学素养,使学生对所学知识和能力逐步提高,思维不断完善。
谢谢各位!
第七章 第3节 课时1
乙醇
乙醇
教学过程
设计
教学背景
分析
教学重点、
难点分析
教学目标的确定
说课
内容
1.本节课从学生的生活经验出发,以学生初中所学的有机物常识为基础,在介绍了有机物甲烷、乙烯等烃的基础之上引入的第一个烃的衍生物;
2.通过本节课的探究学习,既巩固前面所学的知识,也为后面学习乙酸等学习做了铺垫,因此,它既是本章的重点,也是高中有机化学的重点。
3.乙醇这节课的学习,进一步巩固深化对结构决定性质的认识。
教材的地位
和作用
乙醇
已有认知基础
Title
Add your text
学生情况分析
现有认知障碍
A
教学背景分析
1.学生对于烃的衍生物认识较为肤浅,对于官能团决定物质的特殊性质还不了解。
2.学生还没有建立起“结构—性质—用途”这样一个有机物的学习模型。
1.学生根据生活经验以及对初中化学的学习,只了解了一些关于乙醇的用途,没有从分子结构的角度进行系统地学习。
2.学生已经学完烃的基本知识,对有机物的学习有了一定的认识,所以对于进一步学习乙醇的组成和性质,有着较强的求知欲。
A
教学背景分析
教学准备
为顺利完成教学任务,实现教学目标,帮助学生突破教学难点,我制作了多媒体课件,准备了实验、球棍模型。
Company Logo
知识与技能
过程与方法
情感态度
与价值观
1.了解乙醇的物理性质,能解释与乙醇有关的生活现象。2.知道乙醇的分子式和分子结构,能辨认乙醇的官能团。3.掌握乙醇与钠反应,乙醇的催化氧化反应,强调官能团与性质的关系,让学生建立“结构-性质-用途”的有机学习模式。
通过问题,小组合作探究,讨论释疑,动手实验,学习对比,类比、推断等多种科学探究方法。
1.提高解决问题的思维品质,在问题解决的过程中体验成功的喜悦,激发学习兴趣。2.认识化学与人类生活的密切关系,学会关注与化学有关的社会热点问题,培养可持续发展的思想,学会用辩证观点看待事物。
B
教学目标的确定
教学重点
教学难点
乙醇结构的推断
乙醇与钠反应、乙醇的催化氧化反应
建立乙醇的立体结构模型,从结构角度初步认识乙醇的催化氧化的原理和实质。
C
教学重点和难点分析
教学方式和手段
根据教学内容、教学目标和
学生的认知水平,主要采取教师
以问题呈现方式进行引导,学生
通过动脑、动手进行实践、探究。
D
教学过程的设计与实施
创设情境 引入新课
1
质疑探究 加深理解
2
梳理总结 内化提高
4
课堂练习 巩固新知
3
布置作业 延拓课堂
5
1
创设情境 引入新课
1
创设情境 引入新课
通过对生活图片的放映,引入本节课的学习主题——生活中常见的有机物乙醇,进而让学生通过已有的生活经验,自己归纳乙醇的物理性质。
2
质疑探究 加深理解
信息:
已知乙醇可以和金属钠反应,且放出氢气。
取 1mol 的乙醇和 足量的金属钠反应,
实验证明乙醇与生成的氢气的物质的量之比为2:1,则说明乙醇的结构如图 所示。 处的氢原子被置换。
图(1)
图(2)
用球棍插出C2H6O分子的可能结构?
探究一
探究活动1——乙醇的结构
小组合作
C—C—O—H
H
H
H
H
H
结构式:
CH3CH2OH
或 C2H5OH
羟基-OH
分子式:
乙醇的分子结构
C2H6O
结构简式:
2
质疑探究 加深理解
探究一
设计意图
①组装C2H6O的同分异构体的球棍模型:
培养学生的动手能力,以及将微观分子模型化。
学生明辨有机分子式和化学物质的对应关系。
②定量数据对探究乙醇的结构式的研究
学生明辨结构决定性质,性质反映结构。
2
质疑探究 加深理解
探究一
在盛有少量无水乙醇的试管中加入一小块金属钠,迅速塞上配有医用注射针头的单孔塞。
(1)收集气体验纯并点燃。
(2)把干燥的小烧杯罩在火焰上,观察现象。
(3)迅速倒转小烧杯,向其中加入少量澄清石灰水,观察现象。
温馨提示
注意操作安全
2
质疑探究 加深理解
探究二
探究活动2——乙醇与钠的反应
小组合作
1.钠浮在水面上,而沉在乙醇中
对比钠与水反应实验现象,思考并回答下列问题。
3.煤油(烃类)可以保存钠,而乙醇却与钠反应说明乙醇的性质是由它的 决定的
2.钠与乙醇的反应速率比钠与水的反应速率慢,
说明羟基中的H原子的活泼性:
2
质疑探究 加深理解
探究二
4.写出乙醇与水反应的化学方程式:
设计意图
乙醇和水都可以跟钠反应
通过实验让学生明辨官能团的性质,结构相似性质相似,以及基团间相互影响的关系
培养学生的动手操作能力,观察现象的能力,知识的对比、迁移能力。
培养学生透过现象看本质的思维能力
,
2
质疑探究 加深理解
探究二
,
2
质疑探究 加深理解
探究三
探究活动3——乙醇的氧化反应
1.可燃性
乙醇汽油由90%的普通汽油与10%的燃料乙醇调和而成。
请你预测乙醇汽油的应用前景,与石油相比,它具有哪些优越性呢?并写出乙醇燃烧的化学方程式
回归生活一
,
教师将铜丝放在酒精灯的外焰上灼烧,慢慢的移向内焰,上下重复做几次,那么同学们可以直接观察铜丝变化的现象,让学生们去思考,到底内焰和外焰的区别在哪里?请同学们进一步自己来探究实验。
2
质疑探究 加深理解
探究四
探究活动3——乙醇的氧化反应
2.乙醇的催化氧化
(1)点燃酒精灯,拿一根洁净的铜丝在酒精灯的外焰上灼烧至红热。
(2)移开火焰迅速将铜丝放入盛有3mL乙醇的试管中。
(3)重复操作步骤(1)(2) 2-3次,观察铜丝变化并闻液体的气味。
(4)闻气味(方法)注意与乙醇对比
注意操作安全
2
质疑探究 加深理解
温馨提示
探究活动3
探究四
小组合作
1.分析整个反应过程中铜丝的颜色变化?
2.铜丝在整个反应中起什么作用?
3.完成乙醇的催化氧化的方程式并找出乙醇的断键位置:
2
质疑探究 加深理解
根据实验,思考并回答下列问题
探究四
信息:乙醛无色,具有刺激性气味的液体,结构式
C—C—H
H
H
H
O
2
质疑探究 加深理解
探究四
回归生活二
酒精在人体中,不需经消化作用即可直接被肠胃吸收,并很快扩散进入血液并分布至全身各器官,主要是在肝脏和大脑中。酒精在体内的代谢作用,绝大部分发生在肝脏中,在肝脏中一种酶的作用下,酒精先转化成乙醛(对人体有毒),很快又在另一种酶的作用下,变成乙酸最终分解成二氧化碳和水。
乙醛的毒性是乙醇的十倍以上,所以常喝酒会伤肝
2
质疑探究 加深理解
探究五
回归生活三
Cr2(SO4)3
K2Cr2O7
酒精的快速检测
实验:乙醇被酸性KMnO4、K2Cr2O7 (重铬酸钾)氧化
设计意图
乙醇的氧化反应
渗透条件不同,产物不同的学科思想
学会用辩证的思想分析事物
化学反应的实质是旧键的断裂和新键的形成过程
让学生意识到化学来源于生活,服务于生活和人们的生活息息相关。
,
2
质疑探究 加深理解
探究三——五
3
课堂练习 巩固新知
1.下列有关乙醇的物理性质应用中不正确的是( )
A.由于乙醇的密度比较小,所以乙醇中的水可以通过分液的方法除去。
B.由于乙醇可以溶解很多的有机物和无机物,所以可以用乙醇提取中草药的有效成分。
C.由于乙醇可以以任意比溶解在水中,所以酒厂可以勾兑各种浓度的酒。
D.由于乙醇容易挥发,所以才有俗语“酒好不怕巷子深”的说法。
2.将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻,铜片质量不变的( ) A.硝酸 B.无水乙醇 C.石灰水 D.盐酸
3
课堂练习 巩固新知
3 .乙醇与钠反应时断( )键,催化氧化反应时断( )键
A: ① B: ②
C: ③ D: ④
C—C—O—H
H
H
H
H
H
①
②
④
③
设计意图
加深学生对乙醇结构、性质的理解
3
课堂练习 巩固新知
4
梳理总结 内化提高
一、乙醇
1.物理性质:
2.乙醇的分子结构
结构简式:CH3CH2OH或C2H5OH 官能团:羟基
3.化学性质:
(1)与Na反应
2CH3CH2OH+2Na → 2CH3CH2ONa+H2↑
(2)氧化反应
①可燃性:C2H5OH+3O2 → 2CO2+3H2O
②催化氧化: 2C2H5OH+O2 → 2CH3CHO+2H2O
③被强氧化剂氧化:酸性KMnO4、K2Cr2O7
点燃
Cu
加热
5
布置作业 延拓课堂
课后作业:
习题1.2.3题;
酒的度数是如何确定的?
3. 制作一张海报,宣传酗酒或酒后驾车的危害
教学设计的说明
根据学生已有的生活经验和对初中化学的学习,在教学设计时,我再次放映跟乙醇性质有关的图片,让学生自己总结乙醇的物理性质;以问题或实验或生活实践呈现的方式,让学生对乙醇的结构、性质产生一种求知的欲望,通过学生动脑分析、动手实践,让学生自己亲身感悟获得新知的过程,在头脑中构建新的知识网络,学会合作学习,从而发挥他们的潜能,形成基本的科学素养,使学生对所学知识和能力逐步提高,思维不断完善。
谢谢各位!
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
