初中化学科粤版九上3.2 制取氧气(第二课时)课件(共14张PPT)
文档属性
| 名称 | 初中化学科粤版九上3.2 制取氧气(第二课时)课件(共14张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 150.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-20 17:28:54 | ||
图片预览






文档简介
(共14张PPT)
第二节 制取氧气
(第二课时)
1.过氧化氢在什么条件下可以产生氧气?
2.如何检验有氧气生成?
3.什么叫催化剂?
一、复习回顾催化剂
二、实验室制取氧气
1.反应原理
高锰酸钾
锰酸钾
二氧化锰
氧气
+
+
(KMnO4)
(K2MnO4)
(H2O2)
(O2)
(2)
加热
过氧化氢
(H2O2)
(H2O)
(O2)
水
氧气
(1)
+
二氧化锰
二氧化锰
+
加热
(3)
氯酸钾
氯化钾
氧气
(KClO3)
(KCl)
(O2)
1)试管口应略向下倾斜;
2)导管不能伸入试管内太长;
3)铁夹要夹持在距试管口1/3处;
4)药品要平铺在试管底部。
2.装置要点
1)检——检查装置的气密性;
2)装——把药品装入试管,使之平铺在试管底部;
3)固——把试管固定在铁架台上;
4)点——点燃酒精灯开始加热:
5)集——收集氧气;
6)移——将导管移出水面;
7)熄——熄灭酒精灯。
3.操作步骤
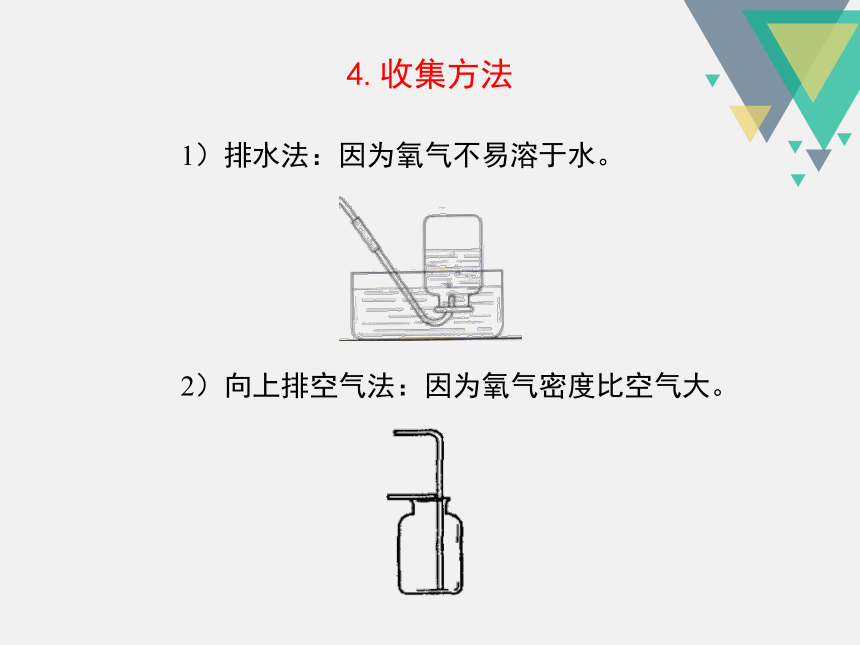
4.收集方法
2)向上排空气法:因为氧气密度比空气大。
1)排水法:因为氧气不易溶于水。
用一根带火星的木条放在集气瓶口,若木条复燃,证明氧气已满。
5.验满方法
1)实验结束后,应先将导管移出水面,再熄灭酒
精灯。以防水倒流,造成试管炸裂。
2)如果所用药品是高锰酸钾,通常要在试管口塞一团棉花,防止高锰酸钾粉末随氧气溅入导管。
3)制备出的氧气应盖好玻璃片,瓶口向上正立在桌面上。
6.操作要点
7.验证氧气的化学性质
用坩埚钳夹一小块木炭,先在空气中加热至红热,再伸入收集氧气的集气瓶里。观察现象。
氧气中
空气中
三、分解反应
分解反应:一种物质生成两种或两种以上
其它物质的反应叫分解反应。
AB A+B
四、氧气的工业制法
方法:分离液态空气。
原理:氧气的氮气的沸点不同。
课堂检测
1.下列关于实验室制氧气并用排水法收集的实验操作先后顺序中不正确的是( )
A.先检查装置的气密性,再装药品
B.先向试管中加入二氧化锰粉末后,再倒入过氧化氢溶液
C.等导管口排出的气泡均匀后,再将导管放在盛水的集气瓶中收集气体
D.先把盛满氧气的集气瓶从水槽中取出,再盖好毛玻璃片
D
2.下列关于氧气叙述正确的是( )
A.分离液态空气法制氧气属于化学变化
B.氧气与其他物质反应时都发光放热
C.用双氧水制氧气时必需要用酒精灯加热
D.排水法收集氧气时,一定到产生连续性气泡时再收集
3.下列有关催化剂的说法正确的是( )
A.只能加快反应速率
B.二氧化锰在任何化学反应中都是催化剂
C.能增加生成物的质量
D.质量和化学性质在化学反应前后不变
D
D
4.检验氧气的最简便方法是( )
A.用带火星的木条去检验 B.闻气味
C.倒入澄清的石灰水 D.观察颜色
5.检验用向上排空气法收集的氧气是否装满集气瓶的方法是( )
A.燃着的小木条伸入集气瓶中
B.带火星的小木条放在集气瓶口
C.燃着的小木条放在集气瓶口
D.带火星的小木条伸入集气瓶中
A
B
退出
第二节 制取氧气
(第二课时)
1.过氧化氢在什么条件下可以产生氧气?
2.如何检验有氧气生成?
3.什么叫催化剂?
一、复习回顾催化剂
二、实验室制取氧气
1.反应原理
高锰酸钾
锰酸钾
二氧化锰
氧气
+
+
(KMnO4)
(K2MnO4)
(H2O2)
(O2)
(2)
加热
过氧化氢
(H2O2)
(H2O)
(O2)
水
氧气
(1)
+
二氧化锰
二氧化锰
+
加热
(3)
氯酸钾
氯化钾
氧气
(KClO3)
(KCl)
(O2)
1)试管口应略向下倾斜;
2)导管不能伸入试管内太长;
3)铁夹要夹持在距试管口1/3处;
4)药品要平铺在试管底部。
2.装置要点
1)检——检查装置的气密性;
2)装——把药品装入试管,使之平铺在试管底部;
3)固——把试管固定在铁架台上;
4)点——点燃酒精灯开始加热:
5)集——收集氧气;
6)移——将导管移出水面;
7)熄——熄灭酒精灯。
3.操作步骤
4.收集方法
2)向上排空气法:因为氧气密度比空气大。
1)排水法:因为氧气不易溶于水。
用一根带火星的木条放在集气瓶口,若木条复燃,证明氧气已满。
5.验满方法
1)实验结束后,应先将导管移出水面,再熄灭酒
精灯。以防水倒流,造成试管炸裂。
2)如果所用药品是高锰酸钾,通常要在试管口塞一团棉花,防止高锰酸钾粉末随氧气溅入导管。
3)制备出的氧气应盖好玻璃片,瓶口向上正立在桌面上。
6.操作要点
7.验证氧气的化学性质
用坩埚钳夹一小块木炭,先在空气中加热至红热,再伸入收集氧气的集气瓶里。观察现象。
氧气中
空气中
三、分解反应
分解反应:一种物质生成两种或两种以上
其它物质的反应叫分解反应。
AB A+B
四、氧气的工业制法
方法:分离液态空气。
原理:氧气的氮气的沸点不同。
课堂检测
1.下列关于实验室制氧气并用排水法收集的实验操作先后顺序中不正确的是( )
A.先检查装置的气密性,再装药品
B.先向试管中加入二氧化锰粉末后,再倒入过氧化氢溶液
C.等导管口排出的气泡均匀后,再将导管放在盛水的集气瓶中收集气体
D.先把盛满氧气的集气瓶从水槽中取出,再盖好毛玻璃片
D
2.下列关于氧气叙述正确的是( )
A.分离液态空气法制氧气属于化学变化
B.氧气与其他物质反应时都发光放热
C.用双氧水制氧气时必需要用酒精灯加热
D.排水法收集氧气时,一定到产生连续性气泡时再收集
3.下列有关催化剂的说法正确的是( )
A.只能加快反应速率
B.二氧化锰在任何化学反应中都是催化剂
C.能增加生成物的质量
D.质量和化学性质在化学反应前后不变
D
D
4.检验氧气的最简便方法是( )
A.用带火星的木条去检验 B.闻气味
C.倒入澄清的石灰水 D.观察颜色
5.检验用向上排空气法收集的氧气是否装满集气瓶的方法是( )
A.燃着的小木条伸入集气瓶中
B.带火星的小木条放在集气瓶口
C.燃着的小木条放在集气瓶口
D.带火星的小木条伸入集气瓶中
A
B
退出
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
