人教版九年级化学 第十一单元 (四)酸、碱、盐化学性质的应用——图像分析课件共16张PPT)
文档属性
| 名称 | 人教版九年级化学 第十一单元 (四)酸、碱、盐化学性质的应用——图像分析课件共16张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 505.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-20 00:00:00 | ||
图片预览






文档简介
(共16张PPT)
酸、碱、盐专题复习
(四)酸、碱、盐化学性质的应用——图像分析
目录
01
知识点精讲
02
课堂检测
知识点1 酸(碱)溶液稀释时及酸碱中和反应时
溶液pH的变化图像
分 类 稀释酸 溶液 稀释碱 溶液 往酸溶液中加入碱溶液 往碱溶液中加入酸溶液
图 像
分 类 稀释酸 溶液 稀释碱 溶液 往酸溶液中加入碱溶液 往碱溶液中加入酸溶液
分析 起点pH<7,加水,pH逐渐增大,无限接近7,但不会等于或大于7 起点pH>7,加水,pH逐渐减小,无限接近7,但不会等于或小于7 起点pH<7,加碱溶液,pH逐渐变大,恰好完全反应时,pH=7,再继续加入碱溶液,pH>7 起点pH>7,加酸溶液,pH逐渐变小,恰好完全反应时,pH=7,再继续加入酸溶液,pH<7
续表
课堂练习
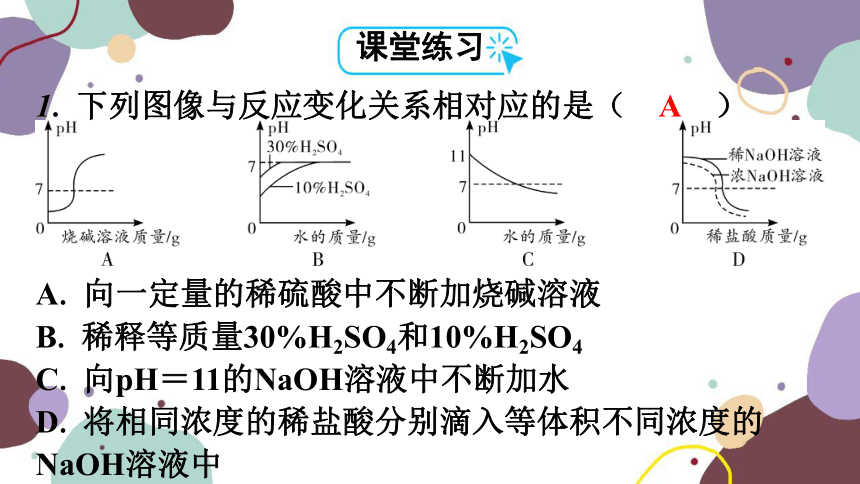
1. 下列图像与反应变化关系相对应的是( A )
A. 向一定量的稀硫酸中不断加烧碱溶液
B. 稀释等质量30%H2SO4和10%H2SO4
C. 向pH=11的NaOH溶液中不断加水
D. 将相同浓度的稀盐酸分别滴入等体积不同浓度的NaOH溶液中
A
思路点拨 酸的浓度越大,酸性越强,pH越小;碱的浓度越大,碱性越强,pH越大。
知识点2 涉及酸、碱、盐之间优先反应的图像分析
1. 向盐和酸的混合溶液中加入碱溶液,中和反应(碱和酸)优先。如向CuSO4和H2SO4的混合溶液中加入NaOH:
2. 向盐和碱的混合溶液中加入酸溶液,中和反应优先。如向Na2CO3和NaOH的混合溶液中加入稀盐酸:
3. 向可溶性钙盐(或钡盐)和酸的混合溶液中加入可溶性碳酸盐溶液,产生气体在先,生成沉淀在后。如向CaCl2和HCl的混合溶液中加入Na2CO3溶液:
4. 生成物质量变化曲线如图Z-4-1所示。
第二个反应在第一个反应结束后开始,即曲线不从原点开始,随着反应的进行,生成物的质量逐渐增大,当第二个反应完全结束时,生成物的质量达到最大且保持不变。
图Z-4-1
课堂练习
2. 一烧杯中含有HCl和CuCl2的混合液,现将一定质量分数的NaOH溶液滴加到混合液中直至过量,则下列图像正确的是( A )
A
1. (2022河北)向含有酚酞的氢氧化钠溶液中慢慢滴入稀硫酸,该过程中溶液pH的变化如图Z-4-2所示。下列分析正确的是( B )
图Z-4-2
B
A. N点时的溶液一定呈红色
B. P点时的溶液能与纯碱发生反应
C. M→N过程中溶液的碱性逐渐增强
D. M→P过程中生成的硫酸钠不断增加
2. 向一定质量的H2SO4和CuSO4溶液中逐滴滴加溶质质量分数为4%的NaOH溶液,所得沉淀质量随加入试剂质量的变化趋势如图Z-4-3所示,请回答下列问题。
图Z-4-3
(2)a点时溶液的溶质为 Na2SO4、CuSO4 (写化学式,下同)。
2NaOH+
(OH)2↓+Na2SO4
开始无明显
现象,一段时间后有蓝色沉淀生成
Na2SO4、CuSO4
(3)c点时溶液的溶质为 Na2SO4、 NaOH ,向其中滴入无色酚酞溶液,观察到的现象是 溶液变红色 。
(4)b点时溶液的溶质为 Na2SO4 ,此时CuSO4与NaOH恰好完全反应,沉淀质量达到最大值p,p= 0.049(n-m) (用含m、n的字母表示)。
Na2SO4、 NaOH
溶液变红色
Na2SO4
0.049(n-m)
谢 谢!
酸、碱、盐专题复习
(四)酸、碱、盐化学性质的应用——图像分析
目录
01
知识点精讲
02
课堂检测
知识点1 酸(碱)溶液稀释时及酸碱中和反应时
溶液pH的变化图像
分 类 稀释酸 溶液 稀释碱 溶液 往酸溶液中加入碱溶液 往碱溶液中加入酸溶液
图 像
分 类 稀释酸 溶液 稀释碱 溶液 往酸溶液中加入碱溶液 往碱溶液中加入酸溶液
分析 起点pH<7,加水,pH逐渐增大,无限接近7,但不会等于或大于7 起点pH>7,加水,pH逐渐减小,无限接近7,但不会等于或小于7 起点pH<7,加碱溶液,pH逐渐变大,恰好完全反应时,pH=7,再继续加入碱溶液,pH>7 起点pH>7,加酸溶液,pH逐渐变小,恰好完全反应时,pH=7,再继续加入酸溶液,pH<7
续表
课堂练习
1. 下列图像与反应变化关系相对应的是( A )
A. 向一定量的稀硫酸中不断加烧碱溶液
B. 稀释等质量30%H2SO4和10%H2SO4
C. 向pH=11的NaOH溶液中不断加水
D. 将相同浓度的稀盐酸分别滴入等体积不同浓度的NaOH溶液中
A
思路点拨 酸的浓度越大,酸性越强,pH越小;碱的浓度越大,碱性越强,pH越大。
知识点2 涉及酸、碱、盐之间优先反应的图像分析
1. 向盐和酸的混合溶液中加入碱溶液,中和反应(碱和酸)优先。如向CuSO4和H2SO4的混合溶液中加入NaOH:
2. 向盐和碱的混合溶液中加入酸溶液,中和反应优先。如向Na2CO3和NaOH的混合溶液中加入稀盐酸:
3. 向可溶性钙盐(或钡盐)和酸的混合溶液中加入可溶性碳酸盐溶液,产生气体在先,生成沉淀在后。如向CaCl2和HCl的混合溶液中加入Na2CO3溶液:
4. 生成物质量变化曲线如图Z-4-1所示。
第二个反应在第一个反应结束后开始,即曲线不从原点开始,随着反应的进行,生成物的质量逐渐增大,当第二个反应完全结束时,生成物的质量达到最大且保持不变。
图Z-4-1
课堂练习
2. 一烧杯中含有HCl和CuCl2的混合液,现将一定质量分数的NaOH溶液滴加到混合液中直至过量,则下列图像正确的是( A )
A
1. (2022河北)向含有酚酞的氢氧化钠溶液中慢慢滴入稀硫酸,该过程中溶液pH的变化如图Z-4-2所示。下列分析正确的是( B )
图Z-4-2
B
A. N点时的溶液一定呈红色
B. P点时的溶液能与纯碱发生反应
C. M→N过程中溶液的碱性逐渐增强
D. M→P过程中生成的硫酸钠不断增加
2. 向一定质量的H2SO4和CuSO4溶液中逐滴滴加溶质质量分数为4%的NaOH溶液,所得沉淀质量随加入试剂质量的变化趋势如图Z-4-3所示,请回答下列问题。
图Z-4-3
(2)a点时溶液的溶质为 Na2SO4、CuSO4 (写化学式,下同)。
2NaOH+
(OH)2↓+Na2SO4
开始无明显
现象,一段时间后有蓝色沉淀生成
Na2SO4、CuSO4
(3)c点时溶液的溶质为 Na2SO4、 NaOH ,向其中滴入无色酚酞溶液,观察到的现象是 溶液变红色 。
(4)b点时溶液的溶质为 Na2SO4 ,此时CuSO4与NaOH恰好完全反应,沉淀质量达到最大值p,p= 0.049(n-m) (用含m、n的字母表示)。
Na2SO4、 NaOH
溶液变红色
Na2SO4
0.049(n-m)
谢 谢!
同课章节目录
