2.1.2氧化钠和过氧化钠 课件(共30张PPT)2023-2024学年高一化学(人教版2019必修第一册)
文档属性
| 名称 | 2.1.2氧化钠和过氧化钠 课件(共30张PPT)2023-2024学年高一化学(人教版2019必修第一册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 21.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-21 14:48:32 | ||
图片预览











文档简介
(共30张PPT)
新
教
材
第二章 海水中的重要元素—钠和氯
钠及其化合物
第一节
第2课时 氧化钠和过氧化钠
【学习目标】
1.了解氧化钠、过氧化钠的主要性质和用途。
2.掌握过氧化钠的增重规律。
新课导入:“滴水点灯”
同学们想知道“滴水点灯”的奥秘吗?
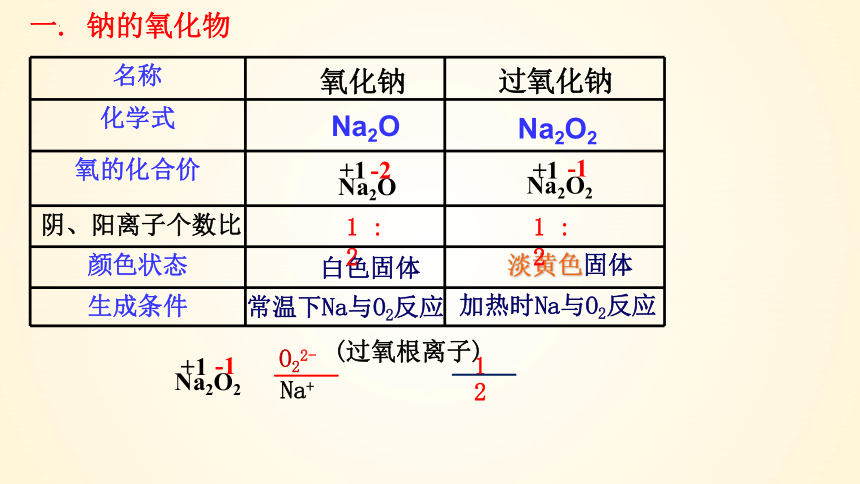
名称
化学式
氧的化合价
颜色状态
生成条件
加热时Na与O2反应
常温下Na与O2反应
淡黄色固体
白色固体
氧化钠
过氧化钠
Na2O
+1
-2
Na2O2
+1
-1
Na2O2
Na2O
一. 钠的氧化物
阴、阳离子个数比
1 : 2
1 : 2
Na2O2
+1
-1
O22-
(过氧根离子)
Na+
1
2
(一) 氧化钠Na2O
白色粉末,离子化合物,强电解质,碱性氧化物
回顾:碱性氧化物有哪些通性?
与H2O、酸性氧化物、酸等发生反应。
试写出Na2O分别与H2O、CO2、 SO2 、HCl(aq)反应方程式
Na2O + H2O = 2NaOH
1、 Na2O与水反应:
2、 Na2O与酸性氧化物反应:
Na2O + CO2 = Na2CO3
Na2O + SO2 = Na2SO3
3、 Na2O与酸反应:
Na2O + 2HCl = 2NaCl + H2O
那么Na2O2可能具有什么性质呢?是否同Na2O一样也能与水、CO2、 SO2、盐酸反应呢?其产物是什么?
Na2O2+H2O=
先来探究:
实验2-3:
将水加入Na2O2的试管中,立即把带火星的木条放在试管口;用手摸一摸试管外壁;然后向反应后的溶液中滴入几滴酚酞试液.
(课本P35)
(1)产生大量气泡,带火星的木条复燃;
(2)试管外壁发热。
(3)滴加酚酞,溶液先变红后褪色;
有O2生成
有碱生成,
溶液有漂白性
反应放热
实验2-3:
现 象:
原 因:
将水加入Na2O2的试管中,立即把带火星的木条放在试管口;用手摸一摸试管外壁;然后向反应后的溶液中滴入几滴酚酞试液.
(课本P35)
漂白性:使有机色素褪色叫漂白性
(二) 过氧化钠Na2O2
淡黄色粉末,离子化合物,强电解质,过氧化物
1.与水反应:
用双线桥表示反应中的电子转移情况
-1 -2 0
失去 2×e-
得到 2×e-
Na2O2既是氧化剂也是还原剂
氧化性: Na2O2 O2
1个 Na2O2与H2O反应转移 个e-
1
离子方程式?
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2H2O=4Na+ + 4OH- + O2↑
>
思考:上述实验中,为什么变红的溶液振荡之后又褪色呢?
Na2O2+H2O反应的机理
思考:上述实验中,为什么变红的溶液振荡之后又褪色呢?
Na2O2+H2O反应的机理
① 先发生复分解反应
Na2O2 + 2H2O = H2O2 + 2NaOH
② 再发生分解反应(氧化还原反应)
2H2O2 = 2H2O + O2 ↑
Na2O2、H2O2都具有强氧化性,具有漂白作用!
应 用:
Na2O2可用于消毒、杀菌和漂白剂
现在你知道“滴水点灯”的秘密在哪里吗?
2.与CO2反应:
实 验:脱脂棉包Na2O2,用长玻璃管向脱脂棉吹气
(二) 过氧化钠Na2O2
2.与CO2反应:
实 验:脱脂棉包Na2O2,用长玻璃管向脱脂棉吹气
2Na2O2 + 2CO2 = 2Na2CO3 + O2
用双线桥表示反应中的电子转移情况
失去 2×e-
-1 -2 0
得到 2×e-
Na2O2既是氧化剂也是还原剂
1个 Na2O2与CO2反应转移 个e-
1
注意:此反应不在溶液中进行,不能改写成离子方程式
应 用:
Na2O2可用于呼吸面具、潜水艇作供氧剂
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
(二) 过氧化钠Na2O2
Na2O2用于呼吸面具和潜水艇中供氧剂等。
思考与交流: Na2O2与SO2能发生反应吗?若能,生成什么物质?
[提示:SO2具有强还原性]
2Na2O2 + 2SO2 = 2Na2SO3 + O2
= 2Na2SO4
Na2O2 + SO2 = Na2SO4
3. 与盐酸的反应:
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑
此反应说明:Na2O2不是碱性氧化物
问:过氧化钠Na2O2与硫酸溶液呢?
(二) 过氧化钠Na2O2
Na2O2的制取和用途
用途:
制取:
2Na+O2==Na2O2
△
或: 2Na2O+O2 == 2Na2O2
△
②作漂白剂、消毒剂。
①作高空飞行和潜水艇中供氧剂。
完成下列表格
【归纳总结】
化学式 Na2O Na2O2
氧元素化合价 _____ _______
色、态
阴、阳离子个数比
是否为碱性氧化物
与水反应的方程式
-2
-1
白色固体
淡黄色固体
1∶2
1∶2
不是
是
Na2O+H2O=2NaOH
2Na2O2+2H2O=4NaOH+O2↑
与CO2反应的方程式
与盐酸反应的方程式
Na2O+CO2=Na2CO3
2Na2O2+2CO2=2Na2CO3+O2
Na2O+2HCl=2NaCl+H2O
2Na2O2+4HCl=4NaCl+2H2O+O2↑
与SO2反应的方程式
Na2O+SO2=Na2SO3
Na2O2+SO2=Na2SO4
H2O
B. 泡沫灭火器
C. 干燥的沙土
D. 干粉灭火器(NaHCO3)
问题1:金属钠着火应选择什么方法灭火?
√
Na2O2着火呢?
干燥的沙土
问题2:金属钠久置空气中的如何变化?
换Na2O呢?
银白色
变暗
变白色固体
结块
粉末
(Na)
(Na2CO3)
(Na2CO3· 10H2O)
(NaOH)
(Na2O)
与O2
与H2O
与CO2
风化
成液
(NaOH潮解)
银白色
变暗
变白色固体
结块
粉末
(Na)
(Na2CO3)
(Na2CO3· 10H2O)
(NaOH)
(Na2O)
与O2
与H2O
与CO2
风化
成液
(NaOH潮解)
问题2:金属钠久置空气中的如何变化?
换Na2O2呢?
Na2O2
与H2O
问题3:
①NaOH溶液滴入紫色石蕊溶液中
②Na2O2固体加入到紫色石蕊溶液中
生成NaOH,呈碱性,同时Na2O2又有漂白性。
下列过程中可能看到的现象?
溶液变蓝
剧烈反应,产生大量气泡,溶液先变蓝, 后褪色
2Na2O2+2H2O = 4NaOH+O2↑
原 因:
问题4:
将金属Na投入CuSO4溶液中,产生大量无色气体,生成蓝色沉淀
2Na+2H2O+CuSO4=Na2SO4+H2↑+Cu(OH)2↓
若将Na2O2投入CuSO4溶液中,预计有什么现象?
追 问:Na2O2+FeCl3(溶液)呢?
产生大量无色气体,生成蓝色沉淀
H2↑
Cu(OH)2↓
2Na2O2+2H2O = 4NaOH+O2↑
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
×2
4
2
2
2
2Na2O2 +2H2O+2CuSO4=2Na2SO4+O2↑+2Cu(OH)2↓
现象:
O2↑
Cu(OH)2↓
6Na2O2+4FeCl3 +6H2O
=4Fe(OH)3↓+ 3O2↑+12NaCl
1.下列关于钠的氧化物的说法正确的是
A.向包有Na2O2粉末的脱脂棉上滴加几滴水,脱脂棉剧烈燃烧起来,
说明Na2O2与H2O反应放热且有氧气生成
B.Na2O与Na2O2中阳、阴离子的个数比不相同
C.将金属钠切开,表面变暗,最终得到淡黄色固体
D.金属钠着火时,可用泡沫灭火器灭火
A
2. 在一定温度下,向饱和的烧碱溶液中放入一定量的Na2O2 ,充分反应后恢复到原温度,下列说法正确的是 ( )
A.溶液中Na+浓度增大,有O2放出
B.溶液的OH-浓度不变,有H2放出
C.溶液中Na+数目减小,有O2放出
D.溶液的OH-浓度增大,有O2放出
注意:题中“饱和”、“过氧化钠”、“原温度”等关键条件。
C
3.在溶液中加入中足量Na2O2后,仍能大量共存的离子组是( )
A.NH4+、Ba2+、Cl-、NO3- B.K+、CO32-、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3- D.Na+、Cl-、CO32-、SO32-
解析:此题主要从两方面考虑:
①考虑Na2O2的强氧化性,溶液中具有还原性的离子不能共存;
②2Na2O2+2H2O=4NaOH+O2↑,考虑不能与OH-共存的离子
B
×
×
×
×
×
4. 2.1 g平均相对分子质量为7.2的CO和H2组成混合气体与足量O2充分燃烧后立即通入足量的Na2O2中,固体质量增加( )
A.2.1 g B.3.6 g C.7.2 g D.不可求
A
① 2CO + O2 = 2CO2
2CO2+2Na2O2 = 2Na2CO3+O2
② 2H2 + O2 = 2H2O
2H2O(g)+2Na2O2 = 4NaOH+O2
根据①②分析可知,CO、H2与足量O2反应后的产物再与Na2O2反应,
Na2O2增重的质量为原CO和H2混合气体的质量,所以固体质量增加了2.1 g。
相当于:
CO+Na2O2=Na2CO3
相当于:
H2+Na2O2 =2NaOH
1.取a g某物质在O2中完全燃烧,将生成物与足量Na2O2固体完全反应,反应后,固体质量恰好也增加了a g,下列物质不能满足上述结果的是( )
√
√
推而广之:
凡化学式符合(CO)m(H2)n形式的物质,均可被Na2O2完全吸收
变形为(CO)6(H2)6
变形为C·(CO)11(H2)11
×
√
D
A. H2 B. CO C. C6H12O6 D. C12H22O11
2.一定温度下,Wg下列物质在足量氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重Wg,符合此要求的是
①H2 ②CO ③CO和H2 ④HCOOCH3 ⑤HOOC-COOH
A.全部 B.仅④⑤ C.仅①②③ D.除⑤以外
D
如:w g 符合通式为(CO)m(H2)n的物质,在O2中充分燃烧后,将其产物通过足量的Na2O2固体,反应完毕,固体增重也必是w g。
练后反思
符合此规律的物质有
无机物:CO、H2及CO、H2的混合气体
有机物: CH3OH(甲醇)、CH3COOH(醋酸)、C6H12O6(葡萄糖)等
新
教
材
第二章 海水中的重要元素—钠和氯
钠及其化合物
第一节
第2课时 氧化钠和过氧化钠
【学习目标】
1.了解氧化钠、过氧化钠的主要性质和用途。
2.掌握过氧化钠的增重规律。
新课导入:“滴水点灯”
同学们想知道“滴水点灯”的奥秘吗?
名称
化学式
氧的化合价
颜色状态
生成条件
加热时Na与O2反应
常温下Na与O2反应
淡黄色固体
白色固体
氧化钠
过氧化钠
Na2O
+1
-2
Na2O2
+1
-1
Na2O2
Na2O
一. 钠的氧化物
阴、阳离子个数比
1 : 2
1 : 2
Na2O2
+1
-1
O22-
(过氧根离子)
Na+
1
2
(一) 氧化钠Na2O
白色粉末,离子化合物,强电解质,碱性氧化物
回顾:碱性氧化物有哪些通性?
与H2O、酸性氧化物、酸等发生反应。
试写出Na2O分别与H2O、CO2、 SO2 、HCl(aq)反应方程式
Na2O + H2O = 2NaOH
1、 Na2O与水反应:
2、 Na2O与酸性氧化物反应:
Na2O + CO2 = Na2CO3
Na2O + SO2 = Na2SO3
3、 Na2O与酸反应:
Na2O + 2HCl = 2NaCl + H2O
那么Na2O2可能具有什么性质呢?是否同Na2O一样也能与水、CO2、 SO2、盐酸反应呢?其产物是什么?
Na2O2+H2O=
先来探究:
实验2-3:
将水加入Na2O2的试管中,立即把带火星的木条放在试管口;用手摸一摸试管外壁;然后向反应后的溶液中滴入几滴酚酞试液.
(课本P35)
(1)产生大量气泡,带火星的木条复燃;
(2)试管外壁发热。
(3)滴加酚酞,溶液先变红后褪色;
有O2生成
有碱生成,
溶液有漂白性
反应放热
实验2-3:
现 象:
原 因:
将水加入Na2O2的试管中,立即把带火星的木条放在试管口;用手摸一摸试管外壁;然后向反应后的溶液中滴入几滴酚酞试液.
(课本P35)
漂白性:使有机色素褪色叫漂白性
(二) 过氧化钠Na2O2
淡黄色粉末,离子化合物,强电解质,过氧化物
1.与水反应:
用双线桥表示反应中的电子转移情况
-1 -2 0
失去 2×e-
得到 2×e-
Na2O2既是氧化剂也是还原剂
氧化性: Na2O2 O2
1个 Na2O2与H2O反应转移 个e-
1
离子方程式?
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2H2O=4Na+ + 4OH- + O2↑
>
思考:上述实验中,为什么变红的溶液振荡之后又褪色呢?
Na2O2+H2O反应的机理
思考:上述实验中,为什么变红的溶液振荡之后又褪色呢?
Na2O2+H2O反应的机理
① 先发生复分解反应
Na2O2 + 2H2O = H2O2 + 2NaOH
② 再发生分解反应(氧化还原反应)
2H2O2 = 2H2O + O2 ↑
Na2O2、H2O2都具有强氧化性,具有漂白作用!
应 用:
Na2O2可用于消毒、杀菌和漂白剂
现在你知道“滴水点灯”的秘密在哪里吗?
2.与CO2反应:
实 验:脱脂棉包Na2O2,用长玻璃管向脱脂棉吹气
(二) 过氧化钠Na2O2
2.与CO2反应:
实 验:脱脂棉包Na2O2,用长玻璃管向脱脂棉吹气
2Na2O2 + 2CO2 = 2Na2CO3 + O2
用双线桥表示反应中的电子转移情况
失去 2×e-
-1 -2 0
得到 2×e-
Na2O2既是氧化剂也是还原剂
1个 Na2O2与CO2反应转移 个e-
1
注意:此反应不在溶液中进行,不能改写成离子方程式
应 用:
Na2O2可用于呼吸面具、潜水艇作供氧剂
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
(二) 过氧化钠Na2O2
Na2O2用于呼吸面具和潜水艇中供氧剂等。
思考与交流: Na2O2与SO2能发生反应吗?若能,生成什么物质?
[提示:SO2具有强还原性]
2Na2O2 + 2SO2 = 2Na2SO3 + O2
= 2Na2SO4
Na2O2 + SO2 = Na2SO4
3. 与盐酸的反应:
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑
此反应说明:Na2O2不是碱性氧化物
问:过氧化钠Na2O2与硫酸溶液呢?
(二) 过氧化钠Na2O2
Na2O2的制取和用途
用途:
制取:
2Na+O2==Na2O2
△
或: 2Na2O+O2 == 2Na2O2
△
②作漂白剂、消毒剂。
①作高空飞行和潜水艇中供氧剂。
完成下列表格
【归纳总结】
化学式 Na2O Na2O2
氧元素化合价 _____ _______
色、态
阴、阳离子个数比
是否为碱性氧化物
与水反应的方程式
-2
-1
白色固体
淡黄色固体
1∶2
1∶2
不是
是
Na2O+H2O=2NaOH
2Na2O2+2H2O=4NaOH+O2↑
与CO2反应的方程式
与盐酸反应的方程式
Na2O+CO2=Na2CO3
2Na2O2+2CO2=2Na2CO3+O2
Na2O+2HCl=2NaCl+H2O
2Na2O2+4HCl=4NaCl+2H2O+O2↑
与SO2反应的方程式
Na2O+SO2=Na2SO3
Na2O2+SO2=Na2SO4
H2O
B. 泡沫灭火器
C. 干燥的沙土
D. 干粉灭火器(NaHCO3)
问题1:金属钠着火应选择什么方法灭火?
√
Na2O2着火呢?
干燥的沙土
问题2:金属钠久置空气中的如何变化?
换Na2O呢?
银白色
变暗
变白色固体
结块
粉末
(Na)
(Na2CO3)
(Na2CO3· 10H2O)
(NaOH)
(Na2O)
与O2
与H2O
与CO2
风化
成液
(NaOH潮解)
银白色
变暗
变白色固体
结块
粉末
(Na)
(Na2CO3)
(Na2CO3· 10H2O)
(NaOH)
(Na2O)
与O2
与H2O
与CO2
风化
成液
(NaOH潮解)
问题2:金属钠久置空气中的如何变化?
换Na2O2呢?
Na2O2
与H2O
问题3:
①NaOH溶液滴入紫色石蕊溶液中
②Na2O2固体加入到紫色石蕊溶液中
生成NaOH,呈碱性,同时Na2O2又有漂白性。
下列过程中可能看到的现象?
溶液变蓝
剧烈反应,产生大量气泡,溶液先变蓝, 后褪色
2Na2O2+2H2O = 4NaOH+O2↑
原 因:
问题4:
将金属Na投入CuSO4溶液中,产生大量无色气体,生成蓝色沉淀
2Na+2H2O+CuSO4=Na2SO4+H2↑+Cu(OH)2↓
若将Na2O2投入CuSO4溶液中,预计有什么现象?
追 问:Na2O2+FeCl3(溶液)呢?
产生大量无色气体,生成蓝色沉淀
H2↑
Cu(OH)2↓
2Na2O2+2H2O = 4NaOH+O2↑
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
×2
4
2
2
2
2Na2O2 +2H2O+2CuSO4=2Na2SO4+O2↑+2Cu(OH)2↓
现象:
O2↑
Cu(OH)2↓
6Na2O2+4FeCl3 +6H2O
=4Fe(OH)3↓+ 3O2↑+12NaCl
1.下列关于钠的氧化物的说法正确的是
A.向包有Na2O2粉末的脱脂棉上滴加几滴水,脱脂棉剧烈燃烧起来,
说明Na2O2与H2O反应放热且有氧气生成
B.Na2O与Na2O2中阳、阴离子的个数比不相同
C.将金属钠切开,表面变暗,最终得到淡黄色固体
D.金属钠着火时,可用泡沫灭火器灭火
A
2. 在一定温度下,向饱和的烧碱溶液中放入一定量的Na2O2 ,充分反应后恢复到原温度,下列说法正确的是 ( )
A.溶液中Na+浓度增大,有O2放出
B.溶液的OH-浓度不变,有H2放出
C.溶液中Na+数目减小,有O2放出
D.溶液的OH-浓度增大,有O2放出
注意:题中“饱和”、“过氧化钠”、“原温度”等关键条件。
C
3.在溶液中加入中足量Na2O2后,仍能大量共存的离子组是( )
A.NH4+、Ba2+、Cl-、NO3- B.K+、CO32-、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3- D.Na+、Cl-、CO32-、SO32-
解析:此题主要从两方面考虑:
①考虑Na2O2的强氧化性,溶液中具有还原性的离子不能共存;
②2Na2O2+2H2O=4NaOH+O2↑,考虑不能与OH-共存的离子
B
×
×
×
×
×
4. 2.1 g平均相对分子质量为7.2的CO和H2组成混合气体与足量O2充分燃烧后立即通入足量的Na2O2中,固体质量增加( )
A.2.1 g B.3.6 g C.7.2 g D.不可求
A
① 2CO + O2 = 2CO2
2CO2+2Na2O2 = 2Na2CO3+O2
② 2H2 + O2 = 2H2O
2H2O(g)+2Na2O2 = 4NaOH+O2
根据①②分析可知,CO、H2与足量O2反应后的产物再与Na2O2反应,
Na2O2增重的质量为原CO和H2混合气体的质量,所以固体质量增加了2.1 g。
相当于:
CO+Na2O2=Na2CO3
相当于:
H2+Na2O2 =2NaOH
1.取a g某物质在O2中完全燃烧,将生成物与足量Na2O2固体完全反应,反应后,固体质量恰好也增加了a g,下列物质不能满足上述结果的是( )
√
√
推而广之:
凡化学式符合(CO)m(H2)n形式的物质,均可被Na2O2完全吸收
变形为(CO)6(H2)6
变形为C·(CO)11(H2)11
×
√
D
A. H2 B. CO C. C6H12O6 D. C12H22O11
2.一定温度下,Wg下列物质在足量氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重Wg,符合此要求的是
①H2 ②CO ③CO和H2 ④HCOOCH3 ⑤HOOC-COOH
A.全部 B.仅④⑤ C.仅①②③ D.除⑤以外
D
如:w g 符合通式为(CO)m(H2)n的物质,在O2中充分燃烧后,将其产物通过足量的Na2O2固体,反应完毕,固体增重也必是w g。
练后反思
符合此规律的物质有
无机物:CO、H2及CO、H2的混合气体
有机物: CH3OH(甲醇)、CH3COOH(醋酸)、C6H12O6(葡萄糖)等
