北京市第十九中学2022-2023学年高一下学期期末考试化学试题(含答案)
文档属性
| 名称 | 北京市第十九中学2022-2023学年高一下学期期末考试化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 889.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-21 14:18:51 | ||
图片预览



文档简介
北京市第十九中学2022-2023学年高一下学期期末考试
化学(2023.07)
考试时长:90分钟10满分:100分
考生务必将答案填写在答题卡上,在试卷上作答无效。考试结束后,将答题卡交回。
可能用到的相对原子质量:H1 C12 N14 O16 S32 Cl35.5 Si28 F19
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.下列生活中的现象与物质结构关联不正确的是( )
A.烟花的绚丽多彩与电子跃迁有关 B.干冰升华与其分子间作用力弱有关 C.钻石璀璨夺目与其为共价晶体有关 D.金属可加工成各种形状与金属键有关
2.下列元素或化合物的性质变化顺序正确的是( )
A.共价键的极性: B.第一电离能:
C.离子键强度: D.原子半径:
3.下列化学用语或图示表达不正确的是( )
A.基态Cl原子的价电子轨道表示式: B.NaOH的电子式:
C.氨分子的VSEPR模型: D.结构示意图:
4.下列事实与氢键无关的是( )
A.水结成冰体积膨胀,密度变小
B.水加热到很高的温度都难以分解
C.相同条件下,氨比同族其它氢化物在水中的溶解度大
D.对羟基苯甲酸()的熔点比邻羟基苯甲酸()高
5.下列说法正确的是( )
A.分子晶体中都存在共价键
B.含有极性键的化合物分子一定不含非极性键
C.、、、的熔、沸点逐渐升高与范德华力有关
D.只要是离子化合物,其熔点一定比共价化合物的熔点高
6.下列说法①和②均正确,但是说法①不能正确解释说法②的是( )
选项 说法① 说法②
A 非金属性: 酸性:
B 分子间作用力: 沸点:
C 键能: 稳定性:
D 电负性: 共价键极性:
7.由短周期主族元素W、X、Y、Z构成的一种阴离子,结构如图所示,W、X、Y、Z的原子序数依次增大,Z元素无正化合价。下列说法正确的是( )
A.X与Y的简单氢化物沸点: B.原子半径大小关系是:
C.该阴离子中键与键数之比为5:2 D.该阴离子中各原子均满足8电子稳定结构
8.下列化学实验中的操作、现象及解释有正确对应关系的是( )
选项 操作 现象 解释
A 向蓝色的稀溶液中加入食盐 溶液由蓝色变为绿色 颜色变化与、相对量多少有关
B 向溶液中加入KSCN溶液 溶液变为红色 生成红色的离子化合物
C 用毛皮摩擦过的带电橡胶棒靠近液流 液流方向不改变 中不含非极性键
D 向溶液里逐滴加入氨水至过量 先形成蓝色沉淀,后溶解得到深蓝色溶液 沉淀溶解时主要反应:
9.科学家对嫦娥五号带回的月球土壤进行分析,发现含有X、Y、Z、V、W五种原子序数依次增大的前20号元素,X原子的最外层电子数是其电子总数的,V的单质常在地球火山口附近沉积,Y属于s区元素,且其原子中没有单电子,Y、W原子的最外层电子数相等且之和等于Z原子的最外层电子数,下列说法正确的是( )
A.Y的氧化物是两性氧化物 B.简单氢化物分子中共价键键能:
C.简单离子半径: D.X、Z形成的化合物属于分子晶体
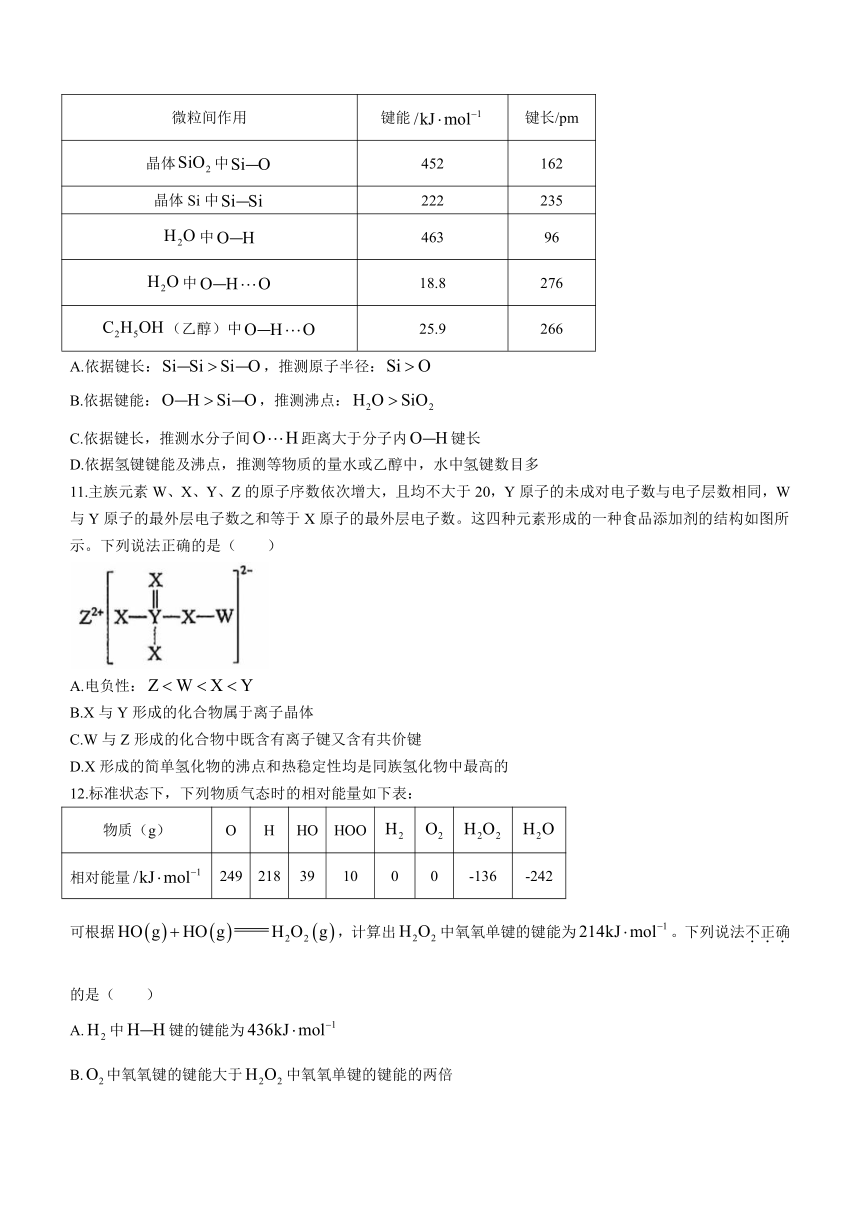
10.结合下表中数据,判断下列说法不正确的是( )(氢键键长定义为的长度)
微粒间作用 键能 键长/pm
晶体中 452 162
晶体Si中 222 235
中 463 96
中 18.8 276
(乙醇)中 25.9 266
A.依据键长:,推测原子半径:
B.依据键能:,推测沸点:
C.依据键长,推测水分子间距离大于分子内键长
D.依据氢键键能及沸点,推测等物质的量水或乙醇中,水中氢键数目多
11.主族元素W、X、Y、Z的原子序数依次增大,且均不大于20,Y原子的未成对电子数与电子层数相同,W与Y原子的最外层电子数之和等于X原子的最外层电子数。这四种元素形成的一种食品添加剂的结构如图所示。下列说法正确的是( )
A.电负性:
B.X与Y形成的化合物属于离子晶体
C.W与Z形成的化合物中既含有离子键又含有共价键
D.X形成的简单氢化物的沸点和热稳定性均是同族氢化物中最高的
12.标准状态下,下列物质气态时的相对能量如下表:
物质(g) O H HO HOO
相对能量 249 218 39 10 0 0 -136 -242
可根据,计算出中氧氧单键的键能为。下列说法不正确的是( )
A.中键的键能为
B.中氧氧键的键能大于中氧氧单键的键能的两倍
C.解离氧氧单键所需能量:
D.
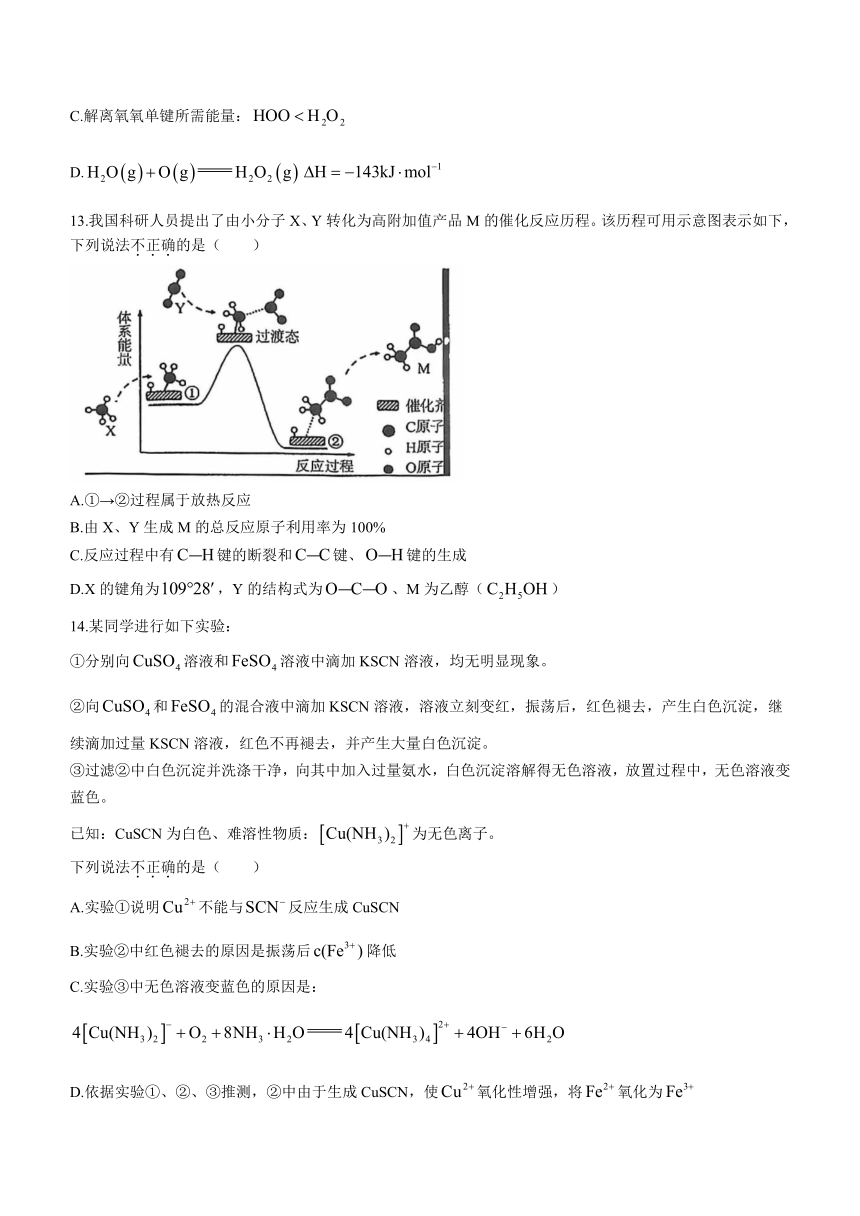
13.我国科研人员提出了由小分子X、Y转化为高附加值产品M的催化反应历程。该历程可用示意图表示如下,下列说法不正确的是( )
A.①→②过程属于放热反应
B.由X、Y生成M的总反应原子利用率为100%
C.反应过程中有键的断裂和键、键的生成
D.X的键角为,Y的结构式为、M为乙醇()
14.某同学进行如下实验:
①分别向溶液和溶液中滴加KSCN溶液,均无明显现象。
②向和的混合液中滴加KSCN溶液,溶液立刻变红,振荡后,红色褪去,产生白色沉淀,继续滴加过量KSCN溶液,红色不再褪去,并产生大量白色沉淀。
③过滤②中白色沉淀并洗涤干净,向其中加入过量氨水,白色沉淀溶解得无色溶液,放置过程中,无色溶液变蓝色。
已知:CuSCN为白色、难溶性物质:为无色离子。
下列说法不正确的是( )
A.实验①说明不能与反应生成CuSCN
B.实验②中红色褪去的原因是振荡后降低
C.实验③中无色溶液变蓝色的原因是:
D.依据实验①、②、③推测,②中由于生成CuSCN,使氧化性增强,将氧化为
第二部分
本部分共5题,共58分。请将答案填写在答题纸上,在试卷上作答无效。
15.(9分)黄铜矿是主要的炼铜原料,其中铜元素的主要存在形式是,含有和。
(1)基态的价层轨道表示式为________。
(2)在较低温度下与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的中心原子杂化方式为________,属于________(填“极性”或“非极性”)分子。
②X与水相比,二者中沸点较低的化合物的电子式为________。
(3)与氧气反应生成,中心原子的价层电子对数为________;从电子云重叠方式看,分子中所含的共价键类型有________。
(4)用配位浸出法炼铜时,可用氨水将中的铜元素浸出,溶液变蓝,同时生成和含有+6价硫元素的微粒,该过程中发生反应的离子方程式为________。
16.(10分)钴()元素容易形成配合物,其常见+2、+3价。
(1)已知配合物的磁矩(n表示中心原子或离子的未成对电子数)。某含钴配离子结构如图所示[所带电荷数目及符号未标出,乙二胺()为电中性配体],若测得其,则该离子所带电荷数目及符号为________。
(2)中子衍射实验证实,晶体中仅存在3种离子(不存在分子):、和上述含钴配离子。该晶体中存在的化学键类型有________;含钴配离子中提供孤电子对的原子是________,配位数是________;是________(填离子符号)。
(3)乙二胺()与正丁烷()的相对分子质量相近,乙二胺沸点比正丁烷高的原因是________。
(4)钴酸锂()是常见的锂离子电池正极材料,其晶胞结构如图所示。晶体中O围绕Co形成八面体,八面体共棱形成层状空间结构,与层交替排列。该晶胞中O的个数为________;充电过程中晶胞高度c变大,原因是会从八面体层间脱出,导致________。
17.(10分)氢能源是一种不依赖化石燃料的储量丰富的清洁能源。
(1)化石燃料中天然气的主要成分是甲烷,甲烷的结构式为________。
(2)我国科学家研发了以负载氧化镍纳米晶粒的聚合物氮化碳二维纳米材料为催化剂的高效电解水制氢技术。
①Ni元素的原子序数为________。
②C、N、O的电负性的由大到小的顺序是________。
③为寻找更多的金属催化剂,科学家从众多金属元素中选取Co、Fe、Cu进行了相关研究,并取得了成功。选取这三种金属进行相关研究的原因可能是________。
(3)开发新型储氢材料是氢能利用的重要研究方向。氨硼烷()是一种潜在的储氢材料,可由(结构为平面六元环状)通过如下反应制得:
①从分子结构解释、、的键角依次减小的原因________。
②中N原子的杂化方式为________。
③中N、B都达到稳定结构,的结构式为(用→表示出配位键)________。
(4)有储氢功能的铜银合金晶体具有立方堆积结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子位于由Cu原子与Ag原子构成的全部四面体中。
①该晶体储氢后的化学式为________。
②已知:;表示阿伏加德罗常数的值。若该立方晶胞的边长为a pm,忽略吸氢前后晶胞的体积变化,标准状况下氢气的密度为,则该储氢材料的储氢能力为________(用含有a、b和的代数式表示)。
18.(15分)主族元素N、Si、F、Cl、Se、Ca等的某些化合物对工农业生产意义重大。
(1)陶瓷具有硬度大、强度高、耐高温等性质,其晶体类型为________。
(2)的熔、沸点低于,原因是________。
(3)硒元素位于元素周期表中________(选填s、p、d、f、ds)区,基态硒原子核外电子云轮廓图呈球形、哑铃形的能级上电子数之比为________。
(4)的中心原子杂化方式为________,的空间构型是________,与互为等电子体的微粒有________(写一种微粒即可)。
(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为________;以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,将原子位置的坐标表示为晶胞棱长的分数,称作原子的分数坐标。ZnSe晶胞中部分原子的分数坐标:A点为、B点为,则C点原子的分数坐标为________。
(6)已知:称为羟基,无机含氧酸()分子结构中含有羟基,如果成酸元素R相同,含氧酸分子中非羟基氧个数越多,R的正电性越高,导致中的O的电子向R偏移,键极性增强,因而在水分子的作用下,也就越容易电离出,即酸性越强。也就是说,无机含氧酸的酸性随着分子中连接在中心原子R上的非羟基氧的个数增多而增强。
亚磷酸()为弱酸,分子结构中含有一个非羟基氧,其酸性比HClO的酸性________(填“强”或“弱”),与过量NaOH溶液反应的离子方程式为________。
(7)萤石()是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是________,若该立方晶胞参数为a cm,阴、阳离子的核间距最小为________cm。
19.(14分)大力推广太阳能和新型化学电池的使用,有助于实现碳减排、碳中和的目标。
(1)太阳能电池板主要材料为单晶硅或多晶硅,硅元素在周期表中的位置是________,与硅同主族的锗元素的基态原子价层电子排布式为________。
(2)分子中Si原子的杂化方式为________,分子中价层电子对的数目为________,分子的空间构型为________,
(3)某有机硅化物的结构为:,标号①~④的碳原子中,属于手性碳原子的是________(填标号)。
(4)碳与硅元素同主族,但形成的晶体性质却有所不同。单晶硅不导电,但石墨晶体中存在自由电子、能导电,石墨晶体中存在自由电子的原因是________。
(5)SiC和单晶硅具有相似的晶体结构,但SiC熔点更高,其原因是________。
(6)磷酸铁锂()电池充放电过程中,正极变化的示意图如下:
①的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有的单元数有________个。
②电池充电时,脱出部分,形成,结构示意图如(b)所示,则x=________,。
北京市第十九中学2022-2023学年高一下学期期末考试
参考答案
第一部分
本部分共14题,每题3分,共42分。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 C A D B C A D A B B D C D B
第二部分
本部分共5题,共58分。
15.(9分)
(1)(1分)
(2)①(1分)极性(1分)
②(1分)
(3)3(1分) 键和键(2分)
(4)(2分)
【物质对,但配平错,给1分】
16.(10分)
(1)一个正电荷(或1+、+1)(1分)
(2)离子键、共价键(或配位键)(2分) N、Cl(2分) 6(1分) (1分)
(3)因为乙二胺分子间存在氢键,所以乙二胺的沸点高于正丁烷(1分)
(4)6(1分)
层和层吸引力减弱,层之间的同性排斥使层间距增大(或:相邻的层中同性相斥,使层间距增大)(1分)
17.(10分)
(1)(1分)
(2)①28(1分)②(1分)
③这三种元素都是过渡元素,在元素周期表中位置和Ni相近,可能具有相似的性质(1分)
(3)①中心原子为sp杂化,键角为180度;和中心原子均为杂化,中孤对电子与成键电子对之间的斥力大于中成键电子对之间的斥力,故键角:(2分)【3种物质杂化方式都说明1分,孤对电子1分〗
②(1分)③(1分)
(4)①(1分)②(1分)
18.(15分)
(1)共价晶体(1分)
(2)和是结构相似的分子晶体,的相对分子量大于,分子间作用力大(2分)
【倒扣分,标红的3点,少1点扣1分,扣完为止】
(3)p(1分) 1:2或8:16(1分)
(4)(1分) 三角锥形(1分) 、、等(合理即可得分,1分)
(5)4(1分) (1分)
(6)强(1分) (2分)
(7)(1分) (1分)
19.(14分)
(1)第三周期、ⅣA族(2分) (1分)
(2)(1分) 4(1分) V形(或折线形、角形)(1分)
(3)②(1分)
(4)石墨中每个碳原子均为杂化,通过单键形成平面层状结构,未参与杂化的p电子可在同一层内自由移动(或:未参与杂化的p电子可形成离域键,电子流动性增强)(2分)
【倒扣分,标红的3点,少1点扣1分,扣完为止】,;
(5)同为共价晶体,,键比键更短,键能更大,SiC熔点更高(2分)
【倒扣分,标红的4点,少1点扣1分,扣完为止】
(6)①4(1分) ②(1分) 13:3(1分)
化学(2023.07)
考试时长:90分钟10满分:100分
考生务必将答案填写在答题卡上,在试卷上作答无效。考试结束后,将答题卡交回。
可能用到的相对原子质量:H1 C12 N14 O16 S32 Cl35.5 Si28 F19
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.下列生活中的现象与物质结构关联不正确的是( )
A.烟花的绚丽多彩与电子跃迁有关 B.干冰升华与其分子间作用力弱有关 C.钻石璀璨夺目与其为共价晶体有关 D.金属可加工成各种形状与金属键有关
2.下列元素或化合物的性质变化顺序正确的是( )
A.共价键的极性: B.第一电离能:
C.离子键强度: D.原子半径:
3.下列化学用语或图示表达不正确的是( )
A.基态Cl原子的价电子轨道表示式: B.NaOH的电子式:
C.氨分子的VSEPR模型: D.结构示意图:
4.下列事实与氢键无关的是( )
A.水结成冰体积膨胀,密度变小
B.水加热到很高的温度都难以分解
C.相同条件下,氨比同族其它氢化物在水中的溶解度大
D.对羟基苯甲酸()的熔点比邻羟基苯甲酸()高
5.下列说法正确的是( )
A.分子晶体中都存在共价键
B.含有极性键的化合物分子一定不含非极性键
C.、、、的熔、沸点逐渐升高与范德华力有关
D.只要是离子化合物,其熔点一定比共价化合物的熔点高
6.下列说法①和②均正确,但是说法①不能正确解释说法②的是( )
选项 说法① 说法②
A 非金属性: 酸性:
B 分子间作用力: 沸点:
C 键能: 稳定性:
D 电负性: 共价键极性:
7.由短周期主族元素W、X、Y、Z构成的一种阴离子,结构如图所示,W、X、Y、Z的原子序数依次增大,Z元素无正化合价。下列说法正确的是( )
A.X与Y的简单氢化物沸点: B.原子半径大小关系是:
C.该阴离子中键与键数之比为5:2 D.该阴离子中各原子均满足8电子稳定结构
8.下列化学实验中的操作、现象及解释有正确对应关系的是( )
选项 操作 现象 解释
A 向蓝色的稀溶液中加入食盐 溶液由蓝色变为绿色 颜色变化与、相对量多少有关
B 向溶液中加入KSCN溶液 溶液变为红色 生成红色的离子化合物
C 用毛皮摩擦过的带电橡胶棒靠近液流 液流方向不改变 中不含非极性键
D 向溶液里逐滴加入氨水至过量 先形成蓝色沉淀,后溶解得到深蓝色溶液 沉淀溶解时主要反应:
9.科学家对嫦娥五号带回的月球土壤进行分析,发现含有X、Y、Z、V、W五种原子序数依次增大的前20号元素,X原子的最外层电子数是其电子总数的,V的单质常在地球火山口附近沉积,Y属于s区元素,且其原子中没有单电子,Y、W原子的最外层电子数相等且之和等于Z原子的最外层电子数,下列说法正确的是( )
A.Y的氧化物是两性氧化物 B.简单氢化物分子中共价键键能:
C.简单离子半径: D.X、Z形成的化合物属于分子晶体
10.结合下表中数据,判断下列说法不正确的是( )(氢键键长定义为的长度)
微粒间作用 键能 键长/pm
晶体中 452 162
晶体Si中 222 235
中 463 96
中 18.8 276
(乙醇)中 25.9 266
A.依据键长:,推测原子半径:
B.依据键能:,推测沸点:
C.依据键长,推测水分子间距离大于分子内键长
D.依据氢键键能及沸点,推测等物质的量水或乙醇中,水中氢键数目多
11.主族元素W、X、Y、Z的原子序数依次增大,且均不大于20,Y原子的未成对电子数与电子层数相同,W与Y原子的最外层电子数之和等于X原子的最外层电子数。这四种元素形成的一种食品添加剂的结构如图所示。下列说法正确的是( )
A.电负性:
B.X与Y形成的化合物属于离子晶体
C.W与Z形成的化合物中既含有离子键又含有共价键
D.X形成的简单氢化物的沸点和热稳定性均是同族氢化物中最高的
12.标准状态下,下列物质气态时的相对能量如下表:
物质(g) O H HO HOO
相对能量 249 218 39 10 0 0 -136 -242
可根据,计算出中氧氧单键的键能为。下列说法不正确的是( )
A.中键的键能为
B.中氧氧键的键能大于中氧氧单键的键能的两倍
C.解离氧氧单键所需能量:
D.
13.我国科研人员提出了由小分子X、Y转化为高附加值产品M的催化反应历程。该历程可用示意图表示如下,下列说法不正确的是( )
A.①→②过程属于放热反应
B.由X、Y生成M的总反应原子利用率为100%
C.反应过程中有键的断裂和键、键的生成
D.X的键角为,Y的结构式为、M为乙醇()
14.某同学进行如下实验:
①分别向溶液和溶液中滴加KSCN溶液,均无明显现象。
②向和的混合液中滴加KSCN溶液,溶液立刻变红,振荡后,红色褪去,产生白色沉淀,继续滴加过量KSCN溶液,红色不再褪去,并产生大量白色沉淀。
③过滤②中白色沉淀并洗涤干净,向其中加入过量氨水,白色沉淀溶解得无色溶液,放置过程中,无色溶液变蓝色。
已知:CuSCN为白色、难溶性物质:为无色离子。
下列说法不正确的是( )
A.实验①说明不能与反应生成CuSCN
B.实验②中红色褪去的原因是振荡后降低
C.实验③中无色溶液变蓝色的原因是:
D.依据实验①、②、③推测,②中由于生成CuSCN,使氧化性增强,将氧化为
第二部分
本部分共5题,共58分。请将答案填写在答题纸上,在试卷上作答无效。
15.(9分)黄铜矿是主要的炼铜原料,其中铜元素的主要存在形式是,含有和。
(1)基态的价层轨道表示式为________。
(2)在较低温度下与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的中心原子杂化方式为________,属于________(填“极性”或“非极性”)分子。
②X与水相比,二者中沸点较低的化合物的电子式为________。
(3)与氧气反应生成,中心原子的价层电子对数为________;从电子云重叠方式看,分子中所含的共价键类型有________。
(4)用配位浸出法炼铜时,可用氨水将中的铜元素浸出,溶液变蓝,同时生成和含有+6价硫元素的微粒,该过程中发生反应的离子方程式为________。
16.(10分)钴()元素容易形成配合物,其常见+2、+3价。
(1)已知配合物的磁矩(n表示中心原子或离子的未成对电子数)。某含钴配离子结构如图所示[所带电荷数目及符号未标出,乙二胺()为电中性配体],若测得其,则该离子所带电荷数目及符号为________。
(2)中子衍射实验证实,晶体中仅存在3种离子(不存在分子):、和上述含钴配离子。该晶体中存在的化学键类型有________;含钴配离子中提供孤电子对的原子是________,配位数是________;是________(填离子符号)。
(3)乙二胺()与正丁烷()的相对分子质量相近,乙二胺沸点比正丁烷高的原因是________。
(4)钴酸锂()是常见的锂离子电池正极材料,其晶胞结构如图所示。晶体中O围绕Co形成八面体,八面体共棱形成层状空间结构,与层交替排列。该晶胞中O的个数为________;充电过程中晶胞高度c变大,原因是会从八面体层间脱出,导致________。
17.(10分)氢能源是一种不依赖化石燃料的储量丰富的清洁能源。
(1)化石燃料中天然气的主要成分是甲烷,甲烷的结构式为________。
(2)我国科学家研发了以负载氧化镍纳米晶粒的聚合物氮化碳二维纳米材料为催化剂的高效电解水制氢技术。
①Ni元素的原子序数为________。
②C、N、O的电负性的由大到小的顺序是________。
③为寻找更多的金属催化剂,科学家从众多金属元素中选取Co、Fe、Cu进行了相关研究,并取得了成功。选取这三种金属进行相关研究的原因可能是________。
(3)开发新型储氢材料是氢能利用的重要研究方向。氨硼烷()是一种潜在的储氢材料,可由(结构为平面六元环状)通过如下反应制得:
①从分子结构解释、、的键角依次减小的原因________。
②中N原子的杂化方式为________。
③中N、B都达到稳定结构,的结构式为(用→表示出配位键)________。
(4)有储氢功能的铜银合金晶体具有立方堆积结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子位于由Cu原子与Ag原子构成的全部四面体中。
①该晶体储氢后的化学式为________。
②已知:;表示阿伏加德罗常数的值。若该立方晶胞的边长为a pm,忽略吸氢前后晶胞的体积变化,标准状况下氢气的密度为,则该储氢材料的储氢能力为________(用含有a、b和的代数式表示)。
18.(15分)主族元素N、Si、F、Cl、Se、Ca等的某些化合物对工农业生产意义重大。
(1)陶瓷具有硬度大、强度高、耐高温等性质,其晶体类型为________。
(2)的熔、沸点低于,原因是________。
(3)硒元素位于元素周期表中________(选填s、p、d、f、ds)区,基态硒原子核外电子云轮廓图呈球形、哑铃形的能级上电子数之比为________。
(4)的中心原子杂化方式为________,的空间构型是________,与互为等电子体的微粒有________(写一种微粒即可)。
(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为________;以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,将原子位置的坐标表示为晶胞棱长的分数,称作原子的分数坐标。ZnSe晶胞中部分原子的分数坐标:A点为、B点为,则C点原子的分数坐标为________。
(6)已知:称为羟基,无机含氧酸()分子结构中含有羟基,如果成酸元素R相同,含氧酸分子中非羟基氧个数越多,R的正电性越高,导致中的O的电子向R偏移,键极性增强,因而在水分子的作用下,也就越容易电离出,即酸性越强。也就是说,无机含氧酸的酸性随着分子中连接在中心原子R上的非羟基氧的个数增多而增强。
亚磷酸()为弱酸,分子结构中含有一个非羟基氧,其酸性比HClO的酸性________(填“强”或“弱”),与过量NaOH溶液反应的离子方程式为________。
(7)萤石()是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是________,若该立方晶胞参数为a cm,阴、阳离子的核间距最小为________cm。
19.(14分)大力推广太阳能和新型化学电池的使用,有助于实现碳减排、碳中和的目标。
(1)太阳能电池板主要材料为单晶硅或多晶硅,硅元素在周期表中的位置是________,与硅同主族的锗元素的基态原子价层电子排布式为________。
(2)分子中Si原子的杂化方式为________,分子中价层电子对的数目为________,分子的空间构型为________,
(3)某有机硅化物的结构为:,标号①~④的碳原子中,属于手性碳原子的是________(填标号)。
(4)碳与硅元素同主族,但形成的晶体性质却有所不同。单晶硅不导电,但石墨晶体中存在自由电子、能导电,石墨晶体中存在自由电子的原因是________。
(5)SiC和单晶硅具有相似的晶体结构,但SiC熔点更高,其原因是________。
(6)磷酸铁锂()电池充放电过程中,正极变化的示意图如下:
①的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有的单元数有________个。
②电池充电时,脱出部分,形成,结构示意图如(b)所示,则x=________,。
北京市第十九中学2022-2023学年高一下学期期末考试
参考答案
第一部分
本部分共14题,每题3分,共42分。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 C A D B C A D A B B D C D B
第二部分
本部分共5题,共58分。
15.(9分)
(1)(1分)
(2)①(1分)极性(1分)
②(1分)
(3)3(1分) 键和键(2分)
(4)(2分)
【物质对,但配平错,给1分】
16.(10分)
(1)一个正电荷(或1+、+1)(1分)
(2)离子键、共价键(或配位键)(2分) N、Cl(2分) 6(1分) (1分)
(3)因为乙二胺分子间存在氢键,所以乙二胺的沸点高于正丁烷(1分)
(4)6(1分)
层和层吸引力减弱,层之间的同性排斥使层间距增大(或:相邻的层中同性相斥,使层间距增大)(1分)
17.(10分)
(1)(1分)
(2)①28(1分)②(1分)
③这三种元素都是过渡元素,在元素周期表中位置和Ni相近,可能具有相似的性质(1分)
(3)①中心原子为sp杂化,键角为180度;和中心原子均为杂化,中孤对电子与成键电子对之间的斥力大于中成键电子对之间的斥力,故键角:(2分)【3种物质杂化方式都说明1分,孤对电子1分〗
②(1分)③(1分)
(4)①(1分)②(1分)
18.(15分)
(1)共价晶体(1分)
(2)和是结构相似的分子晶体,的相对分子量大于,分子间作用力大(2分)
【倒扣分,标红的3点,少1点扣1分,扣完为止】
(3)p(1分) 1:2或8:16(1分)
(4)(1分) 三角锥形(1分) 、、等(合理即可得分,1分)
(5)4(1分) (1分)
(6)强(1分) (2分)
(7)(1分) (1分)
19.(14分)
(1)第三周期、ⅣA族(2分) (1分)
(2)(1分) 4(1分) V形(或折线形、角形)(1分)
(3)②(1分)
(4)石墨中每个碳原子均为杂化,通过单键形成平面层状结构,未参与杂化的p电子可在同一层内自由移动(或:未参与杂化的p电子可形成离域键,电子流动性增强)(2分)
【倒扣分,标红的3点,少1点扣1分,扣完为止】,;
(5)同为共价晶体,,键比键更短,键能更大,SiC熔点更高(2分)
【倒扣分,标红的4点,少1点扣1分,扣完为止】
(6)①4(1分) ②(1分) 13:3(1分)
同课章节目录
