2.3化学反应的方向 课件(共36张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.3化学反应的方向 课件(共36张ppt)化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-21 00:00:00 | ||
图片预览










文档简介
(共36张PPT)
第二章·化学反应速率 化学平衡
第三节
化学反应的方向
化学反应的发生有一定的方向性
1.N2(g)+3H2(g) 2NH3(g) △H=-92.4KJ/mol,但是1molN2和3molH2在一定条件下混合,反应后放出热量却少于92.4KJ。说明了化学反应有什么特点?
化学反应的进行有一定的限度
2.碳和氧气燃烧可以得到二氧化碳,而二氧化碳却很难分解成碳和氧.,为什么?又说明了化学反应有怎样的特点?
化学反应原理
化学反应的快慢
——化学反应速率
化学反应的限度
——化学平衡
化学反应的方向
——
目录
化学反应的方向
02
自发过程 非自发过程
01
习
学
目
标
1.知道化学反应是有方向的,知道化学反应的方向与反应的焓变和熵变有关。
2.能结合具体事例说明反应自发进行的方向。
3.构建化学反应自发性判断的思维模型,发展证据推理与模型认知的学科核心素养。
NO.1
自发过程 非自发过程
自然界有一些过程是自发进行的,而且是有方向性的。
过程1:水的流动
飞流直下:不借助外力
抽水上山:借助水泵,持续消耗电能
高处
低处
自发
非自发
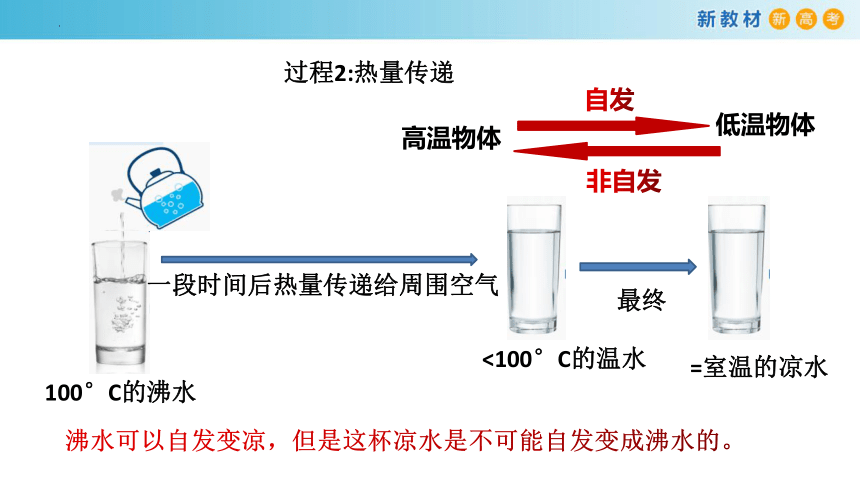
过程2:热量传递
100°C的沸水
一段时间后热量传递给周围空气
<100°C的温水
最终
=室温的凉水
沸水可以自发变凉,但是这杯凉水是不可能自发变成沸水的。
高温物体
低温物体
自发
非自发
过程3:氢气燃烧
氢气的燃烧
自发
水的电解
2H2+O2=2H2O
非自发
①在一定条件下,如果一个过程是自发的,那么它的逆过程通常是非自发的
过程4:钢铁生锈
自发
非自发
钢铁生锈也是
自发反应,但
是速率很慢。
过程5:冬天水结冰自发
过程6:春天冰融水自发
③“自发”是一定条件下的自发,条件变了,可能由原来的“自发”变成“非自发”
过程7:墨滴在水中扩散
过程8:暖炉取暖
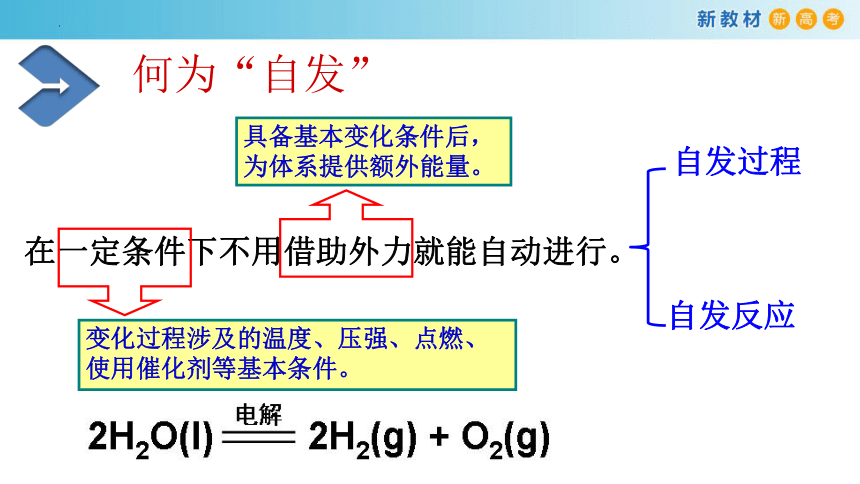
在一定条件下不用借助外力就能自动进行。
何为“自发”
变化过程涉及的温度、压强、点燃、
使用催化剂等基本条件。
具备基本变化条件后,
为体系提供额外能量。
自发过程
自发反应
水往低处流
——能量高到低
室温下冰会自发融化
——有序排列变无序运动
从本质上认识自发过程(从现象到本质)
有些化学反应也是自发进行的,而且具有方向性。
如何判断化学反应自发进行的方向呢
NO.2
化学反应的方向
与自然界中的许多变化一样,化学反应也具有方向性。
如: 化学反应中酸碱中和、铁器暴露在潮湿空气中生锈、甲烷和氧气的混合气体遇明火就燃烧、锌与CuSO4溶液反应生成Cu和ZnSO4等。
这些过程都是自发的,其逆过程就是非自发的.
问题一:什么是自发反应?
自发反应:在一定条件(温度、压强)下不需外界(光、电能)帮助,就能自动进行的反应。
①一般来说,正反应是自发,则逆反应是非自发。
水从高处到低处可以用来发电
氢气燃烧可以设计成原电池
②“自发”只是有发生的趋势,并不代表实际发生,更不能确定发生的速率。
“非自发”也不代表不能发生。
③“自发”是一定条件下的自发,条件变了,可能由原来的“自发”变成“非自发”
寻找反应能否自发进行的判据
思考与讨论1:
准确判断一个过程、一个反应能否自发进行的依据是什么?
水 流
电 流
热 量
自发
高处
低处
自发
高电位
低电位
自发
高温
低温
问题二:如何判断自发反应?
反应物的总能量高
生成物的总能量低
放热反应
H<0
总结感悟
思考与讨论2:下列反应在一定条件下都能自发进行,你知道这些反应能自发进行的原因吗?
① C3H8(g) +5 O2(g) = 3CO2(g) + 4H2O(l) △H=-2217.5kJ/mol
② 2Na(s)+Cl2(g)=2NaCl(s) △H=-882kJ/mol
③ C(s)+ O2(g)=CO2 (g) △H =-393.5kJ/mol
④ H2 (g) +F2(g) = 2HF(g) △H =-546.6kJ/mol
共同特点
总结:放热反应使体系能量降低,能量越低越稳定,△H < O 有利于反应自发进行
△H<0,放热反应。
即体系趋向于从高能状态转变为低能状态(稳定)
小结:自然之法如此神奇,正是很多燃烧反应会遇到“活化能”的壁垒。才使得富含有机物的生命体在富含氧气的大气中没有“自燃”。
思考与讨论3:对以上反应中的③,即碳燃烧,有同学提出这个过程不能自发,因为需要点燃,你怎么看?
因为燃烧反应存在“障碍”——活化能,“点燃”的目的是克服反应的活化能,“启动”反应,使之发生。因为反应放出的热量|△H|>Ea。使得放出的热量足以克服后续反应的活化能,因此在反应引发后,不用持续加热,也能自发进行下去。
1.焓判据(能量判据)
:体系趋向于从能量高的状态转变为能量低的状态,
因此反应放热有利于反应自发进行。
思考与讨论4:为什么有些放热反应需要持续加热呢?
例如:H2(g)+CuO(s)=Cu(s)+H2O(1) △H=-128.5KJ/mol
因为此反应所需活化能很大,而反应放出的热量太少,即|△H|2NH4Cl(s)+Ba(OH)2·8 H2O(s)=NH3(g)+BaCl2(s)+10H2O(l)
2N2O5(g)=4NO2(g)+O2 (g)
(NH4) 2CO3(s) = NH4HCO3(s)+NH3(g)
H ﹥ 0
思考与讨论5:在19世纪,一些化学家认为,决定反应能否自发进行的因素是反应热,放热反应可以自发进行,而吸热反应不能自发进行。吸热反应都不能自发进行吗?
该反应是吸热反应,但在常温下能自发进行
人们经过大量反应焓变的研究表明,大多数能自发进行的反应是放热反应。但是,有些吸热反应也能自发。因此,不能仅仅依靠焓变来判断反应是否自发。
反应放热有利于反应自发进行,但只根据反应的焓变来判断化学反应的方向是不全面的。
结论: 反应的焓变是制约化学反应能否自发进行的因素之一,但不是唯一的因素。
①NH4NO3(s) = NH4+ (aq) +NO3- (aq)
② CaCO3(s) =CaO (s) +CO2 (g)
③N2O4(g)=2NO2(g)
④CuSO4·5H2O(s) = CuSO4(s) +5H2O(l)
⑤Ba(OH)2·8H2O(s)+2NH4Cl(s) = BaCl2(s)+2NH3(g)+10H2O(l)
不自由变自由(有序变无序)
固体变气体
气体少变成气体多
固体变液体
固体变液体和气体
共同点:生成物微粒的活动范围变大,活动范围大的微粒增多。
——即体系的混乱度增大。
结论:除热效应(焓变)外,决定化学反应能否自发进行的另一个因素是体系的混乱度,且大多数自发反应有趋向于体系混乱度增大的倾向。
寻找根源
问题三:吸热反应为什么能自发进行?
思考与讨论6:下列现象哪个混乱度大?哪个更有序?在化学上如果描述混乱度的?
有序排列的火柴散落时自发地成为无序排列
整理好的房间一段时间后总是会变得杂乱无章
S(水) :69.9 J·mol-1·K-1
S(冰) :47.9 J·mol-1·K-1
S(水蒸气):188.7 J·mol-1·K-1
同一物质:S(g)>S(l)>S(s)。
通常情况下,气体分子数增大的化学反应为熵增的反应。
想一想:同一物质不同状态下熵值相等吗?
总结感悟
熵:用来衡量体系混乱(无序)程度的物理量,用S表示。
体系越混乱(无序),熵值越大,单位是J.mol-1.K-1。
熵变(△S):
△S=S(产物)-S(反应物)
△S>0,熵增反应
△S<0,熵减反应
思考与讨论7:对比下列过程,是熵增过程容易自发,还是熵减过程容易自发?
越是有序的状态,越是难以维持
结论:密闭条件下,体系有从有序自发的转变为无序的倾向。
即△S>0有利于反应自发进行,也叫熵增原理,这就是熵判据
①同一物质在不同状态下熵值不同,一般规律是:
S(g)>S(l)>S(s); S(高温)> S(低温); S(低压)> S(高压)
②在化学反应中,气态物质的系数增大,则熵增大。反之,则熵减小
2.熵判据(混乱度判据)
体系趋向于从有序状态转变为无序状态,
因此熵增反应(△S>0 )具有自发进行的倾向 。
1.在下列变化中,体系的熵将发生怎样的变化?
A.少量的食盐溶解于水中
B.气态水变成液态水
C. 2Na2SO3(s)+O2(g)===2Na2SO4(s)
D.CaCO3(s)受热分解为CaO(s)和CO2(g)
E. HCl(g) + NH3(g) = NH4Cl (s)
ΔS<0
ΔS>0
ΔS<0
ΔS<0
ΔS>0
2.下列反应中,熵显著增加的反应是( )
A.CO(g)+2H2(g)===CH3OH(g)
B.3NO2(g)+H2O(l)===2HNO3(aq)+NO(g)
C.2C(s)+O2(g) === 2CO (g)
D.2Hg(l)+O2(g)===2HgO(s)
C
2NH4Cl(s)+Ba(OH)2·8 H2O(s)=NH3(g)+BaCl2(s)+10H2O(l)
2N2O5(g)=4NO2(g)+O2 (g)
(NH4) 2CO3(s) = NH4HCO3(s)+NH3(g)
想一想:下列吸热反应为什么能自发进行?有什么共同点?
上述反应过程中气体分子数增大,反应的熵值增大。
S ﹥ 0
交流讨论
思考与讨论8:所有自发进行的化学反应都是熵增的?
2H2(g)+O2(g)= 2H2O(l) △S<0
NH3(g)+HCl(g)= NH4Cl(s) △S<0
都可自发进行
结论;熵增加(ΔS>0)有利于化学反应的自发进行,但不全面。
想一想:自发反应一定是熵增加的反应吗?
2H2(g)+O2(g)=2H2O(l) S﹤0
推论: 熵增有利于反应自发进行,
但只根据熵变判断化学反应的方向是不全面的。
结论: 自发反应的方向与焓变、熵变有关,判断反应自发进行的方向,需综合考虑体系的焓变和熵变。
交流讨论
√
X
2KClO3(s)==2KCl(s)+3O2(g)
H = -78.03 kJ·mol-1 S = +494.4 J·mol-1·K-1
CO(g)==C(s,石墨)+1/2O2(g)
H =+110.5 kJ·mol-1 S = -89.36 J·mol-1·K-1
判断下列反应能否自发进行
4Fe(OH)2(s)+2H2O(l)+O2(g)==4Fe(OH)3(s)
H = -444.3kJ·mol-1 S = -280.1 J·mol-1·K-1
CaCO3(s)= CaO(s)+ CO2(g)
H = + 178.2 kJ·mol-1 S = +169.6 J·mol-1·K-1
√
X
利用熵变和焓变对自发反应方向性的判断不一致时,怎么办?
√
X
√
X
1876年,吉布斯(美)提出自由能变化 ΔG,并认为化学反应总是向着自由能减小( ΔG < 0)的方向进行,直至达到平衡。
在恒温、恒容的封闭体系中,
G = H – T S (T为热力学温度,为正值)
寻找全面的判据
室温 冰融化
-10 ℃ 水结冰
H2O(s) = H2O (l) △H >0 △S>0
H2O(l) = H2O (s) △H <0 △S<0
3. 复合判据(焓与熵复合判据:ΔG=ΔH-TΔS )
复合判据:自由能ΔG=ΔH-TΔS ,化学反应总是向着自由能减小的方向进行,直到达到平衡。
当ΔG<0, 反应能自发进行;
当ΔG=0,反应处于平衡状态;
当ΔG>0, 反应不能自发进行。
反应在该状况下能否自发进行
<0 >0
>0 <0
>0 >0
<0 <0
H
S
G
<0
>0
低温时>0,高温时<0
低温时<0,高温时>0
自发进行
不自发进行
低温不自发,高温自发
低温自发,高温不自发
△S
△H
H<0
S>0
所有温度下
反应自发进行
H>0
S>0
高温下
反应自发进行
H<0
S<0
低温下
反应自发进行
H<0 , S<0
所有温度下
反应不能自发进行
拓展:
过程的自发性只能用于判断过程的方向,不能确定过程是否一定会发生和过程发生的速率。例如:金刚石有向石墨转化的倾向,但是能否发生,什么时候发生,多快才能完成,就不是能量判据和熵判据能解决的问题了。再如涂有防锈漆和未涂防锈漆的钢制器件,其发生腐蚀过程的自发性是相同的,但只有后者可以实现。
化学反应进行的方向
复合判据
熵判据
焓判据
课堂小结
第二章·化学反应速率 化学平衡
第三节
化学反应的方向
化学反应的发生有一定的方向性
1.N2(g)+3H2(g) 2NH3(g) △H=-92.4KJ/mol,但是1molN2和3molH2在一定条件下混合,反应后放出热量却少于92.4KJ。说明了化学反应有什么特点?
化学反应的进行有一定的限度
2.碳和氧气燃烧可以得到二氧化碳,而二氧化碳却很难分解成碳和氧.,为什么?又说明了化学反应有怎样的特点?
化学反应原理
化学反应的快慢
——化学反应速率
化学反应的限度
——化学平衡
化学反应的方向
——
目录
化学反应的方向
02
自发过程 非自发过程
01
习
学
目
标
1.知道化学反应是有方向的,知道化学反应的方向与反应的焓变和熵变有关。
2.能结合具体事例说明反应自发进行的方向。
3.构建化学反应自发性判断的思维模型,发展证据推理与模型认知的学科核心素养。
NO.1
自发过程 非自发过程
自然界有一些过程是自发进行的,而且是有方向性的。
过程1:水的流动
飞流直下:不借助外力
抽水上山:借助水泵,持续消耗电能
高处
低处
自发
非自发
过程2:热量传递
100°C的沸水
一段时间后热量传递给周围空气
<100°C的温水
最终
=室温的凉水
沸水可以自发变凉,但是这杯凉水是不可能自发变成沸水的。
高温物体
低温物体
自发
非自发
过程3:氢气燃烧
氢气的燃烧
自发
水的电解
2H2+O2=2H2O
非自发
①在一定条件下,如果一个过程是自发的,那么它的逆过程通常是非自发的
过程4:钢铁生锈
自发
非自发
钢铁生锈也是
自发反应,但
是速率很慢。
过程5:冬天水结冰自发
过程6:春天冰融水自发
③“自发”是一定条件下的自发,条件变了,可能由原来的“自发”变成“非自发”
过程7:墨滴在水中扩散
过程8:暖炉取暖
在一定条件下不用借助外力就能自动进行。
何为“自发”
变化过程涉及的温度、压强、点燃、
使用催化剂等基本条件。
具备基本变化条件后,
为体系提供额外能量。
自发过程
自发反应
水往低处流
——能量高到低
室温下冰会自发融化
——有序排列变无序运动
从本质上认识自发过程(从现象到本质)
有些化学反应也是自发进行的,而且具有方向性。
如何判断化学反应自发进行的方向呢
NO.2
化学反应的方向
与自然界中的许多变化一样,化学反应也具有方向性。
如: 化学反应中酸碱中和、铁器暴露在潮湿空气中生锈、甲烷和氧气的混合气体遇明火就燃烧、锌与CuSO4溶液反应生成Cu和ZnSO4等。
这些过程都是自发的,其逆过程就是非自发的.
问题一:什么是自发反应?
自发反应:在一定条件(温度、压强)下不需外界(光、电能)帮助,就能自动进行的反应。
①一般来说,正反应是自发,则逆反应是非自发。
水从高处到低处可以用来发电
氢气燃烧可以设计成原电池
②“自发”只是有发生的趋势,并不代表实际发生,更不能确定发生的速率。
“非自发”也不代表不能发生。
③“自发”是一定条件下的自发,条件变了,可能由原来的“自发”变成“非自发”
寻找反应能否自发进行的判据
思考与讨论1:
准确判断一个过程、一个反应能否自发进行的依据是什么?
水 流
电 流
热 量
自发
高处
低处
自发
高电位
低电位
自发
高温
低温
问题二:如何判断自发反应?
反应物的总能量高
生成物的总能量低
放热反应
H<0
总结感悟
思考与讨论2:下列反应在一定条件下都能自发进行,你知道这些反应能自发进行的原因吗?
① C3H8(g) +5 O2(g) = 3CO2(g) + 4H2O(l) △H=-2217.5kJ/mol
② 2Na(s)+Cl2(g)=2NaCl(s) △H=-882kJ/mol
③ C(s)+ O2(g)=CO2 (g) △H =-393.5kJ/mol
④ H2 (g) +F2(g) = 2HF(g) △H =-546.6kJ/mol
共同特点
总结:放热反应使体系能量降低,能量越低越稳定,△H < O 有利于反应自发进行
△H<0,放热反应。
即体系趋向于从高能状态转变为低能状态(稳定)
小结:自然之法如此神奇,正是很多燃烧反应会遇到“活化能”的壁垒。才使得富含有机物的生命体在富含氧气的大气中没有“自燃”。
思考与讨论3:对以上反应中的③,即碳燃烧,有同学提出这个过程不能自发,因为需要点燃,你怎么看?
因为燃烧反应存在“障碍”——活化能,“点燃”的目的是克服反应的活化能,“启动”反应,使之发生。因为反应放出的热量|△H|>Ea。使得放出的热量足以克服后续反应的活化能,因此在反应引发后,不用持续加热,也能自发进行下去。
1.焓判据(能量判据)
:体系趋向于从能量高的状态转变为能量低的状态,
因此反应放热有利于反应自发进行。
思考与讨论4:为什么有些放热反应需要持续加热呢?
例如:H2(g)+CuO(s)=Cu(s)+H2O(1) △H=-128.5KJ/mol
因为此反应所需活化能很大,而反应放出的热量太少,即|△H|
2N2O5(g)=4NO2(g)+O2 (g)
(NH4) 2CO3(s) = NH4HCO3(s)+NH3(g)
H ﹥ 0
思考与讨论5:在19世纪,一些化学家认为,决定反应能否自发进行的因素是反应热,放热反应可以自发进行,而吸热反应不能自发进行。吸热反应都不能自发进行吗?
该反应是吸热反应,但在常温下能自发进行
人们经过大量反应焓变的研究表明,大多数能自发进行的反应是放热反应。但是,有些吸热反应也能自发。因此,不能仅仅依靠焓变来判断反应是否自发。
反应放热有利于反应自发进行,但只根据反应的焓变来判断化学反应的方向是不全面的。
结论: 反应的焓变是制约化学反应能否自发进行的因素之一,但不是唯一的因素。
①NH4NO3(s) = NH4+ (aq) +NO3- (aq)
② CaCO3(s) =CaO (s) +CO2 (g)
③N2O4(g)=2NO2(g)
④CuSO4·5H2O(s) = CuSO4(s) +5H2O(l)
⑤Ba(OH)2·8H2O(s)+2NH4Cl(s) = BaCl2(s)+2NH3(g)+10H2O(l)
不自由变自由(有序变无序)
固体变气体
气体少变成气体多
固体变液体
固体变液体和气体
共同点:生成物微粒的活动范围变大,活动范围大的微粒增多。
——即体系的混乱度增大。
结论:除热效应(焓变)外,决定化学反应能否自发进行的另一个因素是体系的混乱度,且大多数自发反应有趋向于体系混乱度增大的倾向。
寻找根源
问题三:吸热反应为什么能自发进行?
思考与讨论6:下列现象哪个混乱度大?哪个更有序?在化学上如果描述混乱度的?
有序排列的火柴散落时自发地成为无序排列
整理好的房间一段时间后总是会变得杂乱无章
S(水) :69.9 J·mol-1·K-1
S(冰) :47.9 J·mol-1·K-1
S(水蒸气):188.7 J·mol-1·K-1
同一物质:S(g)>S(l)>S(s)。
通常情况下,气体分子数增大的化学反应为熵增的反应。
想一想:同一物质不同状态下熵值相等吗?
总结感悟
熵:用来衡量体系混乱(无序)程度的物理量,用S表示。
体系越混乱(无序),熵值越大,单位是J.mol-1.K-1。
熵变(△S):
△S=S(产物)-S(反应物)
△S>0,熵增反应
△S<0,熵减反应
思考与讨论7:对比下列过程,是熵增过程容易自发,还是熵减过程容易自发?
越是有序的状态,越是难以维持
结论:密闭条件下,体系有从有序自发的转变为无序的倾向。
即△S>0有利于反应自发进行,也叫熵增原理,这就是熵判据
①同一物质在不同状态下熵值不同,一般规律是:
S(g)>S(l)>S(s); S(高温)> S(低温); S(低压)> S(高压)
②在化学反应中,气态物质的系数增大,则熵增大。反之,则熵减小
2.熵判据(混乱度判据)
体系趋向于从有序状态转变为无序状态,
因此熵增反应(△S>0 )具有自发进行的倾向 。
1.在下列变化中,体系的熵将发生怎样的变化?
A.少量的食盐溶解于水中
B.气态水变成液态水
C. 2Na2SO3(s)+O2(g)===2Na2SO4(s)
D.CaCO3(s)受热分解为CaO(s)和CO2(g)
E. HCl(g) + NH3(g) = NH4Cl (s)
ΔS<0
ΔS>0
ΔS<0
ΔS<0
ΔS>0
2.下列反应中,熵显著增加的反应是( )
A.CO(g)+2H2(g)===CH3OH(g)
B.3NO2(g)+H2O(l)===2HNO3(aq)+NO(g)
C.2C(s)+O2(g) === 2CO (g)
D.2Hg(l)+O2(g)===2HgO(s)
C
2NH4Cl(s)+Ba(OH)2·8 H2O(s)=NH3(g)+BaCl2(s)+10H2O(l)
2N2O5(g)=4NO2(g)+O2 (g)
(NH4) 2CO3(s) = NH4HCO3(s)+NH3(g)
想一想:下列吸热反应为什么能自发进行?有什么共同点?
上述反应过程中气体分子数增大,反应的熵值增大。
S ﹥ 0
交流讨论
思考与讨论8:所有自发进行的化学反应都是熵增的?
2H2(g)+O2(g)= 2H2O(l) △S<0
NH3(g)+HCl(g)= NH4Cl(s) △S<0
都可自发进行
结论;熵增加(ΔS>0)有利于化学反应的自发进行,但不全面。
想一想:自发反应一定是熵增加的反应吗?
2H2(g)+O2(g)=2H2O(l) S﹤0
推论: 熵增有利于反应自发进行,
但只根据熵变判断化学反应的方向是不全面的。
结论: 自发反应的方向与焓变、熵变有关,判断反应自发进行的方向,需综合考虑体系的焓变和熵变。
交流讨论
√
X
2KClO3(s)==2KCl(s)+3O2(g)
H = -78.03 kJ·mol-1 S = +494.4 J·mol-1·K-1
CO(g)==C(s,石墨)+1/2O2(g)
H =+110.5 kJ·mol-1 S = -89.36 J·mol-1·K-1
判断下列反应能否自发进行
4Fe(OH)2(s)+2H2O(l)+O2(g)==4Fe(OH)3(s)
H = -444.3kJ·mol-1 S = -280.1 J·mol-1·K-1
CaCO3(s)= CaO(s)+ CO2(g)
H = + 178.2 kJ·mol-1 S = +169.6 J·mol-1·K-1
√
X
利用熵变和焓变对自发反应方向性的判断不一致时,怎么办?
√
X
√
X
1876年,吉布斯(美)提出自由能变化 ΔG,并认为化学反应总是向着自由能减小( ΔG < 0)的方向进行,直至达到平衡。
在恒温、恒容的封闭体系中,
G = H – T S (T为热力学温度,为正值)
寻找全面的判据
室温 冰融化
-10 ℃ 水结冰
H2O(s) = H2O (l) △H >0 △S>0
H2O(l) = H2O (s) △H <0 △S<0
3. 复合判据(焓与熵复合判据:ΔG=ΔH-TΔS )
复合判据:自由能ΔG=ΔH-TΔS ,化学反应总是向着自由能减小的方向进行,直到达到平衡。
当ΔG<0, 反应能自发进行;
当ΔG=0,反应处于平衡状态;
当ΔG>0, 反应不能自发进行。
反应在该状况下能否自发进行
<0 >0
>0 <0
>0 >0
<0 <0
H
S
G
<0
>0
低温时>0,高温时<0
低温时<0,高温时>0
自发进行
不自发进行
低温不自发,高温自发
低温自发,高温不自发
△S
△H
H<0
S>0
所有温度下
反应自发进行
H>0
S>0
高温下
反应自发进行
H<0
S<0
低温下
反应自发进行
H<0 , S<0
所有温度下
反应不能自发进行
拓展:
过程的自发性只能用于判断过程的方向,不能确定过程是否一定会发生和过程发生的速率。例如:金刚石有向石墨转化的倾向,但是能否发生,什么时候发生,多快才能完成,就不是能量判据和熵判据能解决的问题了。再如涂有防锈漆和未涂防锈漆的钢制器件,其发生腐蚀过程的自发性是相同的,但只有后者可以实现。
化学反应进行的方向
复合判据
熵判据
焓判据
课堂小结
