江苏省扬州市江都区2022-2023学年高二下学期期末考试化学试题(含答案)
文档属性
| 名称 | 江苏省扬州市江都区2022-2023学年高二下学期期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-21 14:19:41 | ||
图片预览




文档简介
扬州市江都区2022-2023学年高二下学期期末考试
化学试题
可能用到的相对原子质量:
一、单项选择题:共13题,每题3分,共39分.每题只有一个选项最符合题意.
1.材料与生产、生活密不可分.下列材料说法正确的是( )
A.太阳能电池中的二氧化硅——半导体材料
B.外层的热控保温材料石墨烯——有机材料
C.形形色色的玻璃——硅酸盐材料
D.食品包装用的聚氯乙烯——有机高分子材料
2.“侯氏制碱法”曾为全球制碱工业做出了巨大贡献.该工艺反应之一如下:,下列说法正确的是( )
A.均为极性键形成的非极性分子 B.键角:
C.电负性: D.与晶体类型相同
3.铁钾矾是一种重要的化工原料.下列说法正确的是( )
A.分子间存在氢键,所以分子很稳定 B.硫离子的结构示意图:
C.离子半径大小: D.碱性强弱:
阅读下列资料,完成4~6题:
氨是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱、制药等工业;合成氨反应为,以铁触媒(主要成分是和)为催化剂.实验室用加热和固体混合物的方法,或将浓氨水与固体混合来制取少量氨气.工业上可利用氨气等制取硝酸.
4.实验室制取少量并探究其性质.下列装置不能达到实验目的的是( )
A.用装置甲制取 B.用装置乙收集
C.用装置丙检验水溶液呈碱性 D.用装置丁吸收多余的
5.下列说法正确的是( )
A.自然固氮和人工固氮都是将转化为 B.铁在纯氧中燃烧生成
C.常温下可用铁制容器盛装氯水 D.转化为时失去上的电子
6.有关工业合成氨的反应下列有关说法正确的是( )
A.其它条件不变,升高温度,可提高活化分子百分数,加快反应速率
B.反应的(E表示键能)
C.断裂同时有形成,说明达该条件下的平衡状态
D.将氨气液化并移走,可提高原料的平衡转化率及平衡时的反应速率
7.下列物质性质与用途具有对应关系的是( )
A.具有氧化性,可用于纸浆漂白
B.乙二醇水溶液凝固点很低,可用作抗冻剂
C.铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀
D.明矾溶于水并水解形成的胶体有吸附性,可用于消毒杀菌
8.下列化学反应表示正确的是( )
A.向硫酸铜中通入少量氨气:
B.向稀硝酸中加入过量铁粉:
C.已知氨气的燃烧热是:
D.“氯碱工业”阴极的电极反应式:
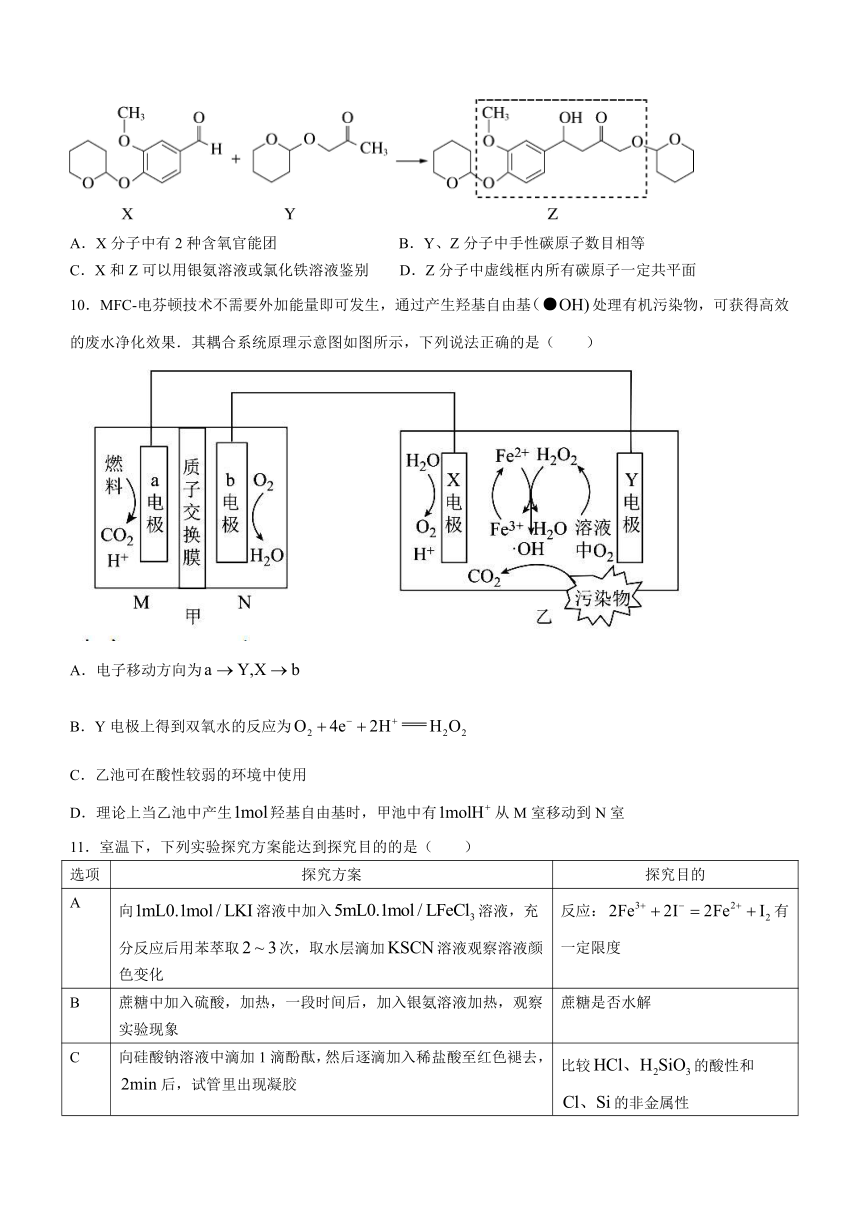
9.可用于治疗阿尔茨海默病,其合成路线如下.下列说法正确的是( )
A.X分子中有2种含氧官能团 B.Y、Z分子中手性碳原子数目相等
C.X和Z可以用银氨溶液或氯化铁溶液鉴别 D.Z分子中虚线框内所有碳原子一定共平面
10.MFC-电芬顿技术不需要外加能量即可发生,通过产生羟基自由基处理有机污染物,可获得高效的废水净化效果.其耦合系统原理示意图如图所示,下列说法正确的是( )
A.电子移动方向为
B.Y电极上得到双氧水的反应为
C.乙池可在酸性较弱的环境中使用
D.理论上当乙池中产生羟基自由基时,甲池中有从M室移动到N室
11.室温下,下列实验探究方案能达到探究目的的是( )
选项 探究方案 探究目的
A 向溶液中加入溶液,充分反应后用苯萃取次,取水层滴加溶液观察溶液颜色变化 反应:有一定限度
B 蔗糖中加入硫酸,加热,一段时间后,加入银氨溶液加热,观察实验现象 蔗糖是否水解
C 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去,后,试管里出现凝胶 比较的酸性和的非金属性
D 向浓度分别为和混合溶液中滴加几滴溶液,出现黄色沉淀
A.A B.B C.C D.D
12.利用烟道气中的生产晶体的工艺流程如下所示.下列说法正确的是( )
A.步骤Ⅰ可得溶液中有
B.步骤Ⅱ中发生的反应为,则的大于的
C.步骤Ⅲ所得溶液中有
D.向饱和溶液中通入的过程,水的电离程度先增大后减小
13.在催化剂作用下,以为原料合成,其主要反应有:
反应1
反应2
将体积比为的混合气体按一定流速通过催化反应管,测得的转化率随温度变化的关系如图所示.
己知的选择性
下列说法正确的是( )
A.图中曲线①表示转化率随温度的变化
B.720~800℃范围内,随温度的升高,出口处的量减少、的量增大
C.720~800℃范围内,随温度的升高,的选择性不断增大
D.其他条件不变,加入或选用高效催化剂,均能提高平衡时产率
二、非选择题,共4小题,61分.
14.(14分)以软锰矿(主要含,还含有和等)为原料经过下列过程可以制得等
(1)酸浸、还原:向软锰矿中加入硫酸、同时加入铁屑,充分反应后,过滤,所得溶液中主要含有和.写出酸浸、还原过程中发生反应的离子方程式:________.的电子排布式为:________,的空间构型为________.
(2)除杂:向酸浸、还原所得滤液中加入固体,调节溶液的,过滤.向已经除去的溶液(约为5)中加入溶液,溶液中的形成氟化物沉淀.
(3)沉锰:向调后所得滤液中加入一定量的氨水,可以得到沉淀.
①其他条件一定,沉锰过程中锰离子的沉淀率与溶液温度的关系如右图所示.50℃后,溶液温度越高,锰离子的沉淀率越低的原因是________.
②沉锰过程中溶液中存在平衡:中含有σ键的________.
(3)氧化:向沉锰所得中加入溶液,可以得到.
(4)制备.在搅拌下向溶液中缓慢滴加溶液,过滤、洗涤、干燥,得到固体,该过程发生的化学方程式为________.
(5)制备:经热解、酸浸等步骤可制备.溶液中加入后立即产生大量气泡,经检测反应过程中有生成,反应前后的质量、化学性质保持不变.该反应过程可描述为________.
15.(15分)丹参醇是存在于中药丹参中的一种天然产物.合成丹参醇的部分路线如下:
已知:
(1)中的杂化的原子个数为________.
(2)的过程:再发生水解反应生成B,R的化学式为,则其结构简式为________.
(3)的反应类型为________.
(4)X的分子式为,写出X的结构简式:________.
(5)A的一种同分异构体Y同时满足下列条件,写出Y的结构简式:________.
①可以和浓溴水发生取代反应,反应时最多消耗
②分子中共有4种不同环境的氢.
(6)写出以和为原料制备的合成路线流程图.
(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干).________
16.(14分)废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧电池的铜帽(总含量约为99%)回收并制备的部分实验过程如下:
(1)铜帽溶解时加入的作用是________.
(2)为确定加入锌灰(主要成分为,杂质为铁及其氧化物)的量,实验中需测定除去后溶液中的物质的量浓度.实验操作为:准确量取的含有的溶液于带塞锥形瓶中,加水稀释至,调节溶液,加入过量的,用标准溶液滴定至终点,消耗的溶液.上述过程中反应的离子方程式如下:(白色) (未配平)
①计算除去后溶液中的物质的量浓度,写出计算过程.________
②滴定选用的指示剂为________,滴定终点判断________.
(3)己知时能溶于溶液生成.下表列出了几种离子生成氢氧化物沉淀的(开始沉淀的按金属离子浓度为计算,金属阳离子沉淀完全时离子的物质的量浓度).
①在答题卡上将表格中的数据补充完整
开始沉淀的 沉淀完全的
1.1 3.1
________ 8.8
5.9 8.9
②由除去铜的滤液制备的实验步骤依次为:________过滤、洗涤、干燥、900℃煅烧.
(实验中可选用的试剂:.)
17.(18分)氨气在工农业生产中有着重要的用途,研究合成氨反应具有重要意义.
(1)直接常压电化学合成氨以纳米作催化剂,和为原料制备.其工作原理如题17图-1所示:
①阴极的电极反应式为________.
②电解过程中,由于发生副反应,使得阴极制得的中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是________.
(2)一定条件下,哈伯-博施合成氨反应历程中的能量变化如题17图-2所示.合成氨反应的热化学方程式为________.生成的历程中,速率最慢的反应的化学方程式为________.
(3)催化释氢可提供哈伯-博施合成氨反应所需的.在催化剂作用下,与水反应生成,可能的反应机理如题17图-3所示.
①其他条件不变时,以代替催化释氢,所得气体的分子式为________.
②已知:为一元弱酸,水溶液呈酸性的原因是________(用离子方程式表示).
③在催化剂的作用下,与水反应.释氢体积及温度随反应时间的变化如题17图-4所示.内,温度随时间快速升高的原因是________.后,氢气体积在增加,面温度却下降的原因是________.
参考答案
单项选择题(39分)
1.C 2.C 3.C 4.D 5.D 6.A 7.B 8.B 9.A 10.A 11.D 12.B 13.A
14.(14分)(1)(3分)
(1分) 正四面体(1分)
(3)①.温度升高,氨水发生分解并挥发(2分) ②(2分)
(4)(3分)
(5)与反应生成了和再分解生成了和或(2分)
15、(15分)(1)(2分) (2)(2分) (3)消去反应(1分)
(4)(2分) (5)(3分) (6)略(5分)
16.(14分)(1)氧化剂(1分) (2)①略(共3分) ②淀粉溶液(1分)
当最后半滴标准溶液滴入时,锥形瓶中的溶液恰好由蓝色变为无色,且半分钟内不变色(2分)
(3)①(2分)
开始沉淀的 沉淀完全的
1.1 3.1
6.8 8.8
5.9 8.9
②向滤液中加入适量,使其充分反应,(1分)向其中滴加,调节溶液约为5(或),过滤;(2分)向滤液中滴加,调节溶液约为10(或)(2分).(共5分)
17、(18分)(1)①(3分) ②(0.5,0.75)(2分)
(2)(2分) (2分)
(3)①(2分) ②(3分)
③与水反应放热,随着时间推移,体系温度升高反应速率增大,温度升高催化剂的活性增强产生氢气速率达到最大.(2分)(只答“温度升高反应速率增大”,给1分)
随着反应的进行,浓度减小,反应速率减慢相同时间内放出的热量减少,热量的散失成为影响温度变化的主要因素.(2分)
化学试题
可能用到的相对原子质量:
一、单项选择题:共13题,每题3分,共39分.每题只有一个选项最符合题意.
1.材料与生产、生活密不可分.下列材料说法正确的是( )
A.太阳能电池中的二氧化硅——半导体材料
B.外层的热控保温材料石墨烯——有机材料
C.形形色色的玻璃——硅酸盐材料
D.食品包装用的聚氯乙烯——有机高分子材料
2.“侯氏制碱法”曾为全球制碱工业做出了巨大贡献.该工艺反应之一如下:,下列说法正确的是( )
A.均为极性键形成的非极性分子 B.键角:
C.电负性: D.与晶体类型相同
3.铁钾矾是一种重要的化工原料.下列说法正确的是( )
A.分子间存在氢键,所以分子很稳定 B.硫离子的结构示意图:
C.离子半径大小: D.碱性强弱:
阅读下列资料,完成4~6题:
氨是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱、制药等工业;合成氨反应为,以铁触媒(主要成分是和)为催化剂.实验室用加热和固体混合物的方法,或将浓氨水与固体混合来制取少量氨气.工业上可利用氨气等制取硝酸.
4.实验室制取少量并探究其性质.下列装置不能达到实验目的的是( )
A.用装置甲制取 B.用装置乙收集
C.用装置丙检验水溶液呈碱性 D.用装置丁吸收多余的
5.下列说法正确的是( )
A.自然固氮和人工固氮都是将转化为 B.铁在纯氧中燃烧生成
C.常温下可用铁制容器盛装氯水 D.转化为时失去上的电子
6.有关工业合成氨的反应下列有关说法正确的是( )
A.其它条件不变,升高温度,可提高活化分子百分数,加快反应速率
B.反应的(E表示键能)
C.断裂同时有形成,说明达该条件下的平衡状态
D.将氨气液化并移走,可提高原料的平衡转化率及平衡时的反应速率
7.下列物质性质与用途具有对应关系的是( )
A.具有氧化性,可用于纸浆漂白
B.乙二醇水溶液凝固点很低,可用作抗冻剂
C.铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀
D.明矾溶于水并水解形成的胶体有吸附性,可用于消毒杀菌
8.下列化学反应表示正确的是( )
A.向硫酸铜中通入少量氨气:
B.向稀硝酸中加入过量铁粉:
C.已知氨气的燃烧热是:
D.“氯碱工业”阴极的电极反应式:
9.可用于治疗阿尔茨海默病,其合成路线如下.下列说法正确的是( )
A.X分子中有2种含氧官能团 B.Y、Z分子中手性碳原子数目相等
C.X和Z可以用银氨溶液或氯化铁溶液鉴别 D.Z分子中虚线框内所有碳原子一定共平面
10.MFC-电芬顿技术不需要外加能量即可发生,通过产生羟基自由基处理有机污染物,可获得高效的废水净化效果.其耦合系统原理示意图如图所示,下列说法正确的是( )
A.电子移动方向为
B.Y电极上得到双氧水的反应为
C.乙池可在酸性较弱的环境中使用
D.理论上当乙池中产生羟基自由基时,甲池中有从M室移动到N室
11.室温下,下列实验探究方案能达到探究目的的是( )
选项 探究方案 探究目的
A 向溶液中加入溶液,充分反应后用苯萃取次,取水层滴加溶液观察溶液颜色变化 反应:有一定限度
B 蔗糖中加入硫酸,加热,一段时间后,加入银氨溶液加热,观察实验现象 蔗糖是否水解
C 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去,后,试管里出现凝胶 比较的酸性和的非金属性
D 向浓度分别为和混合溶液中滴加几滴溶液,出现黄色沉淀
A.A B.B C.C D.D
12.利用烟道气中的生产晶体的工艺流程如下所示.下列说法正确的是( )
A.步骤Ⅰ可得溶液中有
B.步骤Ⅱ中发生的反应为,则的大于的
C.步骤Ⅲ所得溶液中有
D.向饱和溶液中通入的过程,水的电离程度先增大后减小
13.在催化剂作用下,以为原料合成,其主要反应有:
反应1
反应2
将体积比为的混合气体按一定流速通过催化反应管,测得的转化率随温度变化的关系如图所示.
己知的选择性
下列说法正确的是( )
A.图中曲线①表示转化率随温度的变化
B.720~800℃范围内,随温度的升高,出口处的量减少、的量增大
C.720~800℃范围内,随温度的升高,的选择性不断增大
D.其他条件不变,加入或选用高效催化剂,均能提高平衡时产率
二、非选择题,共4小题,61分.
14.(14分)以软锰矿(主要含,还含有和等)为原料经过下列过程可以制得等
(1)酸浸、还原:向软锰矿中加入硫酸、同时加入铁屑,充分反应后,过滤,所得溶液中主要含有和.写出酸浸、还原过程中发生反应的离子方程式:________.的电子排布式为:________,的空间构型为________.
(2)除杂:向酸浸、还原所得滤液中加入固体,调节溶液的,过滤.向已经除去的溶液(约为5)中加入溶液,溶液中的形成氟化物沉淀.
(3)沉锰:向调后所得滤液中加入一定量的氨水,可以得到沉淀.
①其他条件一定,沉锰过程中锰离子的沉淀率与溶液温度的关系如右图所示.50℃后,溶液温度越高,锰离子的沉淀率越低的原因是________.
②沉锰过程中溶液中存在平衡:中含有σ键的________.
(3)氧化:向沉锰所得中加入溶液,可以得到.
(4)制备.在搅拌下向溶液中缓慢滴加溶液,过滤、洗涤、干燥,得到固体,该过程发生的化学方程式为________.
(5)制备:经热解、酸浸等步骤可制备.溶液中加入后立即产生大量气泡,经检测反应过程中有生成,反应前后的质量、化学性质保持不变.该反应过程可描述为________.
15.(15分)丹参醇是存在于中药丹参中的一种天然产物.合成丹参醇的部分路线如下:
已知:
(1)中的杂化的原子个数为________.
(2)的过程:再发生水解反应生成B,R的化学式为,则其结构简式为________.
(3)的反应类型为________.
(4)X的分子式为,写出X的结构简式:________.
(5)A的一种同分异构体Y同时满足下列条件,写出Y的结构简式:________.
①可以和浓溴水发生取代反应,反应时最多消耗
②分子中共有4种不同环境的氢.
(6)写出以和为原料制备的合成路线流程图.
(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干).________
16.(14分)废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧电池的铜帽(总含量约为99%)回收并制备的部分实验过程如下:
(1)铜帽溶解时加入的作用是________.
(2)为确定加入锌灰(主要成分为,杂质为铁及其氧化物)的量,实验中需测定除去后溶液中的物质的量浓度.实验操作为:准确量取的含有的溶液于带塞锥形瓶中,加水稀释至,调节溶液,加入过量的,用标准溶液滴定至终点,消耗的溶液.上述过程中反应的离子方程式如下:(白色) (未配平)
①计算除去后溶液中的物质的量浓度,写出计算过程.________
②滴定选用的指示剂为________,滴定终点判断________.
(3)己知时能溶于溶液生成.下表列出了几种离子生成氢氧化物沉淀的(开始沉淀的按金属离子浓度为计算,金属阳离子沉淀完全时离子的物质的量浓度).
①在答题卡上将表格中的数据补充完整
开始沉淀的 沉淀完全的
1.1 3.1
________ 8.8
5.9 8.9
②由除去铜的滤液制备的实验步骤依次为:________过滤、洗涤、干燥、900℃煅烧.
(实验中可选用的试剂:.)
17.(18分)氨气在工农业生产中有着重要的用途,研究合成氨反应具有重要意义.
(1)直接常压电化学合成氨以纳米作催化剂,和为原料制备.其工作原理如题17图-1所示:
①阴极的电极反应式为________.
②电解过程中,由于发生副反应,使得阴极制得的中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是________.
(2)一定条件下,哈伯-博施合成氨反应历程中的能量变化如题17图-2所示.合成氨反应的热化学方程式为________.生成的历程中,速率最慢的反应的化学方程式为________.
(3)催化释氢可提供哈伯-博施合成氨反应所需的.在催化剂作用下,与水反应生成,可能的反应机理如题17图-3所示.
①其他条件不变时,以代替催化释氢,所得气体的分子式为________.
②已知:为一元弱酸,水溶液呈酸性的原因是________(用离子方程式表示).
③在催化剂的作用下,与水反应.释氢体积及温度随反应时间的变化如题17图-4所示.内,温度随时间快速升高的原因是________.后,氢气体积在增加,面温度却下降的原因是________.
参考答案
单项选择题(39分)
1.C 2.C 3.C 4.D 5.D 6.A 7.B 8.B 9.A 10.A 11.D 12.B 13.A
14.(14分)(1)(3分)
(1分) 正四面体(1分)
(3)①.温度升高,氨水发生分解并挥发(2分) ②(2分)
(4)(3分)
(5)与反应生成了和再分解生成了和或(2分)
15、(15分)(1)(2分) (2)(2分) (3)消去反应(1分)
(4)(2分) (5)(3分) (6)略(5分)
16.(14分)(1)氧化剂(1分) (2)①略(共3分) ②淀粉溶液(1分)
当最后半滴标准溶液滴入时,锥形瓶中的溶液恰好由蓝色变为无色,且半分钟内不变色(2分)
(3)①(2分)
开始沉淀的 沉淀完全的
1.1 3.1
6.8 8.8
5.9 8.9
②向滤液中加入适量,使其充分反应,(1分)向其中滴加,调节溶液约为5(或),过滤;(2分)向滤液中滴加,调节溶液约为10(或)(2分).(共5分)
17、(18分)(1)①(3分) ②(0.5,0.75)(2分)
(2)(2分) (2分)
(3)①(2分) ②(3分)
③与水反应放热,随着时间推移,体系温度升高反应速率增大,温度升高催化剂的活性增强产生氢气速率达到最大.(2分)(只答“温度升高反应速率增大”,给1分)
随着反应的进行,浓度减小,反应速率减慢相同时间内放出的热量减少,热量的散失成为影响温度变化的主要因素.(2分)
同课章节目录
