4.1.2核素 原子结构与元素的性质 课件(共39张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1.2核素 原子结构与元素的性质 课件(共39张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 39.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-21 20:50:51 | ||
图片预览










文档简介
(共39张PPT)
第一节原子结构与元素周期表
第四章 物质结构 元素周期律
第二课时 核素 原子结构与元素的性质
目录
CONTENT
一、核素
二、原子结构与元素的性质
第四章 物质结构 元素周期律
1.
2.
3.
4.
学习目标
知道元素、核素、同位素 的含义
认识碱金属元素的性质与其在元素周期表中位置的关系
认识卤族元素的性质与其在元素周期表中位置的关系
了解同主族元素性质的递变规律
1.金属元素:原子最外层电子一般少于4个,在化学反应中容易 ,具有 。
2.非金属元素:原子最外层电子一般多于4个,在化学反应中容易 ,具有 。
原子结构与元素性质的关系
失去电子
金属性
得到电子
非金属性
同学们能根据得失电子,总结元素的氧化还原性吗
一、核素
名称 氕 氘(重氢) 氚(超重氢)
符号 ___ ___ ___
质子数 ___ ___ ___
中子数 ___ ___ ___
H
D
T
1
1
1
0
1
2
氢元素的三种核素互为同位素
1.元素
(1)概念:具有相同________(_________)的一类_____的总称。
(2)决定元素种类的是_______。
质子数
核电荷数
原子
质子数
一、核素
2.核素
(1)概念:具有一定数目_____和一定数目_____的一种原子。
(2)表示方法——原子符号
质子
中子
(3)
①质子数为19,中子数为20的核素为____;
②质子数为6,中子数为6的核素为____;
③核素 的质子数为___,中子数为___。
(4)决定原子(核素)种类的是________________。
6
8
质子数和中子数
一、核素
3.同位素
(1)概念:_______相同而_______不同的同一_____的不同原子互称为同位素(即同一______的不同______互称为同位素)。“同位”是指核素的_______相同,在元素周期表中占有_____的位置。
质子数
中子数
元素
元素
核素
质子数
相同
(2)特点:
①同位素在周期表中占据同一__________;
②同位素的化学性质几乎__________;
③在天然存在的某种元素里,不论是游离态还是化合态,同位素相互之间保持一定的比率。
位置
相同
一、核素
(3)用途。
①考古时利用__________测定一些文物的年代;
②和用于制造__________;
③放射性同位素释放的射线可用于育种、给金属探伤、诊断和治疗疾病等。
氢弹
(1)任何原子都由质子、中子、电子构成( )
(2)23Na和23Mg互为同位素( )
(3)同位素原子的化学性质几乎相同,物理性质略有差异( )
(4)原子的种类大于元素的种类( )
(5) 为同一元素的不同微粒( )
√
×
×
√
√
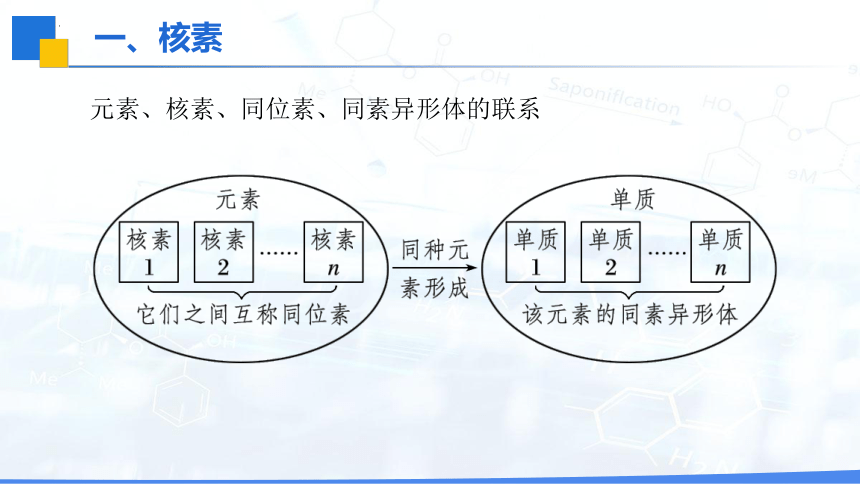
元素、核素、同位素、同素异形体的联系
一、核素
二、原子结构与元素的性质
原子的最外层电子数决定原子的化学性质。
原子 最外层电子数特点 得失电子情况 化学性质
稀有气体元素 都为8(氦为2) 不易_____ _____
金属元素 一般_____4 易_____ _______
非金属元素 _____4 易_____ ______
得失
稳定
少于
失去
不稳定
多于
得到
不稳定
讨论:结合锂、钠和钾的原子结构特点,请你预测锂、钾可能具有哪些与钠相似的化学性质。
二、原子结构与元素的性质
族 元素名称 元素符号 核电荷数 原子结构示意图 最外层电子 电子层数 原子半径(nm)
碱金属元素 锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
Li
Na
K
Rb
Cs
3
11
19
37
55
1
1
1
1
1
2
3
4
5
6
相同点 最外层均有___个电子,均有较强_____性
递变性 从Li到Cs随核电荷数的增加,电子层数____,原子半径____
1
还原
增多
增大
二、原子结构与元素的性质
1、碱金属元素
(1)实验探究
【实验1】碱金属与O2和水的反应
①回忆第二章学过的知识,钠有哪些化学性质
与O2、水、酸、盐溶液反应
②结合锂、钠和钾的原子结构特点,请你预测锂、钾可能具有哪些与钠相似的化学性质。
二、原子结构与元素的性质
K比Na反应更快更剧烈
【实验现象】
剧烈燃烧,发出黄色火焰,
生成淡黄色固体
【实验现象】
剧烈燃烧,发出紫色火焰,
生成黄色固体
Na
K
【实验现象】
2Na+O2====Na2O2(过氧化钠,复杂氧化物)
K+O2==== KO2 (超氧化钾,复杂氧化物)
钾与氧气反应生成多种氧化物,该反应只是其中一个
二、原子结构与元素的性质
(2)钠、钾与水反应
①实验现象:
相同点:金属___在水面上;金属___成闪亮的小球;小球_________;发出___________;反应后的溶液呈___色。
不同点:钾与水的反应有轻微爆炸声并着火燃烧。
浮
熔
四处游动
嘶嘶的响声
红
Na
K
二、原子结构与元素的性质
②化学方程式:
___________________________;________________________。
③实验结论:
与水反应剧烈程度:K___Na;金属的活泼性:K___Na。
2Na+2H2O===2NaOH+H2↑
2K+2H2O===2KOH+H2↑
>
>
碱金属化学性质的相似性和递变性与原子结构的关系
相似性:最外层电子数都是1
容易失去1个电子 (似金属钠,
与O2、水、酸、盐溶液反应)
递变性:从Li→Cs核电荷数增加
电子层数逐渐增多
原子半径逐渐增大
失电子能力逐渐增强
核对最外层电子的引力逐渐减弱
二、原子结构与元素的性质
(3).碱金属单质性质规律
①物理性质规律
银白色
较小
较小
较低
增大
减小
个性特点 ①铯略带金属光泽;②锂的密度比煤油的小;③钠的密度比钾大
提示:少量的钠和钾可保存在煤油中,并密封存放。
二、原子结构与元素的性质
②碱金属元素性质的特殊性
1)碱金属单质还原性最强的是Cs(放射性元素除外),最弱的是Li。
2)碱金属元素只有Li与O2反应的产物为Li2O一种,其他与O2反应的产物至少有两种。
3)碱金属元素的最高价氧化物对应水化物中只有LiOH微溶,其他均为易溶于水的强碱。
4)碱金属从Li→Cs,密度逐渐增大,但K的密度小于Na的。
5)Na、K通常保存在煤油或石蜡油中,但Li通常用石蜡密封。
6)Cs为略带金色光泽的固体,其余碱金属都呈银白色。
二、原子结构与元素的性质
(4)化学性质的相似性和递变性
②递变性
①相似性
二、原子结构与元素的性质
(5)认识碱金属的用途
锂电池是一种高能电池。锂有机化学中重要的催化剂。锂是制造氢弹不可缺少的材料,是优质的高能燃料(已经用于宇宙飞船、人造卫星和超声速飞机)。
钾和钠的合金(液态)——核反应堆的传热介质。由于高压钠灯具有光效高、寿命长,可接受的显色性以及不诱虫,不易使被照物褪色等特点,这就使高压钠灯被广泛的应用于普通照明的各个角落,以逐步地取代相对而言耗能大的荧光高压汞灯。
从碱金属原子结构的角度解释。
(1)碱金属元素的化学性质具有相似性。
提示 碱金属元素的最外层电子数相同,都是1个电子,故它们的化学性质相似。
(2)碱金属元素的性质具有递变性。
提示 随着核电荷数的增加,碱金属元素原子的电子层数逐渐增多,原子半径逐渐增大,原子核对最外层电子的引力逐渐减弱,原子失电子的能力逐渐增强。
二、原子结构与元素的性质
卤族元素(简称卤素)是典型的非金属元素,它们在自然界中都以化合态存在。
2
Br2
I2
Cl2
2、卤族元素
二、原子结构与元素的性质
(1).卤族元素的原子结构及其特点
卤族元素包括:_________________(写元素符号)。前4种元素的原子结构示意图依次是:
F 、Cl 、Br 、I
原子结构特点如下:
①相似性:最外层电子数都是___。
②递变性:F→I,核电荷数依次_____,电子层数依次_____,原子半径逐渐_____。
F、Cl、Br、I、At
7
增大
增多
增大
二、原子结构与元素的性质
F2 Cl2 Br2 I2
颜色 (常态) _______色 (气体) _______色 (气体) _______色 (液体) _______色
(固体)
密度 逐渐____(Cl2、Br2反常) 熔、沸点 逐渐_____ 淡黄绿
黄绿
深红棕
紫黑
增大
升高
相似性:均有颜色,密度小,熔沸点低。
递变性:由F2→I2,气态→固态,颜色加深,密度增大,熔沸点升高。
二、原子结构与元素的性质
(2).卤素单质的化学性质
①卤素单质与氢气反应
卤素单质 反应条件 化学方程式 产物稳定性
F2 暗处 _____________ 很稳定
Cl2 光照或点燃 ______________________ 较稳定
Br2 加热 __________________ 不如氯化氢稳定
I2 不断加热 _______________ 不稳定,同一条件下同时分解
结论 从F2到I2,与H2化合越来越___,生成的氢化物稳定性逐渐_____,元素的非金属性逐渐_____ H2+F2===2HF
难
减弱
减弱
二、原子结构与元素的性质
【实验4-1】
分别向盛有4 mL KBr溶液和4 mL KI溶液的两支试管中加入1 mL氯水,振荡,观察溶液的颜色变化,并与氯水的颜色进行比较。静置一段时间后,观察现象。写出反应的化学方程式。(实验完成后可在两支试管加入四氯化碳溶液,观察)
向盛有4 mL KI溶液的试管中加入1 mL溴水,振荡,观察溶液的颜色变化,并与溴水的颜色进行比较。静置一段时间后,观察现象。写出反应的化学方程式。(实验完成后可在三支试管加入四氯化碳溶液,观察)
②卤素单质间的置换反应。
类似于金属与盐溶液的置换反应,卤素单质间也可发生置换反应。
请设计实验证明。
二、原子结构与元素的性质
实验操作 实验现象 离子方程式 结论
振荡静置后,溶液由无色变为_____色 2Br-+Cl2===Br2+2Cl- 氧化性:_________
振荡静置后,溶液由无色变为___色 2I-+Cl2===I2+2Cl- 振荡静置后,溶液由无色变为___色 2I-+Br2===I2+2Br- 橙黄
褐
褐
Cl2>Br2>I2
二、原子结构与元素的性质
结论:随着核电荷数的增加,卤族单质氧化性逐渐减弱F2> Cl2 > Br2 > I2
单质 常温下单质 颜色和状态 在水中 在CCl4中
Br2 深红棕色液体 黄→橙色 红棕色(橙红色)
I2 紫黑色固体 棕黄→棕褐色 紫(红)色
【拓展】Br2和I2在不同溶剂中的颜色
二、原子结构与元素的性质
(3).卤素单质化学性质规律
①相似性
卤素原子都能得一个电子
②递变性
1、与H2反应越来越难,对应氢化物的稳定性逐渐减弱。
2、Cl2、Br2、I2与H2O反应越来越微弱。
3、
二、原子结构与元素的性质
同主族元素的原子结构与性质的关系
二、原子结构与元素的性质
(1) 与氢气化合的难易程度
(4)最高价氧化物的水化物----最高价含氧酸
的酸性强弱 HClO4>HBrO4>HIO4
(3)非金属单质间的置换
(5)非金属阴离子的还原性 Cl— < Br— < I—、
(2) 气态氢化物的稳定性 HF>HCl>HBr>HI
非金属性:元素原子得到电子的性质
1.下列有关碱金属元素的性质判断正确的是( )
A.K与H2O反应最剧烈
B.Rb比Na活泼,故Rb可以从NaCl溶液中置换出Na
C.碱金属的阳离子没有还原性,所以有强氧化性
D.从Li到Cs都易失去最外层1个电子,且失电子能力逐渐增强
D
2.镭是元素周期表中第七周期ⅡA族元素,关于其叙述不正确的
是( )
A.镭的金属性比钙弱 B.单质能与水反应生成H2
C.在化合物中呈+2价 D.碳酸镭难溶于水
A
3.下列有关碱金属元素和卤素的说法中,错误的是( )
A.溴单质与H2的反应比碘单质与H2的反应更剧烈
B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强
C.钾与水的反应比钠与水的反应更剧烈
D.随核电荷数的增加,碱金属元素和卤素的熔、沸点都逐渐降低
D
4.钾的下列性质与少量的钾保存在煤油中无关的是( )
A.单质钾的密度比煤油大 B.可用小刀片切割金属钾
C.钾易与空气反应 D.单质钾的还原性很强
B
5.下列关于碱金属的叙述错误的是( )
A.它们都能在空气中燃烧生成M2O(M指碱金属元素)
B.它们都能与水反应生成氢气和碱
C.随核电荷数的递增,它们所形成的阳离子的氧化性依次减弱
D.碱金属中密度最小的是锂
A
谢谢
第一节原子结构与元素周期表
第四章 物质结构 元素周期律
第二课时 核素 原子结构与元素的性质
目录
CONTENT
一、核素
二、原子结构与元素的性质
第四章 物质结构 元素周期律
1.
2.
3.
4.
学习目标
知道元素、核素、同位素 的含义
认识碱金属元素的性质与其在元素周期表中位置的关系
认识卤族元素的性质与其在元素周期表中位置的关系
了解同主族元素性质的递变规律
1.金属元素:原子最外层电子一般少于4个,在化学反应中容易 ,具有 。
2.非金属元素:原子最外层电子一般多于4个,在化学反应中容易 ,具有 。
原子结构与元素性质的关系
失去电子
金属性
得到电子
非金属性
同学们能根据得失电子,总结元素的氧化还原性吗
一、核素
名称 氕 氘(重氢) 氚(超重氢)
符号 ___ ___ ___
质子数 ___ ___ ___
中子数 ___ ___ ___
H
D
T
1
1
1
0
1
2
氢元素的三种核素互为同位素
1.元素
(1)概念:具有相同________(_________)的一类_____的总称。
(2)决定元素种类的是_______。
质子数
核电荷数
原子
质子数
一、核素
2.核素
(1)概念:具有一定数目_____和一定数目_____的一种原子。
(2)表示方法——原子符号
质子
中子
(3)
①质子数为19,中子数为20的核素为____;
②质子数为6,中子数为6的核素为____;
③核素 的质子数为___,中子数为___。
(4)决定原子(核素)种类的是________________。
6
8
质子数和中子数
一、核素
3.同位素
(1)概念:_______相同而_______不同的同一_____的不同原子互称为同位素(即同一______的不同______互称为同位素)。“同位”是指核素的_______相同,在元素周期表中占有_____的位置。
质子数
中子数
元素
元素
核素
质子数
相同
(2)特点:
①同位素在周期表中占据同一__________;
②同位素的化学性质几乎__________;
③在天然存在的某种元素里,不论是游离态还是化合态,同位素相互之间保持一定的比率。
位置
相同
一、核素
(3)用途。
①考古时利用__________测定一些文物的年代;
②和用于制造__________;
③放射性同位素释放的射线可用于育种、给金属探伤、诊断和治疗疾病等。
氢弹
(1)任何原子都由质子、中子、电子构成( )
(2)23Na和23Mg互为同位素( )
(3)同位素原子的化学性质几乎相同,物理性质略有差异( )
(4)原子的种类大于元素的种类( )
(5) 为同一元素的不同微粒( )
√
×
×
√
√
元素、核素、同位素、同素异形体的联系
一、核素
二、原子结构与元素的性质
原子的最外层电子数决定原子的化学性质。
原子 最外层电子数特点 得失电子情况 化学性质
稀有气体元素 都为8(氦为2) 不易_____ _____
金属元素 一般_____4 易_____ _______
非金属元素 _____4 易_____ ______
得失
稳定
少于
失去
不稳定
多于
得到
不稳定
讨论:结合锂、钠和钾的原子结构特点,请你预测锂、钾可能具有哪些与钠相似的化学性质。
二、原子结构与元素的性质
族 元素名称 元素符号 核电荷数 原子结构示意图 最外层电子 电子层数 原子半径(nm)
碱金属元素 锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
Li
Na
K
Rb
Cs
3
11
19
37
55
1
1
1
1
1
2
3
4
5
6
相同点 最外层均有___个电子,均有较强_____性
递变性 从Li到Cs随核电荷数的增加,电子层数____,原子半径____
1
还原
增多
增大
二、原子结构与元素的性质
1、碱金属元素
(1)实验探究
【实验1】碱金属与O2和水的反应
①回忆第二章学过的知识,钠有哪些化学性质
与O2、水、酸、盐溶液反应
②结合锂、钠和钾的原子结构特点,请你预测锂、钾可能具有哪些与钠相似的化学性质。
二、原子结构与元素的性质
K比Na反应更快更剧烈
【实验现象】
剧烈燃烧,发出黄色火焰,
生成淡黄色固体
【实验现象】
剧烈燃烧,发出紫色火焰,
生成黄色固体
Na
K
【实验现象】
2Na+O2====Na2O2(过氧化钠,复杂氧化物)
K+O2==== KO2 (超氧化钾,复杂氧化物)
钾与氧气反应生成多种氧化物,该反应只是其中一个
二、原子结构与元素的性质
(2)钠、钾与水反应
①实验现象:
相同点:金属___在水面上;金属___成闪亮的小球;小球_________;发出___________;反应后的溶液呈___色。
不同点:钾与水的反应有轻微爆炸声并着火燃烧。
浮
熔
四处游动
嘶嘶的响声
红
Na
K
二、原子结构与元素的性质
②化学方程式:
___________________________;________________________。
③实验结论:
与水反应剧烈程度:K___Na;金属的活泼性:K___Na。
2Na+2H2O===2NaOH+H2↑
2K+2H2O===2KOH+H2↑
>
>
碱金属化学性质的相似性和递变性与原子结构的关系
相似性:最外层电子数都是1
容易失去1个电子 (似金属钠,
与O2、水、酸、盐溶液反应)
递变性:从Li→Cs核电荷数增加
电子层数逐渐增多
原子半径逐渐增大
失电子能力逐渐增强
核对最外层电子的引力逐渐减弱
二、原子结构与元素的性质
(3).碱金属单质性质规律
①物理性质规律
银白色
较小
较小
较低
增大
减小
个性特点 ①铯略带金属光泽;②锂的密度比煤油的小;③钠的密度比钾大
提示:少量的钠和钾可保存在煤油中,并密封存放。
二、原子结构与元素的性质
②碱金属元素性质的特殊性
1)碱金属单质还原性最强的是Cs(放射性元素除外),最弱的是Li。
2)碱金属元素只有Li与O2反应的产物为Li2O一种,其他与O2反应的产物至少有两种。
3)碱金属元素的最高价氧化物对应水化物中只有LiOH微溶,其他均为易溶于水的强碱。
4)碱金属从Li→Cs,密度逐渐增大,但K的密度小于Na的。
5)Na、K通常保存在煤油或石蜡油中,但Li通常用石蜡密封。
6)Cs为略带金色光泽的固体,其余碱金属都呈银白色。
二、原子结构与元素的性质
(4)化学性质的相似性和递变性
②递变性
①相似性
二、原子结构与元素的性质
(5)认识碱金属的用途
锂电池是一种高能电池。锂有机化学中重要的催化剂。锂是制造氢弹不可缺少的材料,是优质的高能燃料(已经用于宇宙飞船、人造卫星和超声速飞机)。
钾和钠的合金(液态)——核反应堆的传热介质。由于高压钠灯具有光效高、寿命长,可接受的显色性以及不诱虫,不易使被照物褪色等特点,这就使高压钠灯被广泛的应用于普通照明的各个角落,以逐步地取代相对而言耗能大的荧光高压汞灯。
从碱金属原子结构的角度解释。
(1)碱金属元素的化学性质具有相似性。
提示 碱金属元素的最外层电子数相同,都是1个电子,故它们的化学性质相似。
(2)碱金属元素的性质具有递变性。
提示 随着核电荷数的增加,碱金属元素原子的电子层数逐渐增多,原子半径逐渐增大,原子核对最外层电子的引力逐渐减弱,原子失电子的能力逐渐增强。
二、原子结构与元素的性质
卤族元素(简称卤素)是典型的非金属元素,它们在自然界中都以化合态存在。
2
Br2
I2
Cl2
2、卤族元素
二、原子结构与元素的性质
(1).卤族元素的原子结构及其特点
卤族元素包括:_________________(写元素符号)。前4种元素的原子结构示意图依次是:
F 、Cl 、Br 、I
原子结构特点如下:
①相似性:最外层电子数都是___。
②递变性:F→I,核电荷数依次_____,电子层数依次_____,原子半径逐渐_____。
F、Cl、Br、I、At
7
增大
增多
增大
二、原子结构与元素的性质
F2 Cl2 Br2 I2
颜色 (常态) _______色 (气体) _______色 (气体) _______色 (液体) _______色
(固体)
密度 逐渐____(Cl2、Br2反常) 熔、沸点 逐渐_____ 淡黄绿
黄绿
深红棕
紫黑
增大
升高
相似性:均有颜色,密度小,熔沸点低。
递变性:由F2→I2,气态→固态,颜色加深,密度增大,熔沸点升高。
二、原子结构与元素的性质
(2).卤素单质的化学性质
①卤素单质与氢气反应
卤素单质 反应条件 化学方程式 产物稳定性
F2 暗处 _____________ 很稳定
Cl2 光照或点燃 ______________________ 较稳定
Br2 加热 __________________ 不如氯化氢稳定
I2 不断加热 _______________ 不稳定,同一条件下同时分解
结论 从F2到I2,与H2化合越来越___,生成的氢化物稳定性逐渐_____,元素的非金属性逐渐_____ H2+F2===2HF
难
减弱
减弱
二、原子结构与元素的性质
【实验4-1】
分别向盛有4 mL KBr溶液和4 mL KI溶液的两支试管中加入1 mL氯水,振荡,观察溶液的颜色变化,并与氯水的颜色进行比较。静置一段时间后,观察现象。写出反应的化学方程式。(实验完成后可在两支试管加入四氯化碳溶液,观察)
向盛有4 mL KI溶液的试管中加入1 mL溴水,振荡,观察溶液的颜色变化,并与溴水的颜色进行比较。静置一段时间后,观察现象。写出反应的化学方程式。(实验完成后可在三支试管加入四氯化碳溶液,观察)
②卤素单质间的置换反应。
类似于金属与盐溶液的置换反应,卤素单质间也可发生置换反应。
请设计实验证明。
二、原子结构与元素的性质
实验操作 实验现象 离子方程式 结论
振荡静置后,溶液由无色变为_____色 2Br-+Cl2===Br2+2Cl- 氧化性:_________
振荡静置后,溶液由无色变为___色 2I-+Cl2===I2+2Cl- 振荡静置后,溶液由无色变为___色 2I-+Br2===I2+2Br- 橙黄
褐
褐
Cl2>Br2>I2
二、原子结构与元素的性质
结论:随着核电荷数的增加,卤族单质氧化性逐渐减弱F2> Cl2 > Br2 > I2
单质 常温下单质 颜色和状态 在水中 在CCl4中
Br2 深红棕色液体 黄→橙色 红棕色(橙红色)
I2 紫黑色固体 棕黄→棕褐色 紫(红)色
【拓展】Br2和I2在不同溶剂中的颜色
二、原子结构与元素的性质
(3).卤素单质化学性质规律
①相似性
卤素原子都能得一个电子
②递变性
1、与H2反应越来越难,对应氢化物的稳定性逐渐减弱。
2、Cl2、Br2、I2与H2O反应越来越微弱。
3、
二、原子结构与元素的性质
同主族元素的原子结构与性质的关系
二、原子结构与元素的性质
(1) 与氢气化合的难易程度
(4)最高价氧化物的水化物----最高价含氧酸
的酸性强弱 HClO4>HBrO4>HIO4
(3)非金属单质间的置换
(5)非金属阴离子的还原性 Cl— < Br— < I—、
(2) 气态氢化物的稳定性 HF>HCl>HBr>HI
非金属性:元素原子得到电子的性质
1.下列有关碱金属元素的性质判断正确的是( )
A.K与H2O反应最剧烈
B.Rb比Na活泼,故Rb可以从NaCl溶液中置换出Na
C.碱金属的阳离子没有还原性,所以有强氧化性
D.从Li到Cs都易失去最外层1个电子,且失电子能力逐渐增强
D
2.镭是元素周期表中第七周期ⅡA族元素,关于其叙述不正确的
是( )
A.镭的金属性比钙弱 B.单质能与水反应生成H2
C.在化合物中呈+2价 D.碳酸镭难溶于水
A
3.下列有关碱金属元素和卤素的说法中,错误的是( )
A.溴单质与H2的反应比碘单质与H2的反应更剧烈
B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强
C.钾与水的反应比钠与水的反应更剧烈
D.随核电荷数的增加,碱金属元素和卤素的熔、沸点都逐渐降低
D
4.钾的下列性质与少量的钾保存在煤油中无关的是( )
A.单质钾的密度比煤油大 B.可用小刀片切割金属钾
C.钾易与空气反应 D.单质钾的还原性很强
B
5.下列关于碱金属的叙述错误的是( )
A.它们都能在空气中燃烧生成M2O(M指碱金属元素)
B.它们都能与水反应生成氢气和碱
C.随核电荷数的递增,它们所形成的阳离子的氧化性依次减弱
D.碱金属中密度最小的是锂
A
谢谢
