3.1.3氧化还原反应 课件(共25张PPT) 2023-2024学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 3.1.3氧化还原反应 课件(共25张PPT) 2023-2024学年高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-21 20:52:33 | ||
图片预览






文档简介
(共25张PPT)
专题3 从海水中获得的化学物质
第一单元 氯气及氯的化合物
氧化还原反应
(第一课时)
能从化合价变化和电子转移角度认识氧化还原反应,培养宏观辨识与微观探析的化学核心素养。
01
学会表示电子转移方向和数目的方法,掌握氧化剂、还原剂、氧化反应和还原反应的概念及其相互关系,培养变化联系的观念与平衡思想的化学核心素养。
02
学习目标
充电电池中氧化还原反应
钢铁被氧化腐蚀
生活中的氧化还原现象
为什么食品袋里
要放脱氧剂呢?
生活中的氧化还原现象
任务一 氧化还原反应的基本概念
氧化还原反应
非氧化还原反应
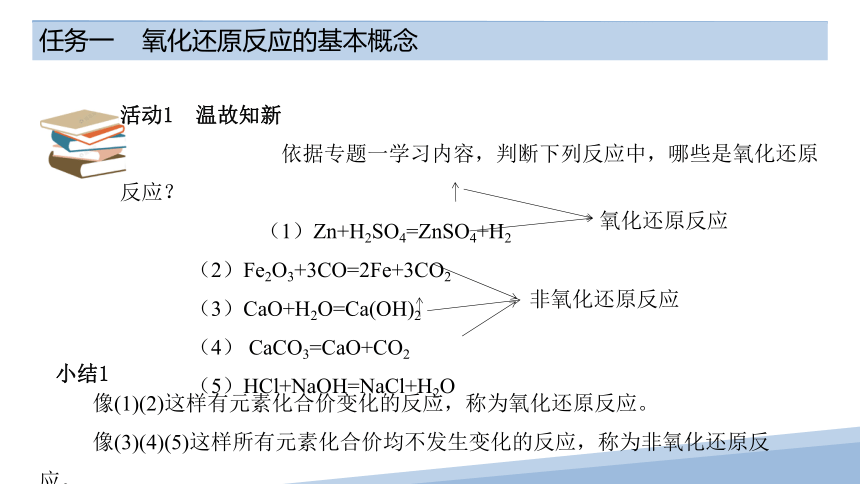
活动1 温故知新
依据专题一学习内容,判断下列反应中,哪些是氧化还原反应?
(1)Zn+H2SO4=ZnSO4+H2
(2)Fe2O3+3CO=2Fe+3CO2
(3)CaO+H2O=Ca(OH)2
(4) CaCO3=CaO+CO2
(5)HCl+NaOH=NaCl+H2O
小结1
像(1)(2)这样有元素化合价变化的反应,称为氧化还原反应。
像(3)(4)(5)这样所有元素化合价均不发生变化的反应,称为非氧化还原反应。
任务一 氧化还原反应的基本概念
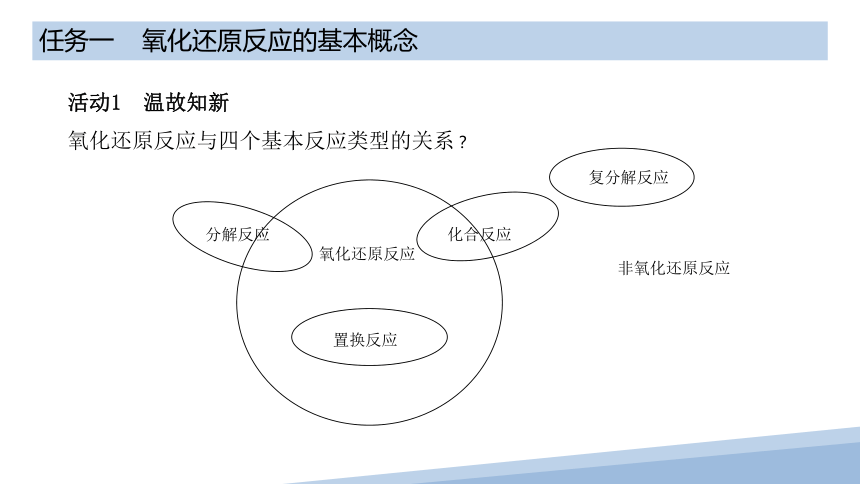
活动1 温故知新
氧化还原反应与四个基本反应类型的关系?
氧化还原反应
非氧化还原反应
置换反应
复分解反应
化合反应
分解反应
任务一 氧化还原反应的基本概念
请从元素的化合价是否发生变化的角度,对氯气和金属钠的化学反应进行分类,它属于何种反应类型?反应中化合价发生变化的原因是什么?寻找氧化还原反应的本质?
活动2 思考
2 Na + Cl2 = 2NaCl
任务一 氧化还原反应的基本概念
e-
失电子,钠原子变为钠离子
0
+1
0
-1
得电子,氯原子变为氯离子
Na+
Cl-
0
0
+1
-1
得到电子,化合价降低
失去电子,化合价升高
2 Na + Cl2 = 2NaCl
得失电子同时进行、同时存在
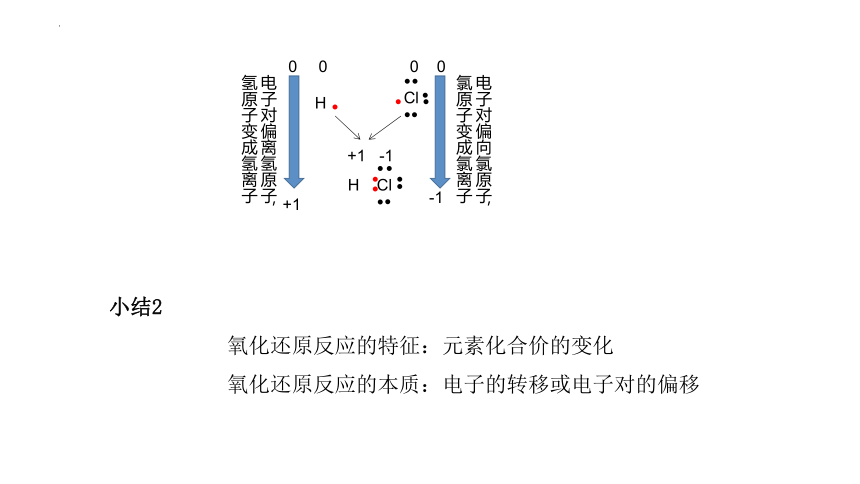
小结2
氧化还原反应的特征:元素化合价的变化
氧化还原反应的本质:电子的转移或电子对的偏移
H
H
●
●
●
Cl
●
●
●
●
●
●
0
0
+1 -1
Cl
●
●
●
●
●
●
●
0
-1
电子对偏向氯原子,氯原子变成氯离子
电子对偏离氢原子,氢原子变成氢离子
0
+1
任务一 氧化还原反应的基本概念
活动3 练习
找出下列反应中元素化合价的变化及电子的得失。
2Fe + 3Cl2 == 2FeCl3
2HClO == O2 + 2HCl
2NaCl + 2H2O == 2NaOH +H2 +Cl2
光照
通电
点燃
任务二 电子转移表示方法
活动1 思考:氧化还原反应的本质是电子的转移,怎么表示电子的转移呢?请以钠与氯气的反应为例进行说明。
1、双线桥法:表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
2 Na + Cl2 = 2NaCl
标价态
正确标出反应前后各元素的化合价
明确变价元素的化合价升降关系
注得失
标出“失去”或“得到”电子的总数
0
0
+1
-1
失去2×e-
得到2×e-
双箭头
一条线始于被还原的物质中的降价元素,止于还原产物中的相应元素;
一条线始于被氧化的物质中的升价元素,终止于氧化产物中的相应元素
注意事项:
1、箭头和箭尾必须连接同一元素,并且箭头指向生成物,箭尾连接反应物;
2、线桥上必须标明“得到”或“失去”,并且得到和失去的电子总数应相等;
3、用双线桥法标电子转移数目时,用a×be-的形式表示,a表示得电子或失电子的 原子个数,b表示每个原子失去或得到的电子数,当a=1时,可以直接写为be-;当b=1时,要写为a×e-。箭头、箭尾必须对应化合价变化的同种元素的原子;
任务二 电子转移表示方法
小结1
标价态
双箭头
注得失
任务二 电子转移表示方法
2、 单线桥法
表示反应过程中不同元素原子间的电子转移情况。
2 Na + Cl2 = 2NaCl
标价态
正确标出反应前后各元素的化合价;明确变价元素的化合价升降关系
单线桥
始于被氧化物质中化合价升高的元素,止于被还原物质中化合价降低的元素
标数目
标出转移电子的总数
-1
2e-
0
0
+1
注意事项:
1、不需要标明“得到”或“失去”,只标明电子转移数目;
2、要用箭头标明电子转移的方向;
3、箭头由反应物中失电子元素原子指向得电子元素原子。
任务二 电子转移表示方法
活动2 练习
请用双线桥法和单线桥法表示下列各反应电子转移方向和数目。
Cl2 + 2NaOH == NaCl + NaClO + H2O
任务二 电子转移表示方法
Fe + H2SO4 == FeSO4 + H2
2KClO3 == 2KCl + 3O2
MnO2
2KMn04+16HCl(浓)==2KC1+2MnCl2+5Cl2↑+8H2O
活动3 思考: 氧化还原反应中同一元素化合价全部发生变化吗?
高锰酸钾与浓盐酸在一定条件下可以反应生成氯气。该反应是氧化还原反应吗?如果是,用双线桥法和单线桥法表示电子转移的方向和数目。
失去10×e-,化合价升高
得到2×5e-,化合价降低
2KMn04+16HCl(浓)==2KC1+2MnCl2+5Cl2↑+8H2O
10e-
任务二 电子转移表示方法
小结3 氧化还原反应中同一元素可能只有部分原子的化合价发生变化
得失电子总数相等
氧化剂:
所含元素得到电子(化合价降低)的反应物。
任务三 氧化剂、还原剂、氧化产物、还原产物
还原剂:
所含元素失去电子(化合价升高)的反应物。
2Na + Cl2 = 2NaCl
氧化剂
还原剂
注意:氧化剂和还原剂均是指反应物质,是一种化学试剂,不是某一种元素。
活动1 思考
失去电子,化合价升高
得到电子,化合价降低
-1
0
+1
0
钠与氯气反应中,钠、氯气、氯化钠分别扮演什么角色呢?
任务三 氧化剂、还原剂、氧化产物、还原产物
氧化产物:
还原剂失去电子,被氧化的产物。
还原产物:
氧化剂得到电子,被还原的产物。
得到电子,化合价降低
2Na + Cl2 = 2NaCl
0
+1
0
-1
失去电子,化合价升高
氧化剂
还原剂
氧化产物
还原产物
任务三 氧化剂、还原剂、氧化产物、还原产物
氧化剂+还原剂=氧化产物+还原产物
化合价升高,失去电子,被氧化,发生氧化反应
化合价降低,得到电子,被还原,发生还原反应
氧化剂
得电子
化合价降低
发生还原反应
还原剂
失电子
化合价升高
发生氧化反应
小结1
e-
任务三 氧化剂、还原剂、氧化产物、还原产物
降 得 还
升 失 氧
口诀:升失氧化还原剂 、 降得还原氧化剂
任务三 氧化剂、还原剂、氧化产物、还原产物
4NO + 3O2 + 2H2O == 4HNO3
活动2 练习
请指出下列反应中的氧化剂、还原剂、氧化产物、还原产物
MnO2 + 4HCl(浓) == MnCl2 + Cl2↑ + H2O
归纳总结
反应物
化合价升高
化合价降低
特征
失去电子
得到电子
本质
发生氧化反应
发生还原反应
氧化产物
还原产物
反应
产物
食品包装中的脱氧剂目的是为了防止食品发生氧化还原反应而腐烂
人生就像氧化还原反应,有失去有得到,有升有降,起起落落总会向前行,加油各位!!!
谢 谢 观 看
专题3 从海水中获得的化学物质
第一单元 氯气及氯的化合物
氧化还原反应
(第一课时)
能从化合价变化和电子转移角度认识氧化还原反应,培养宏观辨识与微观探析的化学核心素养。
01
学会表示电子转移方向和数目的方法,掌握氧化剂、还原剂、氧化反应和还原反应的概念及其相互关系,培养变化联系的观念与平衡思想的化学核心素养。
02
学习目标
充电电池中氧化还原反应
钢铁被氧化腐蚀
生活中的氧化还原现象
为什么食品袋里
要放脱氧剂呢?
生活中的氧化还原现象
任务一 氧化还原反应的基本概念
氧化还原反应
非氧化还原反应
活动1 温故知新
依据专题一学习内容,判断下列反应中,哪些是氧化还原反应?
(1)Zn+H2SO4=ZnSO4+H2
(2)Fe2O3+3CO=2Fe+3CO2
(3)CaO+H2O=Ca(OH)2
(4) CaCO3=CaO+CO2
(5)HCl+NaOH=NaCl+H2O
小结1
像(1)(2)这样有元素化合价变化的反应,称为氧化还原反应。
像(3)(4)(5)这样所有元素化合价均不发生变化的反应,称为非氧化还原反应。
任务一 氧化还原反应的基本概念
活动1 温故知新
氧化还原反应与四个基本反应类型的关系?
氧化还原反应
非氧化还原反应
置换反应
复分解反应
化合反应
分解反应
任务一 氧化还原反应的基本概念
请从元素的化合价是否发生变化的角度,对氯气和金属钠的化学反应进行分类,它属于何种反应类型?反应中化合价发生变化的原因是什么?寻找氧化还原反应的本质?
活动2 思考
2 Na + Cl2 = 2NaCl
任务一 氧化还原反应的基本概念
e-
失电子,钠原子变为钠离子
0
+1
0
-1
得电子,氯原子变为氯离子
Na+
Cl-
0
0
+1
-1
得到电子,化合价降低
失去电子,化合价升高
2 Na + Cl2 = 2NaCl
得失电子同时进行、同时存在
小结2
氧化还原反应的特征:元素化合价的变化
氧化还原反应的本质:电子的转移或电子对的偏移
H
H
●
●
●
Cl
●
●
●
●
●
●
0
0
+1 -1
Cl
●
●
●
●
●
●
●
0
-1
电子对偏向氯原子,氯原子变成氯离子
电子对偏离氢原子,氢原子变成氢离子
0
+1
任务一 氧化还原反应的基本概念
活动3 练习
找出下列反应中元素化合价的变化及电子的得失。
2Fe + 3Cl2 == 2FeCl3
2HClO == O2 + 2HCl
2NaCl + 2H2O == 2NaOH +H2 +Cl2
光照
通电
点燃
任务二 电子转移表示方法
活动1 思考:氧化还原反应的本质是电子的转移,怎么表示电子的转移呢?请以钠与氯气的反应为例进行说明。
1、双线桥法:表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
2 Na + Cl2 = 2NaCl
标价态
正确标出反应前后各元素的化合价
明确变价元素的化合价升降关系
注得失
标出“失去”或“得到”电子的总数
0
0
+1
-1
失去2×e-
得到2×e-
双箭头
一条线始于被还原的物质中的降价元素,止于还原产物中的相应元素;
一条线始于被氧化的物质中的升价元素,终止于氧化产物中的相应元素
注意事项:
1、箭头和箭尾必须连接同一元素,并且箭头指向生成物,箭尾连接反应物;
2、线桥上必须标明“得到”或“失去”,并且得到和失去的电子总数应相等;
3、用双线桥法标电子转移数目时,用a×be-的形式表示,a表示得电子或失电子的 原子个数,b表示每个原子失去或得到的电子数,当a=1时,可以直接写为be-;当b=1时,要写为a×e-。箭头、箭尾必须对应化合价变化的同种元素的原子;
任务二 电子转移表示方法
小结1
标价态
双箭头
注得失
任务二 电子转移表示方法
2、 单线桥法
表示反应过程中不同元素原子间的电子转移情况。
2 Na + Cl2 = 2NaCl
标价态
正确标出反应前后各元素的化合价;明确变价元素的化合价升降关系
单线桥
始于被氧化物质中化合价升高的元素,止于被还原物质中化合价降低的元素
标数目
标出转移电子的总数
-1
2e-
0
0
+1
注意事项:
1、不需要标明“得到”或“失去”,只标明电子转移数目;
2、要用箭头标明电子转移的方向;
3、箭头由反应物中失电子元素原子指向得电子元素原子。
任务二 电子转移表示方法
活动2 练习
请用双线桥法和单线桥法表示下列各反应电子转移方向和数目。
Cl2 + 2NaOH == NaCl + NaClO + H2O
任务二 电子转移表示方法
Fe + H2SO4 == FeSO4 + H2
2KClO3 == 2KCl + 3O2
MnO2
2KMn04+16HCl(浓)==2KC1+2MnCl2+5Cl2↑+8H2O
活动3 思考: 氧化还原反应中同一元素化合价全部发生变化吗?
高锰酸钾与浓盐酸在一定条件下可以反应生成氯气。该反应是氧化还原反应吗?如果是,用双线桥法和单线桥法表示电子转移的方向和数目。
失去10×e-,化合价升高
得到2×5e-,化合价降低
2KMn04+16HCl(浓)==2KC1+2MnCl2+5Cl2↑+8H2O
10e-
任务二 电子转移表示方法
小结3 氧化还原反应中同一元素可能只有部分原子的化合价发生变化
得失电子总数相等
氧化剂:
所含元素得到电子(化合价降低)的反应物。
任务三 氧化剂、还原剂、氧化产物、还原产物
还原剂:
所含元素失去电子(化合价升高)的反应物。
2Na + Cl2 = 2NaCl
氧化剂
还原剂
注意:氧化剂和还原剂均是指反应物质,是一种化学试剂,不是某一种元素。
活动1 思考
失去电子,化合价升高
得到电子,化合价降低
-1
0
+1
0
钠与氯气反应中,钠、氯气、氯化钠分别扮演什么角色呢?
任务三 氧化剂、还原剂、氧化产物、还原产物
氧化产物:
还原剂失去电子,被氧化的产物。
还原产物:
氧化剂得到电子,被还原的产物。
得到电子,化合价降低
2Na + Cl2 = 2NaCl
0
+1
0
-1
失去电子,化合价升高
氧化剂
还原剂
氧化产物
还原产物
任务三 氧化剂、还原剂、氧化产物、还原产物
氧化剂+还原剂=氧化产物+还原产物
化合价升高,失去电子,被氧化,发生氧化反应
化合价降低,得到电子,被还原,发生还原反应
氧化剂
得电子
化合价降低
发生还原反应
还原剂
失电子
化合价升高
发生氧化反应
小结1
e-
任务三 氧化剂、还原剂、氧化产物、还原产物
降 得 还
升 失 氧
口诀:升失氧化还原剂 、 降得还原氧化剂
任务三 氧化剂、还原剂、氧化产物、还原产物
4NO + 3O2 + 2H2O == 4HNO3
活动2 练习
请指出下列反应中的氧化剂、还原剂、氧化产物、还原产物
MnO2 + 4HCl(浓) == MnCl2 + Cl2↑ + H2O
归纳总结
反应物
化合价升高
化合价降低
特征
失去电子
得到电子
本质
发生氧化反应
发生还原反应
氧化产物
还原产物
反应
产物
食品包装中的脱氧剂目的是为了防止食品发生氧化还原反应而腐烂
人生就像氧化还原反应,有失去有得到,有升有降,起起落落总会向前行,加油各位!!!
谢 谢 观 看
