人教版化学九年级下册 第十单元课题1 常见的酸和碱第2课时 酸的化学性质课件(共29张PPT)
文档属性
| 名称 | 人教版化学九年级下册 第十单元课题1 常见的酸和碱第2课时 酸的化学性质课件(共29张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 287.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-22 06:24:19 | ||
图片预览






文档简介
(共29张PPT)
第十单元 酸和碱
课题一 常见的酸和碱
九年级化学下册(RJ)教学课件
第2课时 酸的化学性质
目录 content
学习目标
1
情景导学
2
新课进行时
3
知识小结
4
随堂演练
5
H
N
S
C
a
B
Na
课后作业
6
0.00
学习目标
1
+
+
学习目标
学习目标
1.学习酸的分类与命名,从电离的观点了解酸的通性。
2.了解并记住金属活动性顺序,并能用它来判断某金属与酸能否发生置换反应。
3.掌握酸与金属氧化物的反应。
4.了解中和反应以及它在生产、科研中的应用。
0.00
2
+
+
情景导学
情景导学
在不借用试剂的前提下,你可以使紫色的石蕊变成红色吗
紫色石蕊试液为什么变色?
除了碳酸,还有其他物质能使紫色石蕊试液变红吗?
石蕊试液
0.00
新课进行时
3
+
+
知识点一
新课进行时
酸与指示剂作用
在不借用试剂的前提下,你可以使紫色石蕊溶液变成红色吗
石蕊溶液
紫色石蕊溶液为什么变色?
除了碳酸,还有其他物质能使紫色石蕊溶液变红吗?
新课进行时
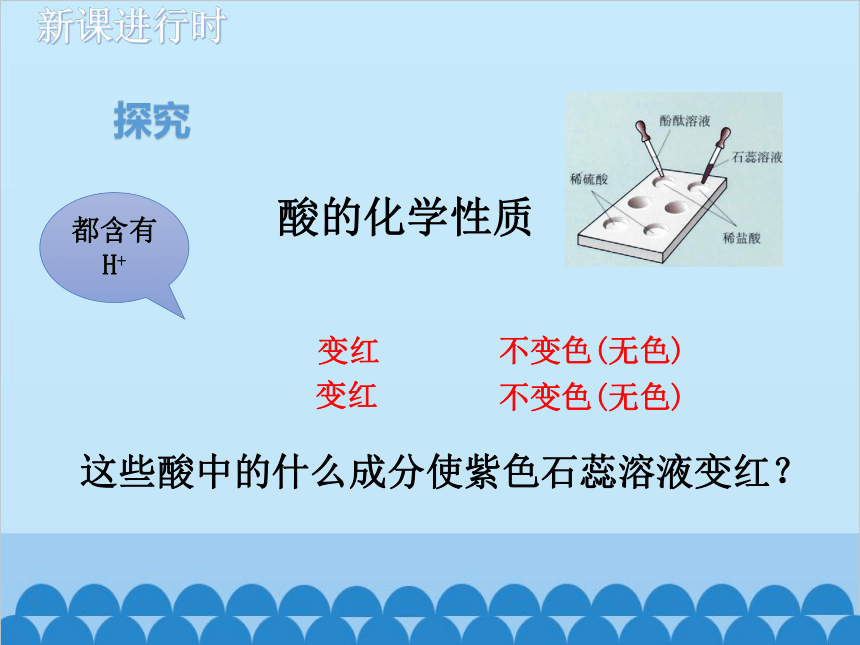
酸的化学性质
这些酸中的什么成分使紫色石蕊溶液变红?
变红
变红
不变色(无色)
不变色(无色)
都含有H+
探究
新课进行时
酸溶液与活泼金属反应
知识点二
问题
你知道酸与哪些物质能发生反应?又有哪些现象产生呢?
观察盐酸、硫酸与镁、锌、铁、铜四种金属的反应,并填写下表。
实验
新课进行时
反应剧烈,产生气泡
反应非常剧烈,产生气泡
反应速度适中,产生气泡
反应速度适中,产生气泡
反应比较慢,产生气泡
反应比较慢,产生气泡
不反应
不反应
你有什么发现吗?
新课进行时
表演:用肢体语言表达铜、铁、锌、镁在稀盐酸中的表现
盐酸
God save me!!
无所谓, 我无所谓…
我得意的笑,又得意的笑…
为什么受伤的总是我!
?
新课进行时
反应剧烈,产生气泡
反应非常剧烈,产生气泡
反应速度适中,产生气泡
反应速度适中,产生气泡
反应比较慢,产生气泡
反应比较慢,产生气泡
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Zn+H2SO4=ZnSO4+H2↑
Mg+H2SO4 =MgSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
Fe+2HCl=FeCl2+H2↑
不反应
不反应
你有什么发现吗?
新课进行时
小结
1.酸能与比较活泼的金属反应产生氢气。
2.与酸反应越剧烈的金属性质越活泼。
(金属活泼程度为镁>锌>铁>铜)
新课进行时
金属 最活泼,金属 最不活泼。
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
⑴从左向右金属活动性由强逐渐减弱。
K
Au
规律:
⑵排在 前面金属能与稀盐酸、稀硫酸反应生成氢气,排在 后面金属与稀盐酸、稀硫酸不反应。且位置越靠前产生氢气速度 。
Mg
Zn
Fe
Cu
H
H
越快
金属 + 酸 → 盐 + 氢气(置换反应)
新课进行时
酸溶液与金属氧化物反应
知识点三
实验
新课进行时
实验现象:
铁锈+盐酸:开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色;
铁锈+硫酸:开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色,当铁锈消失后,铁钉表面会冒出气泡。
为什么?
金属单质+酸→H2
新课进行时
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
化学方程式:
生成物有什么共同之处?
金属氧化物+酸→盐+水
新课进行时
自由讨论
1.利用上述反应清除铁制品表面的锈时,能否将铁制品长时间浸在酸中?为什么?
2.氧化铜能与稀硫酸发生化学反应吗?为什么?
CuO+H2SO4 =CuSO4+H2O
CuO+2HCl=CuCl2+H2O
不能,除锈以后,铁会继续跟酸反应生成H2。
金属氧化物可与酸反应生成盐和水
0.00
知识小结
4
+
+
知识小结
你能归纳出稀盐酸和稀硫酸有哪些相似的化学性质吗
③稀硫酸、盐酸都能与金属氧化物
反应,并生成水
①稀硫酸、稀盐酸都能与指示剂作用
②稀硫酸、稀盐酸都能与活动性较强
的金属发生置换反应,放出氢气
酸的化学性质
0.00
随堂演练
5
+
+
课堂习题演练
练习与应用(P59)
2.(1)厕所用清洁剂中含有盐酸,如果不慎洒到大理石地面上,会发出嘶嘶声,并有气体产生。这种气体是( )。
A.二氧化硫 B.二氧化碳
C.氢气 D.氧气
B
CaCO3
课堂习题演练
6.某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现有废硫酸9.8 t(H2SO4的质量分数为20%),与足量的废铁屑反应,可生产FeSO4的质量是多少?
课堂习题演练
解:设可生产FeSO4的质量为x。
Fe + H2SO4 = FeSO4 + H2↑
98 152
9.8t×20%
答:可生产FeSO4的质量是3.04t。
解得x=3.04t。
随堂演练
1.泉州是白蚂蚁的高发地区,白蚂蚁会蛀蚀木头,它分泌的蚁酸是一种酸,还能腐蚀很多建筑材料。下列建筑材料最不容易被白蚂蚁腐蚀的是( )
A.钢筋 B.铜制品 C.大理石 D.铝合金
B
主要成分是铁
主要成分是铝
主要成分是碳酸钙
0.00
课后作业
6
+
+
课后作业
完成学生用书本课时的习题
谢 谢 大 家!
THANK YOU
第十单元 酸和碱
课题一 常见的酸和碱
九年级化学下册(RJ)教学课件
第2课时 酸的化学性质
目录 content
学习目标
1
情景导学
2
新课进行时
3
知识小结
4
随堂演练
5
H
N
S
C
a
B
Na
课后作业
6
0.00
学习目标
1
+
+
学习目标
学习目标
1.学习酸的分类与命名,从电离的观点了解酸的通性。
2.了解并记住金属活动性顺序,并能用它来判断某金属与酸能否发生置换反应。
3.掌握酸与金属氧化物的反应。
4.了解中和反应以及它在生产、科研中的应用。
0.00
2
+
+
情景导学
情景导学
在不借用试剂的前提下,你可以使紫色的石蕊变成红色吗
紫色石蕊试液为什么变色?
除了碳酸,还有其他物质能使紫色石蕊试液变红吗?
石蕊试液
0.00
新课进行时
3
+
+
知识点一
新课进行时
酸与指示剂作用
在不借用试剂的前提下,你可以使紫色石蕊溶液变成红色吗
石蕊溶液
紫色石蕊溶液为什么变色?
除了碳酸,还有其他物质能使紫色石蕊溶液变红吗?
新课进行时
酸的化学性质
这些酸中的什么成分使紫色石蕊溶液变红?
变红
变红
不变色(无色)
不变色(无色)
都含有H+
探究
新课进行时
酸溶液与活泼金属反应
知识点二
问题
你知道酸与哪些物质能发生反应?又有哪些现象产生呢?
观察盐酸、硫酸与镁、锌、铁、铜四种金属的反应,并填写下表。
实验
新课进行时
反应剧烈,产生气泡
反应非常剧烈,产生气泡
反应速度适中,产生气泡
反应速度适中,产生气泡
反应比较慢,产生气泡
反应比较慢,产生气泡
不反应
不反应
你有什么发现吗?
新课进行时
表演:用肢体语言表达铜、铁、锌、镁在稀盐酸中的表现
盐酸
God save me!!
无所谓, 我无所谓…
我得意的笑,又得意的笑…
为什么受伤的总是我!
?
新课进行时
反应剧烈,产生气泡
反应非常剧烈,产生气泡
反应速度适中,产生气泡
反应速度适中,产生气泡
反应比较慢,产生气泡
反应比较慢,产生气泡
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Zn+H2SO4=ZnSO4+H2↑
Mg+H2SO4 =MgSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
Fe+2HCl=FeCl2+H2↑
不反应
不反应
你有什么发现吗?
新课进行时
小结
1.酸能与比较活泼的金属反应产生氢气。
2.与酸反应越剧烈的金属性质越活泼。
(金属活泼程度为镁>锌>铁>铜)
新课进行时
金属 最活泼,金属 最不活泼。
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
⑴从左向右金属活动性由强逐渐减弱。
K
Au
规律:
⑵排在 前面金属能与稀盐酸、稀硫酸反应生成氢气,排在 后面金属与稀盐酸、稀硫酸不反应。且位置越靠前产生氢气速度 。
Mg
Zn
Fe
Cu
H
H
越快
金属 + 酸 → 盐 + 氢气(置换反应)
新课进行时
酸溶液与金属氧化物反应
知识点三
实验
新课进行时
实验现象:
铁锈+盐酸:开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色;
铁锈+硫酸:开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色,当铁锈消失后,铁钉表面会冒出气泡。
为什么?
金属单质+酸→H2
新课进行时
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
化学方程式:
生成物有什么共同之处?
金属氧化物+酸→盐+水
新课进行时
自由讨论
1.利用上述反应清除铁制品表面的锈时,能否将铁制品长时间浸在酸中?为什么?
2.氧化铜能与稀硫酸发生化学反应吗?为什么?
CuO+H2SO4 =CuSO4+H2O
CuO+2HCl=CuCl2+H2O
不能,除锈以后,铁会继续跟酸反应生成H2。
金属氧化物可与酸反应生成盐和水
0.00
知识小结
4
+
+
知识小结
你能归纳出稀盐酸和稀硫酸有哪些相似的化学性质吗
③稀硫酸、盐酸都能与金属氧化物
反应,并生成水
①稀硫酸、稀盐酸都能与指示剂作用
②稀硫酸、稀盐酸都能与活动性较强
的金属发生置换反应,放出氢气
酸的化学性质
0.00
随堂演练
5
+
+
课堂习题演练
练习与应用(P59)
2.(1)厕所用清洁剂中含有盐酸,如果不慎洒到大理石地面上,会发出嘶嘶声,并有气体产生。这种气体是( )。
A.二氧化硫 B.二氧化碳
C.氢气 D.氧气
B
CaCO3
课堂习题演练
6.某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现有废硫酸9.8 t(H2SO4的质量分数为20%),与足量的废铁屑反应,可生产FeSO4的质量是多少?
课堂习题演练
解:设可生产FeSO4的质量为x。
Fe + H2SO4 = FeSO4 + H2↑
98 152
9.8t×20%
答:可生产FeSO4的质量是3.04t。
解得x=3.04t。
随堂演练
1.泉州是白蚂蚁的高发地区,白蚂蚁会蛀蚀木头,它分泌的蚁酸是一种酸,还能腐蚀很多建筑材料。下列建筑材料最不容易被白蚂蚁腐蚀的是( )
A.钢筋 B.铜制品 C.大理石 D.铝合金
B
主要成分是铁
主要成分是铝
主要成分是碳酸钙
0.00
课后作业
6
+
+
课后作业
完成学生用书本课时的习题
谢 谢 大 家!
THANK YOU
同课章节目录
