2.1.2钠的几种化合物 课件(共41张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 2.1.2钠的几种化合物 课件(共41张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 156.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-22 23:46:34 | ||
图片预览




文档简介
(共41张PPT)
第二章 海水中的重要元素——钠和氯
第1节 钠及其化合物
第2课时 钠的几种化合物
运用比较的方法研究氧化钠和过氧化钠、碳酸钠和碳酸氢钠的性质及其差异,掌握其在生产生活中的用途。
通过探究碳酸钠和碳酸氢钠的性质,进一步体验科学探究过程,提高观察能力和分析问题能力。
通过对纯碱的生产历史的学习,感受化学工业发展中技术进步的重要性,体会建设生态文明的意义。
学习目标
1. 过氧化钠与水、与CO2反应的化学方程式
2. 碳酸钠和碳酸氢钠的性质差异
1.碳酸钠和碳酸氢钠的性质差异实验探究
2. 从物质组成差异认识物质的性质的思路
本节重难点
本节重点
本节难点
氧化钠与过氧化钠
Na2O2
Na2O
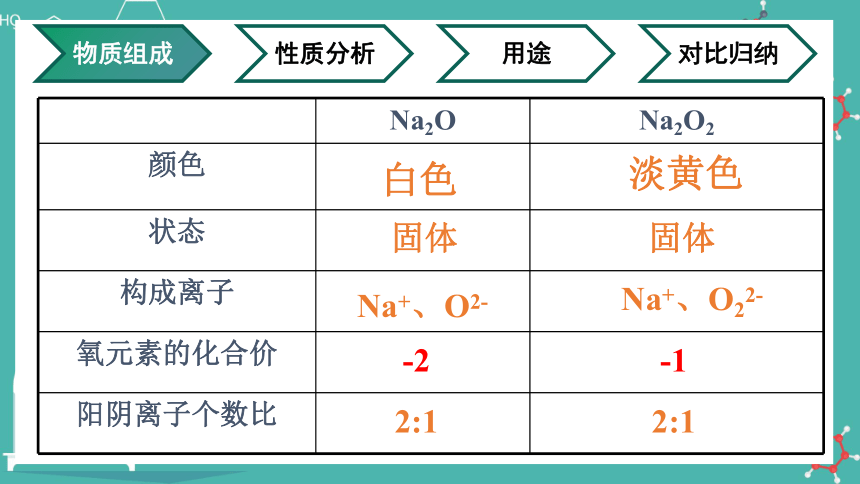
Na2O Na2O2
颜色
状态
构成离子
氧元素的化合价
阳阴离子个数比
白色
固体
固体
淡黄色
Na+、O2-
Na+、O22-
2:1
2:1
-2
-1
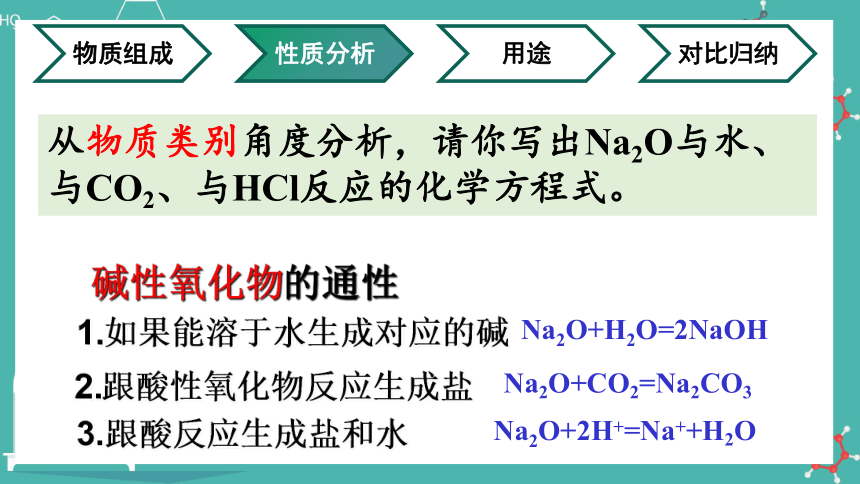
从物质类别角度分析,请你写出Na2O与水、与CO2、与HCl反应的化学方程式。
碱性氧化物的通性
1.如果能溶于水生成对应的碱
3.跟酸反应生成盐和水
2.跟酸性氧化物反应生成盐
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
Na2O+2H+=Na++H2O
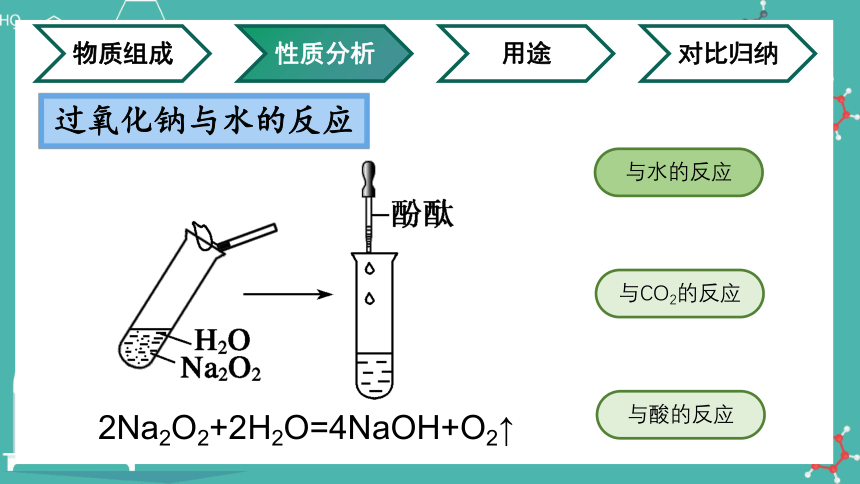
过氧化钠与水的反应
与水的反应
与CO2的反应
与酸的反应
2Na2O2+2H2O=4NaOH+O2↑
过氧化钠与水的反应
与水的反应
与CO2的反应
与酸的反应
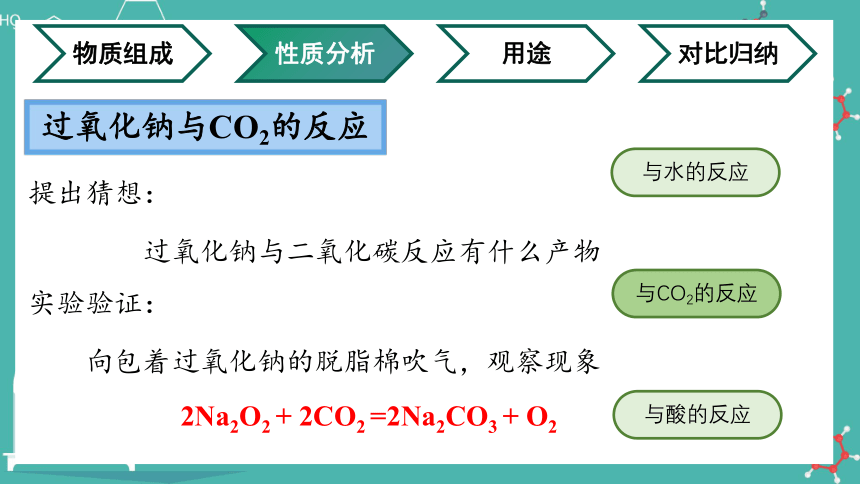
过氧化钠与CO2的反应
提出猜想:
过氧化钠与二氧化碳反应有什么产物
实验验证:
向包着过氧化钠的脱脂棉吹气,观察现象
2Na2O2 + 2CO2 =2Na2CO3 + O2
与水的反应
与CO2的反应
与酸的反应
与水的反应
与CO2的反应
与酸的反应
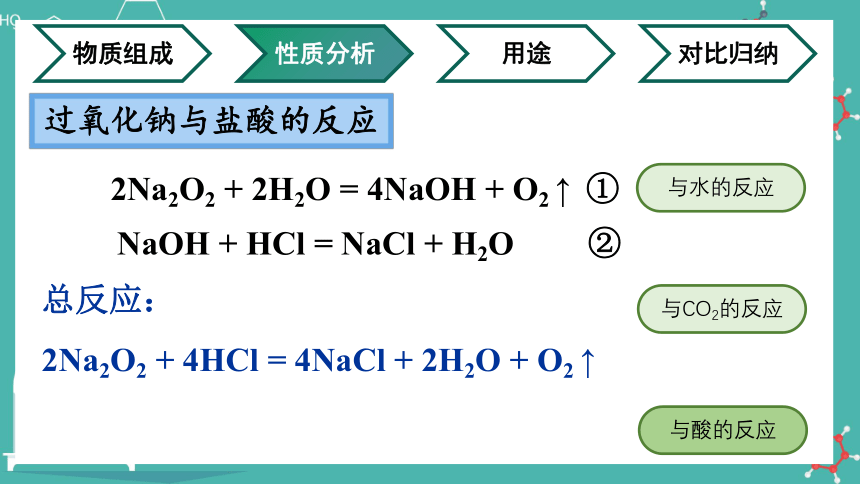
NaOH + HCl = NaCl + H2O ②
2Na2O2 + 2H2O = 4NaOH + O2 ↑ ①
总反应:
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2 ↑
与水的反应
与CO2的反应
与酸的反应
过氧化钠与盐酸的反应
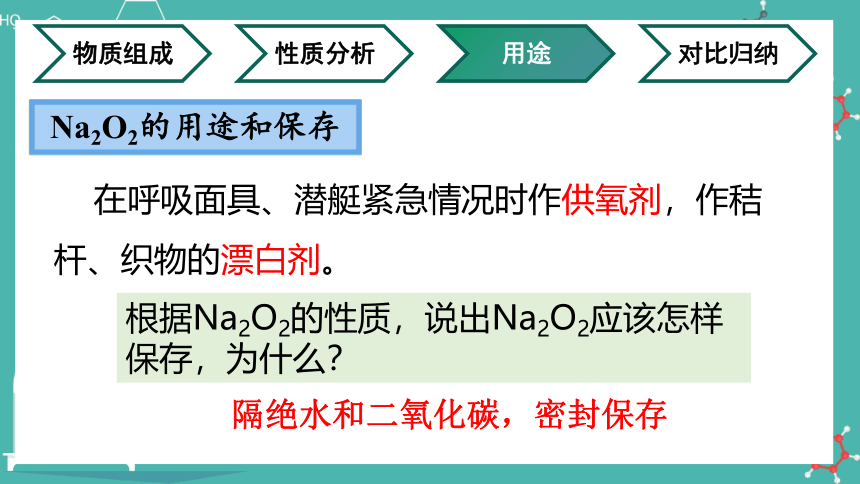
Na2O2的用途和保存
在呼吸面具、潜艇紧急情况时作供氧剂,作秸杆、织物的漂白剂。
根据Na2O2的性质,说出Na2O2应该怎样保存,为什么?
隔绝水和二氧化碳,密封保存
物质 氧化钠Na2O 过氧化钠Na2O2
颜色 白色 淡黄色
氧元素的化合价 -2 -1
阳阴离子个数比 2:1 2:1
与H2O反应
与CO2反应
与H+反应
用途 制备烧碱 漂白剂、强氧化剂、供氧剂
Na2O+H2O=2NaOH
2Na2O2 + 2H2O =
4NaOH + O2↑
Na2O+CO2=Na2CO3
2Na2O2 + 2CO2 =2Na2CO3 + O2
Na2O+2H+=Na++H2O
2Na2O2 + 4H+ =4Na++2H2O + O2↑
碳酸钠与碳酸氢钠
Na2CO3
NaHCO3
第 * 页
在面粉发酵或油条制作过程中,经常会用到发酵粉和食用碱,它们的主要成分是什么,俗称什么?
碳酸氢钠
小苏打
碳酸钠
苏打
天然碱
我国已发现天然碱矿产地有152处,储量近4亿吨。其中内蒙古的碱湖最多。现在内蒙古的很多工厂采用天然碱为原料生产烧碱、纯碱和小苏打。
天然碱来自于碱湖和碱矿。主要成分是碳酸钠、碳酸氢钠,还含有少量杂质(如氯化钠)。
碳酸钠(Na2CO3)
碳酸氢钠(NaHCO3)
化学名称 碳酸钠 碳酸氢钠
俗 称
化学式 无水物 结晶水合物
色 态
溶解性 纯碱、苏打
小苏打
Na2CO3
Na2CO3 10H2O
NaHCO3
白色粉末
白色晶体
无色晶体
Na2CO3 >
NaHCO3
碳酸钠、碳酸氢钠的物理性质
溶解性与碱性
步骤 Na2CO3 NaHCO3
①
②
③
初步结论
仍有固体残留
溶液变微红色
白色粉未,加水结块成晶体,放热
白色粉未,加水部分溶解,感受不到热量变化
振荡长时间可溶解
溶液变红色
1.溶解过程放热
2.易溶于水
3.溶液显碱性
1.溶解过程微弱放热
2.易溶于水,但溶解度比Na2CO3小
3.溶液显碱性,但碱性比Na2CO3弱
2、与稀盐酸的反应
2、与稀盐酸的反应
因此可以用稀盐酸可以区分碳酸钠和碳酸氢钠
①向碳酸钠溶液滴加稀盐酸:开始没有气泡,过一会才产生气泡,即反应分为两个阶段:
Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2 ↑
②向碳酸氢钠溶液滴加稀盐酸:立即有大量气泡产生
NaHCO3+HCl=NaCl+H2O+CO2 ↑
3、热稳定性
碳酸钠 碳酸氢钠
溶解性 Na2CO3 NaHCO3 PH Na2CO3 NaHCO3 与盐酸的反应 反应速率Na2CO3 NaHCO3 热稳定性 Na2CO3 NaHCO3 >
>
>
<
玻璃纤维
肥皂
造纸
Na2CO3的用途
制玻璃、纺织等等
NaHCO3的用途
制作泡沫灭火器
用于治疗胃酸过多
发酵粉的主要成分
碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3) 俗名 纯碱、苏打 小苏打 颜色状态 白色粉末 细小白色晶体 溶解性 水溶液碱性强弱 热稳定性
与酸反应
相互转化关系 稳定,加热不分解
Na2CO3>NaHCO3
Na2CO3>NaHCO3
CO32-+2H+=H2O+CO2↑
HCO3-+H+=H2O+CO2↑
2NaHCO3=Na2CO3+H2O+CO2↑
△
碳酸钠与碳酸氢钠的比较
Na2CO3
NaHCO3
/ NaOH
△
/ HCl
H2O + CO2
2NaHCO3=Na2CO3+H2O+CO2↑
NaHCO3 + NaOH= Na2CO3 + H2O
Na2CO3 + H2O + CO2 = 2NaHCO3
Na2CO3 + HCl = NaHCO3 + NaCl
Δ
实验方案 实验现象 结论
区别碳酸钠和碳酸氢钠的实验
NaHCO3受热分解,澄清石灰水变浑浊,Na2CO3则无
NaHCO3受热易分解Na2CO3稳定
分别加热NaHCO3固体和Na2CO3固体
NaHCO3与盐酸反应比Na2CO3剧烈,都放出气体
NaHCO3、 Na2CO3均能与盐酸反应,但NaHCO3反应剧烈
碳酸钠的pH值大于碳酸氢钠的pH
同浓度时Na2CO3溶液的碱性强于NaHCO3
用pH试纸测量相同浓度的溶液的pH值
滴加CaCl2溶液
碳酸钠溶液产生白色沉淀
Na2CO3产生白色沉淀,NaHCO3不反应
滴加Ca(OH)2溶液
均产生白色沉淀
都发生反应,生成白色沉淀
滴加相同浓度的盐酸
侯德榜与“侯氏制碱法”
1943年,中国化学工程师学会一致同意,将一种新的联合制碱法命名为“侯氏联合制碱法”。侯氏指的是侯德榜,此时他已是年逾半百,距离他受邀归国已过去了20余年。1921年,刚过而立之年的侯德榜踏上了回国的旅程,应爱国实业家范旭东的邀请,出任永利碱业公司的总工程师。
作为工业中不可缺少的重要原料,纯碱(碳酸钠)的用途很广泛,最初人们从盐碱地或盐湖中获取,但远远满足不了工业生产的需要。1862年,比利时人索尔维用食盐、氨、二氧化碳为原材料,成功制取了碳酸钠。
侯氏制碱法
侯德榜
资料卡片
侯德榜就任总工程师后,全身心地投入到制碱工艺和设备的改进上,终于摸索出了索尔维法的各项生产技术。1924年8月,塘沽碱厂正式投产。1926年,中国生产的“红三角”牌纯碱在美国费城的万国博览会上获得金质奖章。在范旭东先生的赞同支持下,侯德榜将他摸索出的制碱方法写成专著,公诸于世。该书1933年由美国化学会出版,轰动了科学界,被誉为首创的制碱名著,为祖国争得了荣誉。
资料卡片
侯氏制碱法
先将NH3通入饱和氯化钠溶液中,然后再将CO2通入上述溶液,充分反应后进行过滤,洗涤滤液,加热滤渣即得到纯碱。
CO 在NaCl中的溶解度很小,先通入NH 使食盐水显碱性,能够吸收大量CO 气体,产生高浓度的HCO -,才能析出NaHCO 晶体。
NH3+CO2+H2O+NaCl=NaHCO3+NH4Cl
2NaHCO3=Na2CO3+H2O+CO2
Δ
资料卡片
侯氏制碱法
根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。教材p38【实验2-6】
焰色试验
烧
蘸
烧
洗
烧
铂丝/铁丝
盐酸
观察火焰颜色
蘸取试样
烧至无色
资料卡片
焰色试验
金属元素 锂 钠 钾 钙 锶 钡 铜
颜色 紫红色 黄色 紫色(透过蓝色钴玻璃) 砖红色 洋红色 黄绿色 绿色
鉴别金属元素的存在,属于物理方法
蓝色钴玻璃是为了滤去黄光
资料卡片
1.检验烧碱溶液里是否含有少量纯碱的方法是( )
A.加少量的盐酸看是否有气体产生
B.加过量的盐酸看是否有气体产生
C.加热看是否有气体生成
D.加入氯化镁溶液看是否有沉淀产生
B
课堂小练
2.某物质灼烧,焰色反应为黄色,下列判断正确的( )
A.该物质一定是钠的化合物
B.该物质一定是含钠元素
C.该物质一定是金属钠
D.不能确定该物质是否含钾元素
B
课堂小练
3.老面是指发面的面种子,北方叫面引子,也有的地方叫面头(酵头)。老面就是发面蒸馒头时剩下一小团面,由于里面有很多酵母菌,下次发面的时候可作为菌种用。这种用上次发酵的面做菌种发面蒸的馒头就叫老面馒头。老面在保存过程中往往会同时有乳酸菌存在,发的时间稍长就会有独特的酸味出现,故用老面发面蒸馒头时需要加食用碱来中和其酸味。老面能使馒头变得蓬松多孔,其原理是什么
课堂小练
课堂小练
提示:面团在老面中的酵母菌以及其他一定数量和种类的微生物的共同作用下发生反应,生成二氧化碳、乳酸、醋酸、乙醇等物质,其中二氧化碳能使面团呈海绵状。
钠的重要化合物
氧化钠
过氧化纳
色、态
化学性质
白色固体
色、态
化学性质
与H2O反应
与CO2反应
淡黄色固体
用途
供氧剂
漂白剂
与H2O反应
与CO2反应
碳酸钠
碳酸氢钠
白色粉末
易溶于水
热稳定性好
与HCl反应较快
与NaOH不反应
白色晶体
较易溶于水
热稳定性差
与HCl反应剧烈
与NaOH反应
课堂小结
课堂小结
第二章 海水中的重要元素——钠和氯
第1节 钠及其化合物
第2课时 钠的几种化合物
运用比较的方法研究氧化钠和过氧化钠、碳酸钠和碳酸氢钠的性质及其差异,掌握其在生产生活中的用途。
通过探究碳酸钠和碳酸氢钠的性质,进一步体验科学探究过程,提高观察能力和分析问题能力。
通过对纯碱的生产历史的学习,感受化学工业发展中技术进步的重要性,体会建设生态文明的意义。
学习目标
1. 过氧化钠与水、与CO2反应的化学方程式
2. 碳酸钠和碳酸氢钠的性质差异
1.碳酸钠和碳酸氢钠的性质差异实验探究
2. 从物质组成差异认识物质的性质的思路
本节重难点
本节重点
本节难点
氧化钠与过氧化钠
Na2O2
Na2O
Na2O Na2O2
颜色
状态
构成离子
氧元素的化合价
阳阴离子个数比
白色
固体
固体
淡黄色
Na+、O2-
Na+、O22-
2:1
2:1
-2
-1
从物质类别角度分析,请你写出Na2O与水、与CO2、与HCl反应的化学方程式。
碱性氧化物的通性
1.如果能溶于水生成对应的碱
3.跟酸反应生成盐和水
2.跟酸性氧化物反应生成盐
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
Na2O+2H+=Na++H2O
过氧化钠与水的反应
与水的反应
与CO2的反应
与酸的反应
2Na2O2+2H2O=4NaOH+O2↑
过氧化钠与水的反应
与水的反应
与CO2的反应
与酸的反应
过氧化钠与CO2的反应
提出猜想:
过氧化钠与二氧化碳反应有什么产物
实验验证:
向包着过氧化钠的脱脂棉吹气,观察现象
2Na2O2 + 2CO2 =2Na2CO3 + O2
与水的反应
与CO2的反应
与酸的反应
与水的反应
与CO2的反应
与酸的反应
NaOH + HCl = NaCl + H2O ②
2Na2O2 + 2H2O = 4NaOH + O2 ↑ ①
总反应:
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2 ↑
与水的反应
与CO2的反应
与酸的反应
过氧化钠与盐酸的反应
Na2O2的用途和保存
在呼吸面具、潜艇紧急情况时作供氧剂,作秸杆、织物的漂白剂。
根据Na2O2的性质,说出Na2O2应该怎样保存,为什么?
隔绝水和二氧化碳,密封保存
物质 氧化钠Na2O 过氧化钠Na2O2
颜色 白色 淡黄色
氧元素的化合价 -2 -1
阳阴离子个数比 2:1 2:1
与H2O反应
与CO2反应
与H+反应
用途 制备烧碱 漂白剂、强氧化剂、供氧剂
Na2O+H2O=2NaOH
2Na2O2 + 2H2O =
4NaOH + O2↑
Na2O+CO2=Na2CO3
2Na2O2 + 2CO2 =2Na2CO3 + O2
Na2O+2H+=Na++H2O
2Na2O2 + 4H+ =4Na++2H2O + O2↑
碳酸钠与碳酸氢钠
Na2CO3
NaHCO3
第 * 页
在面粉发酵或油条制作过程中,经常会用到发酵粉和食用碱,它们的主要成分是什么,俗称什么?
碳酸氢钠
小苏打
碳酸钠
苏打
天然碱
我国已发现天然碱矿产地有152处,储量近4亿吨。其中内蒙古的碱湖最多。现在内蒙古的很多工厂采用天然碱为原料生产烧碱、纯碱和小苏打。
天然碱来自于碱湖和碱矿。主要成分是碳酸钠、碳酸氢钠,还含有少量杂质(如氯化钠)。
碳酸钠(Na2CO3)
碳酸氢钠(NaHCO3)
化学名称 碳酸钠 碳酸氢钠
俗 称
化学式 无水物 结晶水合物
色 态
溶解性 纯碱、苏打
小苏打
Na2CO3
Na2CO3 10H2O
NaHCO3
白色粉末
白色晶体
无色晶体
Na2CO3 >
NaHCO3
碳酸钠、碳酸氢钠的物理性质
溶解性与碱性
步骤 Na2CO3 NaHCO3
①
②
③
初步结论
仍有固体残留
溶液变微红色
白色粉未,加水结块成晶体,放热
白色粉未,加水部分溶解,感受不到热量变化
振荡长时间可溶解
溶液变红色
1.溶解过程放热
2.易溶于水
3.溶液显碱性
1.溶解过程微弱放热
2.易溶于水,但溶解度比Na2CO3小
3.溶液显碱性,但碱性比Na2CO3弱
2、与稀盐酸的反应
2、与稀盐酸的反应
因此可以用稀盐酸可以区分碳酸钠和碳酸氢钠
①向碳酸钠溶液滴加稀盐酸:开始没有气泡,过一会才产生气泡,即反应分为两个阶段:
Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2 ↑
②向碳酸氢钠溶液滴加稀盐酸:立即有大量气泡产生
NaHCO3+HCl=NaCl+H2O+CO2 ↑
3、热稳定性
碳酸钠 碳酸氢钠
溶解性 Na2CO3 NaHCO3 PH Na2CO3 NaHCO3 与盐酸的反应 反应速率Na2CO3 NaHCO3 热稳定性 Na2CO3 NaHCO3 >
>
>
<
玻璃纤维
肥皂
造纸
Na2CO3的用途
制玻璃、纺织等等
NaHCO3的用途
制作泡沫灭火器
用于治疗胃酸过多
发酵粉的主要成分
碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3) 俗名 纯碱、苏打 小苏打 颜色状态 白色粉末 细小白色晶体 溶解性 水溶液碱性强弱 热稳定性
与酸反应
相互转化关系 稳定,加热不分解
Na2CO3>NaHCO3
Na2CO3>NaHCO3
CO32-+2H+=H2O+CO2↑
HCO3-+H+=H2O+CO2↑
2NaHCO3=Na2CO3+H2O+CO2↑
△
碳酸钠与碳酸氢钠的比较
Na2CO3
NaHCO3
/ NaOH
△
/ HCl
H2O + CO2
2NaHCO3=Na2CO3+H2O+CO2↑
NaHCO3 + NaOH= Na2CO3 + H2O
Na2CO3 + H2O + CO2 = 2NaHCO3
Na2CO3 + HCl = NaHCO3 + NaCl
Δ
实验方案 实验现象 结论
区别碳酸钠和碳酸氢钠的实验
NaHCO3受热分解,澄清石灰水变浑浊,Na2CO3则无
NaHCO3受热易分解Na2CO3稳定
分别加热NaHCO3固体和Na2CO3固体
NaHCO3与盐酸反应比Na2CO3剧烈,都放出气体
NaHCO3、 Na2CO3均能与盐酸反应,但NaHCO3反应剧烈
碳酸钠的pH值大于碳酸氢钠的pH
同浓度时Na2CO3溶液的碱性强于NaHCO3
用pH试纸测量相同浓度的溶液的pH值
滴加CaCl2溶液
碳酸钠溶液产生白色沉淀
Na2CO3产生白色沉淀,NaHCO3不反应
滴加Ca(OH)2溶液
均产生白色沉淀
都发生反应,生成白色沉淀
滴加相同浓度的盐酸
侯德榜与“侯氏制碱法”
1943年,中国化学工程师学会一致同意,将一种新的联合制碱法命名为“侯氏联合制碱法”。侯氏指的是侯德榜,此时他已是年逾半百,距离他受邀归国已过去了20余年。1921年,刚过而立之年的侯德榜踏上了回国的旅程,应爱国实业家范旭东的邀请,出任永利碱业公司的总工程师。
作为工业中不可缺少的重要原料,纯碱(碳酸钠)的用途很广泛,最初人们从盐碱地或盐湖中获取,但远远满足不了工业生产的需要。1862年,比利时人索尔维用食盐、氨、二氧化碳为原材料,成功制取了碳酸钠。
侯氏制碱法
侯德榜
资料卡片
侯德榜就任总工程师后,全身心地投入到制碱工艺和设备的改进上,终于摸索出了索尔维法的各项生产技术。1924年8月,塘沽碱厂正式投产。1926年,中国生产的“红三角”牌纯碱在美国费城的万国博览会上获得金质奖章。在范旭东先生的赞同支持下,侯德榜将他摸索出的制碱方法写成专著,公诸于世。该书1933年由美国化学会出版,轰动了科学界,被誉为首创的制碱名著,为祖国争得了荣誉。
资料卡片
侯氏制碱法
先将NH3通入饱和氯化钠溶液中,然后再将CO2通入上述溶液,充分反应后进行过滤,洗涤滤液,加热滤渣即得到纯碱。
CO 在NaCl中的溶解度很小,先通入NH 使食盐水显碱性,能够吸收大量CO 气体,产生高浓度的HCO -,才能析出NaHCO 晶体。
NH3+CO2+H2O+NaCl=NaHCO3+NH4Cl
2NaHCO3=Na2CO3+H2O+CO2
Δ
资料卡片
侯氏制碱法
根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。教材p38【实验2-6】
焰色试验
烧
蘸
烧
洗
烧
铂丝/铁丝
盐酸
观察火焰颜色
蘸取试样
烧至无色
资料卡片
焰色试验
金属元素 锂 钠 钾 钙 锶 钡 铜
颜色 紫红色 黄色 紫色(透过蓝色钴玻璃) 砖红色 洋红色 黄绿色 绿色
鉴别金属元素的存在,属于物理方法
蓝色钴玻璃是为了滤去黄光
资料卡片
1.检验烧碱溶液里是否含有少量纯碱的方法是( )
A.加少量的盐酸看是否有气体产生
B.加过量的盐酸看是否有气体产生
C.加热看是否有气体生成
D.加入氯化镁溶液看是否有沉淀产生
B
课堂小练
2.某物质灼烧,焰色反应为黄色,下列判断正确的( )
A.该物质一定是钠的化合物
B.该物质一定是含钠元素
C.该物质一定是金属钠
D.不能确定该物质是否含钾元素
B
课堂小练
3.老面是指发面的面种子,北方叫面引子,也有的地方叫面头(酵头)。老面就是发面蒸馒头时剩下一小团面,由于里面有很多酵母菌,下次发面的时候可作为菌种用。这种用上次发酵的面做菌种发面蒸的馒头就叫老面馒头。老面在保存过程中往往会同时有乳酸菌存在,发的时间稍长就会有独特的酸味出现,故用老面发面蒸馒头时需要加食用碱来中和其酸味。老面能使馒头变得蓬松多孔,其原理是什么
课堂小练
课堂小练
提示:面团在老面中的酵母菌以及其他一定数量和种类的微生物的共同作用下发生反应,生成二氧化碳、乳酸、醋酸、乙醇等物质,其中二氧化碳能使面团呈海绵状。
钠的重要化合物
氧化钠
过氧化纳
色、态
化学性质
白色固体
色、态
化学性质
与H2O反应
与CO2反应
淡黄色固体
用途
供氧剂
漂白剂
与H2O反应
与CO2反应
碳酸钠
碳酸氢钠
白色粉末
易溶于水
热稳定性好
与HCl反应较快
与NaOH不反应
白色晶体
较易溶于水
热稳定性差
与HCl反应剧烈
与NaOH反应
课堂小结
课堂小结
