1.2.1 反应热的计算 课件(共76张PPT)23-24学年化学人教版高二选择性必修第一册课件
文档属性
| 名称 | 1.2.1 反应热的计算 课件(共76张PPT)23-24学年化学人教版高二选择性必修第一册课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-22 23:58:22 | ||
图片预览








文档简介
(共76张PPT)
第一章 第二节
第1课时 反应热的计算
1.变化观念与平衡思想:能认识化学变化的本质是有新物质生成并伴随能量的
转化,并遵循盖斯定律。
2.证据推理与模型认知:构建盖斯定律模型,理解盖斯定律的本质,能运用模
型进行相关判断或计算。
核心素养
发展目标
一、盖斯定律
二、反应热的计算
课时对点练
内容索引
盖斯定律
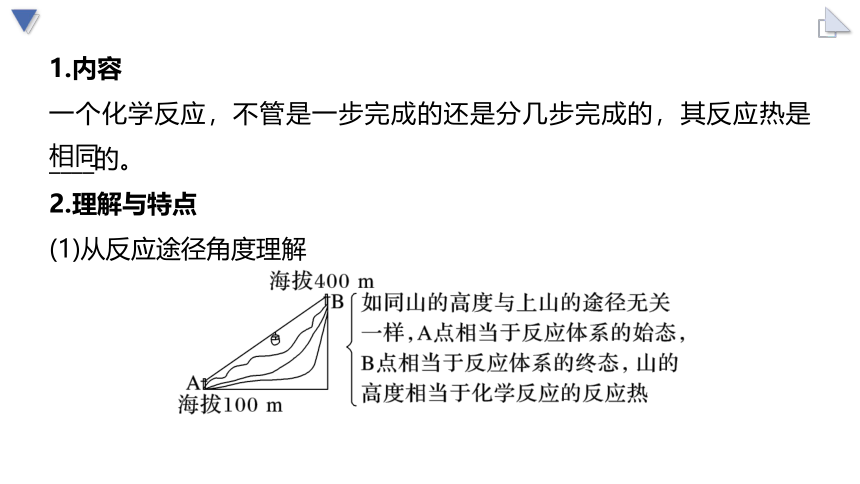
1.内容
一个化学反应,不管是一步完成的还是分几步完成的,其反应热是____的。
2.理解与特点
(1)从反应途径角度理解
相同
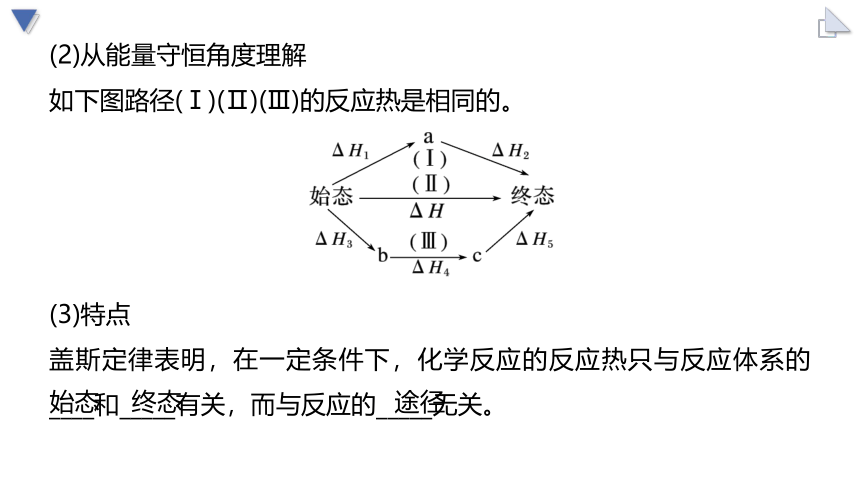
(2)从能量守恒角度理解
如下图路径(Ⅰ)(Ⅱ)(Ⅲ)的反应热是相同的。
(3)特点
盖斯定律表明,在一定条件下,化学反应的反应热只与反应体系的____和_____有关,而与反应的_____无关。
始态
终态
途径
3.意义
应用盖斯定律可以间接计算出反应很慢的或不容易直接发生的或者伴有副反应发生的反应的反应热。
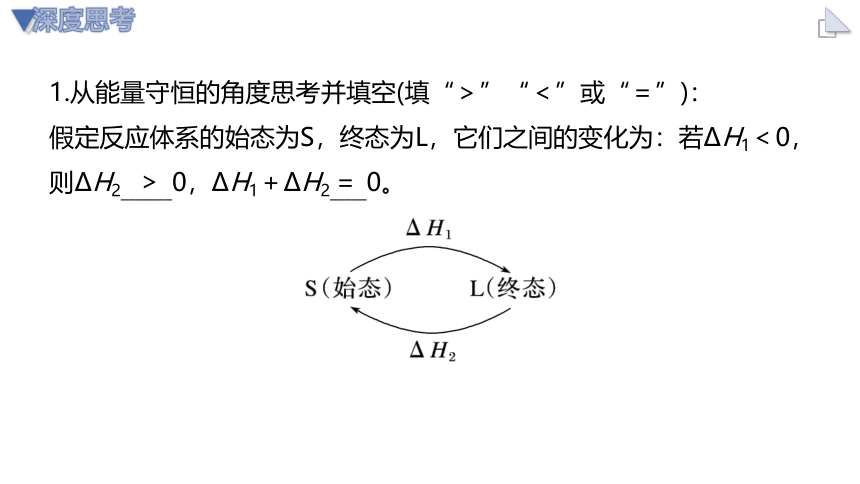
1.从能量守恒的角度思考并填空(填“>”“<”或“=”):
假定反应体系的始态为S,终态为L,它们之间的变化为:若ΔH1<0,则ΔH2_______0,ΔH1+ΔH2_____0。
深度思考
>
=
深度思考
2.(1)能直接测出反应C(s)+ O2(g)===CO(g)的反应热ΔH吗?为什么?
提示 不能直接测出。在氧气供应不足时,虽可生成CO,但同时还有部分CO可继续被氧化生成CO2。
深度思考
(2)已知:Ⅰ.C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
Ⅱ.CO(g)+ O2(g)===CO2(g) ΔH2=-283.0 kJ·mol-1
如何根据上述两个反应,计算C(s)+ O2(g)===CO(g)的反应热ΔH。
提示 ①虚拟路径法
反应C(s)+O2(g)===CO2(g)的途径可设计如下:
深度思考
则ΔH=ΔH1-ΔH2=-110.5 kJ·mol-1。
②加合法
分析:找唯一:C、CO分别在Ⅰ、Ⅱ中出现一次
同侧加:C是Ⅰ中反应物,为同侧,则“+Ⅰ”
异侧减:CO是Ⅱ中反应物,为异侧,则“-Ⅱ”
调化学计量数:化学计量数相同,不用调整,则Ⅰ-Ⅱ即为运算式。所以ΔH=ΔH1-ΔH2=-110.5 kJ·mol-1。
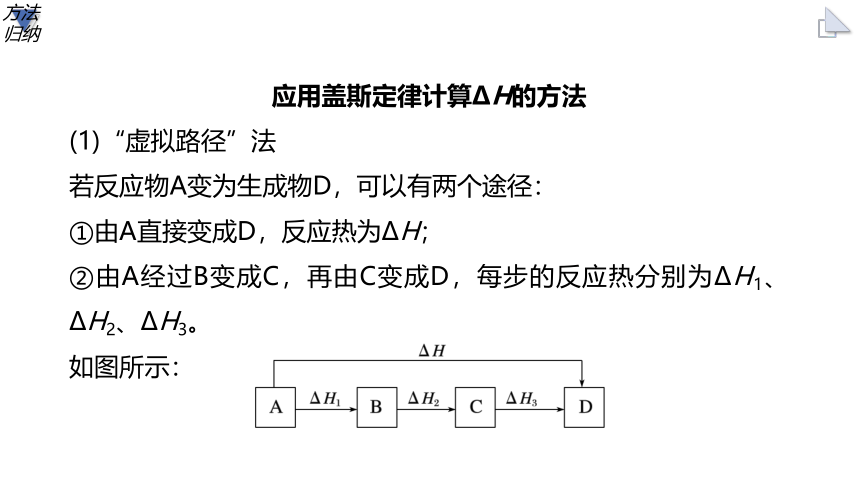
应用盖斯定律计算ΔH的方法
(1)“虚拟路径”法
若反应物A变为生成物D,可以有两个途径:
①由A直接变成D,反应热为ΔH;
②由A经过B变成C,再由C变成D,每步的反应热分别为ΔH1、ΔH2、ΔH3。
如图所示:
方法归纳
则:ΔH=ΔH1+ΔH2+ΔH3。
(2)加合法
依据目标方程式中各物质的位置和化学计量数,调整已知方程式,最终加合成目标方程式,ΔH同时作出相应的调整和运算。
方法归纳
应用体验
1.已知:P4(s,白磷)+5O2(g)===P4O10(s) ΔH1
设计成如下转化路径,请填空:
ΔH1
4ΔH2
则ΔH=____________。
ΔH1-4ΔH2
应用体验
2.已知25 ℃、101 kPa下,1 mol水蒸发为水蒸气需要吸热44.01 kJ,
2H2O(l)===2H2(g)+O2(g) ΔH=+571.66 kJ·mol-1
C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.29 kJ·mol-1
(1)1 mol水蒸发为水蒸气的热化学方程式为______________________________________________________________________________________________
______________________________________________________________。
H2O(l)===H2O(g) ΔH=
+44.01 kJ·mol-1
应用体验
(2)计算出反应C(s)+ O2(g)===CO(g)的反应热(写出计算过程)。
答案 由①H2O(l)===H2O(g) ΔH=+44.01 kJ·mol-1,
②2H2O(l)===2H2(g)+O2(g) ΔH=+571.66 kJ·mol-1,
③C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.29 kJ·mol-1,
利用盖斯定律计算ΔH的四步骤
(1)定:确定待求反应的热化学方程式。
(2)找:找出待求热化学方程式中只在已知化学方程式中出现一次的物质。
(3)调:依据该物质调整已知化学方程式的方向(同侧相加,异侧相减)和化学计量数,每个已知化学方程式只能调整一次。
(4)算:ΔH与化学方程式一一对应调整和运算。
思维建模
返回
二
反应热的计算
1.根据热化学方程式计算
热化学方程式中反应热数值与各物质的化学计量数成正比。例如,
aA(g)+bB(g)===cC(g)+dD(g) ΔH
a b c d |ΔH|
n(A) n(B) n(C) n(D) Q
例1
蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。甲烷气体燃烧的热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=-890.3 kJ·mol-1,则320 g“可燃冰”(分子式为CH4·8H2O)释放的甲烷气体完全燃烧生成二氧化碳气体和液态水时放出的热量为_________。
1 780.6 kJ
320 g CH4·8H2O中甲烷的物质的量为2 mol,2 mol甲烷气体完全燃烧生成二氧化碳气体和液态水时放出的热量为1 780.6 kJ。
2.根据物质的燃烧热数值计算
Q(放)=n(可燃物)×|ΔH(燃烧热)|。
家用液化气的主要成分之一是丁烷(C4H10)。常温常压下,丁烷的燃烧热ΔH=-2 900 kJ·mol-1,则1 g丁烷完全燃烧生成CO2气体和液态水时放出的热量为_______。
例2
50 kJ
3.根据反应物、生成物的键能计算
ΔH=E(反应物的键能总和)-E(生成物的键能总和)。
我国是世界上第二大乙烯生产国,乙烯可由乙烷裂解得到:C2H6(g)
C2H4(g)+H2(g),相关化学键的键能数据如下表所示,则上述反应的ΔH等于
例3
化学键 C—H C—C C==C H—H
键能/(kJ·mol-1) 412 348 612 436
A.-124 kJ·mol-1 B.+124 kJ·mol-1
C.-288 kJ·mol-1 D.+288 kJ·mol-1
√
4.根据图像计算
碳燃烧的过程如图所示:
则下列说法正确的是
A.1 mol C(s)与0.5 mol O2(g)的总能量小于1 mol
CO(g)的能量
B.CO2(g)===C(g)+O2(g) ΔH=+393.5 kJ·mol-1
C.2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1
D.等量的碳燃烧C(s)―→CO2(g)过程比C(s)―→CO(g)―→CO2(g)过程释
放的能量多
例4
√
因C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·
mol-1,所以CO2(g)===C(s)+O2(g) ΔH=+393.5 kJ·mol-1,故B错误;
根据盖斯定律可知,反应的反应热只与始态和终态有关,与过程无关,故D错误。
5.根据盖斯定律计算
将两个或两个以上的热化学方程式包括其ΔH相加或相减,得到一个新的热化学方程式及其ΔH。
工业上常利用CO2和NH3合成尿素[CO(NH2)2],该可逆反应分两步进行,整个过程中的能量变化如图所示。下列说法正确的是
A.NH2COONH4为合成尿素反应的中间产物
B.利用CO2和NH3合成尿素需要吸收能量
C.反应Ⅱ的ΔH=-E2
D.2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l)的焓变ΔH=E1-E2
例5
√
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·mol-1。
已知:碳的燃烧热ΔH1=a kJ·mol-1;
S(s)+2K(s)===K2S(s) ΔH2=b kJ·mol-1;
2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ·mol-1,则x为
A.3a+b-c B.c-3a-b
C.a+b-c D.c-a-b
例6
√
表示碳燃烧热的热化学方程式为①C(s)+O2(g)===CO2(g) ΔH1=a kJ·
mol-1,将另外两个热化学方程式进行编号,②S(s)+2K(s)===K2S(s) ΔH2=b kJ·mol-1,③2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ·
mol-1,运用盖斯定律,①×3+②-③得S(s)+2KNO3(s)+3C(s)===
K2S(s)+N2(g)+3CO2(g) ΔH=(3a+b-c) kJ·mol-1,则x=3a+b-c,故A正确。
返回
课时对点练
1
2
3
4
5
6
7
8
9
题组一 盖斯定律
1.下列关于盖斯定律的描述不正确的是
A.化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途
径有关
B.化学反应不管是一步完成还是分几步完成,其反应热是相同的
C.利用盖斯定律可间接计算通过实验难以测定的反应的反应热
D.利用盖斯定律可以计算有副反应发生的反应的反应热
√
10
11
12
13
14
15
对点训练
化学反应的反应热与反应的途径无关,依据盖斯定律可以比较方便地计算通过实验难以测定的反应和有副反应发生的反应的反应热。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2.假设反应体系的始态为甲,中间态为乙,终态为丙,它们之间的变化如图所示,则下列说法不正确的是
A.|ΔH1|>|ΔH2|
B.|ΔH1|<|ΔH3|
C.ΔH1+ΔH2+ΔH3=0
D.甲→丙的ΔH=ΔH1+ΔH2
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
题述过程中甲为始态,乙为中间态,丙为终态,由盖斯定律可知,甲→丙的ΔH=ΔH1+ΔH2,D项正确;
在题述过程中ΔH1与ΔH2的相对大小无法判断,A项错误;
由|ΔH3|=|ΔH1|+|ΔH2|知,|ΔH1|<|ΔH3|,B项正确;
从能量守恒的角度可知,ΔH1+ΔH2+ΔH3=0,C项正确。
2
3.在298 K、101 kPa时,有下列反应:
①O2(g)+2H2(g)===2H2O(g) ΔH1
②Cl2(g)+H2(g)===2HCl(g) ΔH2
③2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1、ΔH2的关系正确的是
A.ΔH3=ΔH1=ΔH2 B.ΔH3=ΔH1+2ΔH2
C.ΔH3=2ΔH2-ΔH1 D.ΔH3=ΔH1-ΔH2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
根据盖斯定律,由2×②-①可得③,则ΔH3=2ΔH2-ΔH1。
2
4.LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)===2LiH(s) ΔH=-182 kJ·mol-1
②2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1
③4Li(s)+O2(g)===2Li2O(s) ΔH=-1 196 kJ·mol-1
则反应2LiH(s)+O2(g)===Li2O(s)+H2O(l)的焓变为
A.+351 kJ·mol-1 B.-351 kJ·mol-1
C.+702 kJ·mol-1 D.-702 kJ·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
5.(2023·延安高二检测)2 mol金属钠和1 mol氯气反应的能量关系如图所示,下列说法不正确的是
A.ΔH2>0
B.ΔH4+ΔH5+ΔH8=ΔH1
C.在相同条件下,2K(g)―→2K+(g)的ΔH<ΔH3
D.ΔH6+ΔH7=ΔH8
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
Na(s)的能量低于Na(g),则ΔH2>0,A说法正确;
根据盖斯定律,ΔH1=ΔH2+ΔH3+ΔH4+ΔH5+ΔH8,B说法不正确;
Na的活泼性小于K,故K比Na更易失电子,失电子吸收的能量更小,在相同条件下,2K(g)―→2K+(g)的ΔH<ΔH3,C说法正确;
根据盖斯定律,ΔH6+ΔH7=ΔH8,D说法正确。
2
题组二 反应热的计算
6.CH4—CO2催化重整反应为CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH。
已知:①C(s)+2H2(g)===CH4(g) ΔH1=-75 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-394 kJ·mol-1
③C(s)+ O2(g)===CO(g) ΔH3=-111 kJ·mol-1
则ΔH为
A.-580 kJ·mol-1 B.+247 kJ·mol-1
C.+208 kJ·mol-1 D.-430 kJ·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
根据盖斯定律可得CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=2ΔH3-ΔH2-ΔH1=+247 kJ·mol-1。
2
7.已知:S2(s)===S2(g) ΔH=+4.5 kJ·mol-1。某些化学键的键能数据如表所示:
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
化学键 H—H Cl—Cl H—Cl S==S H—S
键能/ (kJ·mol-1) 436 243 431 255 339
下列说法正确的是
A.1 mol H2(g)与2 mol Cl2(g)反应生成HCl(g)时放出370 kJ热量
B.H2(g)与S2(s)反应生成H2S(g)的热化学方程式为2H2(g)+S2(s)===2H2S(g) ΔH
=-229 kJ·mol-1
C.反应的焓变ΔH=反应物的键能之和-生成物的键能之和
D.1 mol H2S(g)分解吸收的热量比1 mol HCl(g)分解吸收的热量多,所以H2S(g)
比HCl(g)稳定
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
A项,反应H2(g)+Cl2(g)===2HCl(g)的ΔH=E(Cl—Cl)+E(H—H)-2E(H—Cl)=(243 kJ·mol-1+436 kJ·mol-1)-2×431 kJ·mol-1=-183 kJ·
mol-1,当2 mol Cl2(g)与1 mol H2(g)反应时,只有1 mol Cl2(g)参加反应,所以放出的热量为183 kJ,错误;
B项,根据表中键能数据可得热化学方程式:2H2(g)+S2(g)===2H2S(g) ΔH=-229 kJ·mol-1,结合S2(s)===S2(g) ΔH=+4.5 kJ·mol-1可得热化学方程式:2H2(g)+S2(s)===2H2S(g) ΔH=-224.5 kJ·mol-1,错误;
D项,由于H—Cl的键能大于H—S,所以HCl(g)比H2S(g)稳定,错误。
2
8.(2023·重庆高二检测)已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-a kJ·mol-1
②H2(g)+ O2(g)===H2O(g) ΔH2=-b kJ·mol-1
③C(s)+ O2(g)===CO(g) ΔH3=-c kJ·mol-1
④C(s)+O2(g)===CO2(g) ΔH4=-d kJ·mol-1
下列说法正确的是
A.c>d
B.0.5a<b
C.氢气的燃烧热为ΔH=-b kJ·mol-1
D.CO(g)+ O2(g)===CO2(g) ΔH=-(d-c) kJ·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
CO燃烧生成CO2是放热反应,故C(s)不完全燃烧生成CO放出的热量少,即cH2完全燃烧的指定产物是H2O(l),不是H2O(g),C说法不正确;
2
9.氢卤酸的能量关系如图所示。下列说法正确的是
A.已知HF气体溶于水放热,则HF的ΔH1>0
B.相同条件下,HCl的ΔH2比HBr的小
C.相同条件下,HCl的(ΔH3+ΔH4)比HI的大
D.一定条件下,气态原子生成1 mol H—X放
出a kJ能量,则该条件下ΔH2=-a kJ·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
√
15
对点训练
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
由于HF气体溶于水放热,则HX(aq)―→
HX(g)吸收热量,故ΔH1>0,A正确;
由于HCl比HBr稳定,所以相同条件下HCl的ΔH2比HBr的大,B错误;
ΔH3+ΔH4代表H(g)―→H+(aq)的焓变,与是HCl的还是HI的无关,C错误;
一定条件下,气态原子形成1 mol H—X放出a kJ能量,则断开1 mol H—X形成气态原子吸收a kJ的能量,即ΔH2=+a kJ·mol-1,D错误。
2
10.肼(N2H4)在不同条件下分解产物不同,200 ℃时在Cu表面分解的机理如图甲所示。已知200 ℃时,反应Ⅰ:3N2H4(g)===N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1;反应Ⅱ:N2H4(g)+H2(g)===2NH3(g) ΔH2=
-41.8 kJ·mol-1。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
下列说法不正确的是
A.图甲所示过程①是放热反应
B.反应Ⅱ的能量变化示意图如图乙所示
C.断开3 mol N2H4(g)的化学键吸收的能量大于形成1 mol N2(g)和4 mol
NH3(g)的化学键释放的能量
D.200 ℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)===N2(g)
+2H2(g) ΔH=+50.7 kJ·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
对点训练
1
3
4
5
6
7
8
9
10
11
12
13
14
15
过程①是N2H4分解生成N2和NH3,已知热化学方程式Ⅰ中ΔH1为负值,所以过程①为放热反应,故A正确;
反应Ⅱ是放热反应,能量变化示意图正确,故B正确;
2
对点训练
1
3
4
5
6
7
8
9
10
11
12
13
14
15
放热反应中,反应物的化学键的键能之和小于生成物的化学键的键能之和,故C错误;
根据盖斯定律:Ⅰ-2×Ⅱ得N2H4(g)===N2(g)+2H2(g) ΔH=-32.9 kJ·
mol-1-2×(-41.8 kJ·mol-1)=+50.7 kJ·mol-1,故D正确。
2
11.已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1,CO(g)+
O2(g)===CO2(g) ΔH=-282.8 kJ·mol-1。现有CO、H2、CO2组成的混合气体67.2 L(标准状况下),经完全燃烧后放出的总热量为710.0 kJ,并生成18 g液态水,则燃烧前混合气体中CO的体积分数为
A.80% B.50%
C.60% D.20%
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
由于CO2在O2中不燃烧,
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
12.SO2的催化氧化反应是合成硫酸的重要步骤,下面是该反应中的能量变化示意图。已知:SO3(g)+H2O(l)===H2SO4(aq) ΔH4=-d kJ·mol-1,且a、b、c、d均为正值。下列说法错误的是
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
D.2SO2(g)+O2(g)+2H2O(l)===2H2SO4(aq) ΔH=-(c+d) kJ·mol-1
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
由盖斯定律可得2SO2(g)+O2(g)+2H2O(l)===2H2SO4(aq) ΔH=
-(c+2d) kJ·mol-1,D错误。
2
13.回答下列问题:
(1)中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
试写出25 ℃、101 kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的 热化学方程式:_______________________________________________
__________________。
8CO2(g)+25H2(g)===C8H18(l)+16H2O(l) ΔH=
-(25a-b) kJ·mol-1
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
根据盖斯定律,由①×25-②得8CO2(g)+25H2(g)===C8H18(l)+16H2O(l) ΔH=25ΔH1-ΔH2=-(25a-b) kJ·mol-1。
2
(2)化学反应原理研究物质转化过程中的规律并在生产生活中有广泛的应用。汽车排气管内的催化转化器可实现尾气无毒处理。
已知:N2(g)+O2(g)===2NO(g) ΔH=+180.5 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1
CO2(g)===C(s)+O2(g) ΔH=+393.5 kJ·mol-1
则反应2NO(g)+2CO(g)===N2(g)+2CO2(g)的ΔH=________ kJ·mol-1。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
-746.5
将反应从上到下依次编号为①②③,根据盖斯定律,由-(①+②+③×2)得反应2NO(g)+2CO(g)===N2(g)+2CO2(g)的ΔH=-746.5 kJ·mol-1。
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(3)合成氨在工业生产中具有重要意义。在合成氨工业中I2O5常用于定量测量CO的含量。已知:2I2(s)+5O2(g)===2I2O5(s) ΔH=-76 kJ·mol-1;2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1。则该测定反应的热化学方程式为____________________________________________________。
5CO(g)+I2O5(s)===5CO2(g)+I2(s) ΔH=-1 377 kJ·mol-1
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(4)氮及其化合物与人类生产、生活密切相关。氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:CO(g)+NO2(g)===NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)===N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用CO将NO2还原为N2,当消耗标准状况下3.36 L CO时,放出的热量
为_____________ kJ(用含有a和b的代数式表示,不用化简)。
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
14.为了合理利用化学能,确保安全生产,进行化工设计时需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常可以通过实验进行测定,也可通过理论进行推算。
(1)实验测得,5 g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ热量,则表示甲醇燃烧热的热化学方程式为
_______________________________________________________。
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
5 g CH3OH液体在氧气中充分燃烧生成CO2气体和液态水时放出113.5 kJ热量,
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)现有如下两个热化学方程式:
2H2(g)+O2(g)===2H2O(g) ΔH1=a kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=b kJ·mol-1
则a____ (填“>”“=”或“<”)b。
>
将两个热化学方程式进行比较,由于H2O由气态变成液态放出热量,故ΔH1>ΔH2,则a>b。
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键断裂和生成物的化学键形成的过程。在化学反应过程中,断裂化学键需要吸收能量,形成化学键又会释放能量。
已知:N2(g)+3H2(g) 2NH3(g) ΔH=a kJ·mol-1,根据上表中所列键能数据可计算出a=______。
-93
化学键 H—H N—H N≡N
键能/(kJ·mol-1) 436 391 945
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
15.CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式分别为①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1;
②2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1;
③C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1。
(1)在深海中存在一种甲烷细菌,它们依靠甲烷与O2在酶的催化作用下产生的能量存活,在甲烷细菌使1 mol甲烷生成CO2气体与液态水的过程中,放出的能量______(填“>”“<”或“=”)890.3 kJ。
=
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
反应热与反应条件无关,由CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,得到甲烷细菌使1 mol甲烷生成CO2气体与液态水放出的能量为890.3 kJ。
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)甲烷与CO2可用于生产合成气(主要成分是一氧化碳和氢气):CH4(g)+CO2(g) 2CO(g)+2H2(g),1 g CH4完全反应可释放15.46 kJ的热量,则:
①下图能表示该反应过程中能量变化的是_____(填字母)。
D
1 g CH4完全反应可释放15.46 kJ的热量,计算1 mol甲烷完全反应放出的热量为247.36 kJ,图D正确。
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化曲线如图所示,则CH4的转化率为______。
63%
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(3)C(s)与H2(g)很难发生反应,所以C(s)+2H2(g)===CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)===CH4(g)的反应热ΔH=______________。
-74.8 kJ·mol-1
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(4)目前对题干所述的三种物质的研究是燃料研究的重点,下列关于这三种物质的研究方向中可行的是____ (填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4反应生
产合成气(CO、H2)
D.用固态碳合成C60,以C60作为燃料
C
返回
2
第一章 第二节
第1课时 反应热的计算
1.变化观念与平衡思想:能认识化学变化的本质是有新物质生成并伴随能量的
转化,并遵循盖斯定律。
2.证据推理与模型认知:构建盖斯定律模型,理解盖斯定律的本质,能运用模
型进行相关判断或计算。
核心素养
发展目标
一、盖斯定律
二、反应热的计算
课时对点练
内容索引
盖斯定律
1.内容
一个化学反应,不管是一步完成的还是分几步完成的,其反应热是____的。
2.理解与特点
(1)从反应途径角度理解
相同
(2)从能量守恒角度理解
如下图路径(Ⅰ)(Ⅱ)(Ⅲ)的反应热是相同的。
(3)特点
盖斯定律表明,在一定条件下,化学反应的反应热只与反应体系的____和_____有关,而与反应的_____无关。
始态
终态
途径
3.意义
应用盖斯定律可以间接计算出反应很慢的或不容易直接发生的或者伴有副反应发生的反应的反应热。
1.从能量守恒的角度思考并填空(填“>”“<”或“=”):
假定反应体系的始态为S,终态为L,它们之间的变化为:若ΔH1<0,则ΔH2_______0,ΔH1+ΔH2_____0。
深度思考
>
=
深度思考
2.(1)能直接测出反应C(s)+ O2(g)===CO(g)的反应热ΔH吗?为什么?
提示 不能直接测出。在氧气供应不足时,虽可生成CO,但同时还有部分CO可继续被氧化生成CO2。
深度思考
(2)已知:Ⅰ.C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
Ⅱ.CO(g)+ O2(g)===CO2(g) ΔH2=-283.0 kJ·mol-1
如何根据上述两个反应,计算C(s)+ O2(g)===CO(g)的反应热ΔH。
提示 ①虚拟路径法
反应C(s)+O2(g)===CO2(g)的途径可设计如下:
深度思考
则ΔH=ΔH1-ΔH2=-110.5 kJ·mol-1。
②加合法
分析:找唯一:C、CO分别在Ⅰ、Ⅱ中出现一次
同侧加:C是Ⅰ中反应物,为同侧,则“+Ⅰ”
异侧减:CO是Ⅱ中反应物,为异侧,则“-Ⅱ”
调化学计量数:化学计量数相同,不用调整,则Ⅰ-Ⅱ即为运算式。所以ΔH=ΔH1-ΔH2=-110.5 kJ·mol-1。
应用盖斯定律计算ΔH的方法
(1)“虚拟路径”法
若反应物A变为生成物D,可以有两个途径:
①由A直接变成D,反应热为ΔH;
②由A经过B变成C,再由C变成D,每步的反应热分别为ΔH1、ΔH2、ΔH3。
如图所示:
方法归纳
则:ΔH=ΔH1+ΔH2+ΔH3。
(2)加合法
依据目标方程式中各物质的位置和化学计量数,调整已知方程式,最终加合成目标方程式,ΔH同时作出相应的调整和运算。
方法归纳
应用体验
1.已知:P4(s,白磷)+5O2(g)===P4O10(s) ΔH1
设计成如下转化路径,请填空:
ΔH1
4ΔH2
则ΔH=____________。
ΔH1-4ΔH2
应用体验
2.已知25 ℃、101 kPa下,1 mol水蒸发为水蒸气需要吸热44.01 kJ,
2H2O(l)===2H2(g)+O2(g) ΔH=+571.66 kJ·mol-1
C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.29 kJ·mol-1
(1)1 mol水蒸发为水蒸气的热化学方程式为______________________________________________________________________________________________
______________________________________________________________。
H2O(l)===H2O(g) ΔH=
+44.01 kJ·mol-1
应用体验
(2)计算出反应C(s)+ O2(g)===CO(g)的反应热(写出计算过程)。
答案 由①H2O(l)===H2O(g) ΔH=+44.01 kJ·mol-1,
②2H2O(l)===2H2(g)+O2(g) ΔH=+571.66 kJ·mol-1,
③C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.29 kJ·mol-1,
利用盖斯定律计算ΔH的四步骤
(1)定:确定待求反应的热化学方程式。
(2)找:找出待求热化学方程式中只在已知化学方程式中出现一次的物质。
(3)调:依据该物质调整已知化学方程式的方向(同侧相加,异侧相减)和化学计量数,每个已知化学方程式只能调整一次。
(4)算:ΔH与化学方程式一一对应调整和运算。
思维建模
返回
二
反应热的计算
1.根据热化学方程式计算
热化学方程式中反应热数值与各物质的化学计量数成正比。例如,
aA(g)+bB(g)===cC(g)+dD(g) ΔH
a b c d |ΔH|
n(A) n(B) n(C) n(D) Q
例1
蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。甲烷气体燃烧的热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=-890.3 kJ·mol-1,则320 g“可燃冰”(分子式为CH4·8H2O)释放的甲烷气体完全燃烧生成二氧化碳气体和液态水时放出的热量为_________。
1 780.6 kJ
320 g CH4·8H2O中甲烷的物质的量为2 mol,2 mol甲烷气体完全燃烧生成二氧化碳气体和液态水时放出的热量为1 780.6 kJ。
2.根据物质的燃烧热数值计算
Q(放)=n(可燃物)×|ΔH(燃烧热)|。
家用液化气的主要成分之一是丁烷(C4H10)。常温常压下,丁烷的燃烧热ΔH=-2 900 kJ·mol-1,则1 g丁烷完全燃烧生成CO2气体和液态水时放出的热量为_______。
例2
50 kJ
3.根据反应物、生成物的键能计算
ΔH=E(反应物的键能总和)-E(生成物的键能总和)。
我国是世界上第二大乙烯生产国,乙烯可由乙烷裂解得到:C2H6(g)
C2H4(g)+H2(g),相关化学键的键能数据如下表所示,则上述反应的ΔH等于
例3
化学键 C—H C—C C==C H—H
键能/(kJ·mol-1) 412 348 612 436
A.-124 kJ·mol-1 B.+124 kJ·mol-1
C.-288 kJ·mol-1 D.+288 kJ·mol-1
√
4.根据图像计算
碳燃烧的过程如图所示:
则下列说法正确的是
A.1 mol C(s)与0.5 mol O2(g)的总能量小于1 mol
CO(g)的能量
B.CO2(g)===C(g)+O2(g) ΔH=+393.5 kJ·mol-1
C.2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1
D.等量的碳燃烧C(s)―→CO2(g)过程比C(s)―→CO(g)―→CO2(g)过程释
放的能量多
例4
√
因C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·
mol-1,所以CO2(g)===C(s)+O2(g) ΔH=+393.5 kJ·mol-1,故B错误;
根据盖斯定律可知,反应的反应热只与始态和终态有关,与过程无关,故D错误。
5.根据盖斯定律计算
将两个或两个以上的热化学方程式包括其ΔH相加或相减,得到一个新的热化学方程式及其ΔH。
工业上常利用CO2和NH3合成尿素[CO(NH2)2],该可逆反应分两步进行,整个过程中的能量变化如图所示。下列说法正确的是
A.NH2COONH4为合成尿素反应的中间产物
B.利用CO2和NH3合成尿素需要吸收能量
C.反应Ⅱ的ΔH=-E2
D.2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l)的焓变ΔH=E1-E2
例5
√
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·mol-1。
已知:碳的燃烧热ΔH1=a kJ·mol-1;
S(s)+2K(s)===K2S(s) ΔH2=b kJ·mol-1;
2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ·mol-1,则x为
A.3a+b-c B.c-3a-b
C.a+b-c D.c-a-b
例6
√
表示碳燃烧热的热化学方程式为①C(s)+O2(g)===CO2(g) ΔH1=a kJ·
mol-1,将另外两个热化学方程式进行编号,②S(s)+2K(s)===K2S(s) ΔH2=b kJ·mol-1,③2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ·
mol-1,运用盖斯定律,①×3+②-③得S(s)+2KNO3(s)+3C(s)===
K2S(s)+N2(g)+3CO2(g) ΔH=(3a+b-c) kJ·mol-1,则x=3a+b-c,故A正确。
返回
课时对点练
1
2
3
4
5
6
7
8
9
题组一 盖斯定律
1.下列关于盖斯定律的描述不正确的是
A.化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途
径有关
B.化学反应不管是一步完成还是分几步完成,其反应热是相同的
C.利用盖斯定律可间接计算通过实验难以测定的反应的反应热
D.利用盖斯定律可以计算有副反应发生的反应的反应热
√
10
11
12
13
14
15
对点训练
化学反应的反应热与反应的途径无关,依据盖斯定律可以比较方便地计算通过实验难以测定的反应和有副反应发生的反应的反应热。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2.假设反应体系的始态为甲,中间态为乙,终态为丙,它们之间的变化如图所示,则下列说法不正确的是
A.|ΔH1|>|ΔH2|
B.|ΔH1|<|ΔH3|
C.ΔH1+ΔH2+ΔH3=0
D.甲→丙的ΔH=ΔH1+ΔH2
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
题述过程中甲为始态,乙为中间态,丙为终态,由盖斯定律可知,甲→丙的ΔH=ΔH1+ΔH2,D项正确;
在题述过程中ΔH1与ΔH2的相对大小无法判断,A项错误;
由|ΔH3|=|ΔH1|+|ΔH2|知,|ΔH1|<|ΔH3|,B项正确;
从能量守恒的角度可知,ΔH1+ΔH2+ΔH3=0,C项正确。
2
3.在298 K、101 kPa时,有下列反应:
①O2(g)+2H2(g)===2H2O(g) ΔH1
②Cl2(g)+H2(g)===2HCl(g) ΔH2
③2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1、ΔH2的关系正确的是
A.ΔH3=ΔH1=ΔH2 B.ΔH3=ΔH1+2ΔH2
C.ΔH3=2ΔH2-ΔH1 D.ΔH3=ΔH1-ΔH2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
根据盖斯定律,由2×②-①可得③,则ΔH3=2ΔH2-ΔH1。
2
4.LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)===2LiH(s) ΔH=-182 kJ·mol-1
②2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1
③4Li(s)+O2(g)===2Li2O(s) ΔH=-1 196 kJ·mol-1
则反应2LiH(s)+O2(g)===Li2O(s)+H2O(l)的焓变为
A.+351 kJ·mol-1 B.-351 kJ·mol-1
C.+702 kJ·mol-1 D.-702 kJ·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
5.(2023·延安高二检测)2 mol金属钠和1 mol氯气反应的能量关系如图所示,下列说法不正确的是
A.ΔH2>0
B.ΔH4+ΔH5+ΔH8=ΔH1
C.在相同条件下,2K(g)―→2K+(g)的ΔH<ΔH3
D.ΔH6+ΔH7=ΔH8
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
Na(s)的能量低于Na(g),则ΔH2>0,A说法正确;
根据盖斯定律,ΔH1=ΔH2+ΔH3+ΔH4+ΔH5+ΔH8,B说法不正确;
Na的活泼性小于K,故K比Na更易失电子,失电子吸收的能量更小,在相同条件下,2K(g)―→2K+(g)的ΔH<ΔH3,C说法正确;
根据盖斯定律,ΔH6+ΔH7=ΔH8,D说法正确。
2
题组二 反应热的计算
6.CH4—CO2催化重整反应为CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH。
已知:①C(s)+2H2(g)===CH4(g) ΔH1=-75 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-394 kJ·mol-1
③C(s)+ O2(g)===CO(g) ΔH3=-111 kJ·mol-1
则ΔH为
A.-580 kJ·mol-1 B.+247 kJ·mol-1
C.+208 kJ·mol-1 D.-430 kJ·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
根据盖斯定律可得CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=2ΔH3-ΔH2-ΔH1=+247 kJ·mol-1。
2
7.已知:S2(s)===S2(g) ΔH=+4.5 kJ·mol-1。某些化学键的键能数据如表所示:
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
化学键 H—H Cl—Cl H—Cl S==S H—S
键能/ (kJ·mol-1) 436 243 431 255 339
下列说法正确的是
A.1 mol H2(g)与2 mol Cl2(g)反应生成HCl(g)时放出370 kJ热量
B.H2(g)与S2(s)反应生成H2S(g)的热化学方程式为2H2(g)+S2(s)===2H2S(g) ΔH
=-229 kJ·mol-1
C.反应的焓变ΔH=反应物的键能之和-生成物的键能之和
D.1 mol H2S(g)分解吸收的热量比1 mol HCl(g)分解吸收的热量多,所以H2S(g)
比HCl(g)稳定
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
A项,反应H2(g)+Cl2(g)===2HCl(g)的ΔH=E(Cl—Cl)+E(H—H)-2E(H—Cl)=(243 kJ·mol-1+436 kJ·mol-1)-2×431 kJ·mol-1=-183 kJ·
mol-1,当2 mol Cl2(g)与1 mol H2(g)反应时,只有1 mol Cl2(g)参加反应,所以放出的热量为183 kJ,错误;
B项,根据表中键能数据可得热化学方程式:2H2(g)+S2(g)===2H2S(g) ΔH=-229 kJ·mol-1,结合S2(s)===S2(g) ΔH=+4.5 kJ·mol-1可得热化学方程式:2H2(g)+S2(s)===2H2S(g) ΔH=-224.5 kJ·mol-1,错误;
D项,由于H—Cl的键能大于H—S,所以HCl(g)比H2S(g)稳定,错误。
2
8.(2023·重庆高二检测)已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-a kJ·mol-1
②H2(g)+ O2(g)===H2O(g) ΔH2=-b kJ·mol-1
③C(s)+ O2(g)===CO(g) ΔH3=-c kJ·mol-1
④C(s)+O2(g)===CO2(g) ΔH4=-d kJ·mol-1
下列说法正确的是
A.c>d
B.0.5a<b
C.氢气的燃烧热为ΔH=-b kJ·mol-1
D.CO(g)+ O2(g)===CO2(g) ΔH=-(d-c) kJ·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
CO燃烧生成CO2是放热反应,故C(s)不完全燃烧生成CO放出的热量少,即c
2
9.氢卤酸的能量关系如图所示。下列说法正确的是
A.已知HF气体溶于水放热,则HF的ΔH1>0
B.相同条件下,HCl的ΔH2比HBr的小
C.相同条件下,HCl的(ΔH3+ΔH4)比HI的大
D.一定条件下,气态原子生成1 mol H—X放
出a kJ能量,则该条件下ΔH2=-a kJ·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
√
15
对点训练
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
由于HF气体溶于水放热,则HX(aq)―→
HX(g)吸收热量,故ΔH1>0,A正确;
由于HCl比HBr稳定,所以相同条件下HCl的ΔH2比HBr的大,B错误;
ΔH3+ΔH4代表H(g)―→H+(aq)的焓变,与是HCl的还是HI的无关,C错误;
一定条件下,气态原子形成1 mol H—X放出a kJ能量,则断开1 mol H—X形成气态原子吸收a kJ的能量,即ΔH2=+a kJ·mol-1,D错误。
2
10.肼(N2H4)在不同条件下分解产物不同,200 ℃时在Cu表面分解的机理如图甲所示。已知200 ℃时,反应Ⅰ:3N2H4(g)===N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1;反应Ⅱ:N2H4(g)+H2(g)===2NH3(g) ΔH2=
-41.8 kJ·mol-1。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
下列说法不正确的是
A.图甲所示过程①是放热反应
B.反应Ⅱ的能量变化示意图如图乙所示
C.断开3 mol N2H4(g)的化学键吸收的能量大于形成1 mol N2(g)和4 mol
NH3(g)的化学键释放的能量
D.200 ℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)===N2(g)
+2H2(g) ΔH=+50.7 kJ·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
对点训练
1
3
4
5
6
7
8
9
10
11
12
13
14
15
过程①是N2H4分解生成N2和NH3,已知热化学方程式Ⅰ中ΔH1为负值,所以过程①为放热反应,故A正确;
反应Ⅱ是放热反应,能量变化示意图正确,故B正确;
2
对点训练
1
3
4
5
6
7
8
9
10
11
12
13
14
15
放热反应中,反应物的化学键的键能之和小于生成物的化学键的键能之和,故C错误;
根据盖斯定律:Ⅰ-2×Ⅱ得N2H4(g)===N2(g)+2H2(g) ΔH=-32.9 kJ·
mol-1-2×(-41.8 kJ·mol-1)=+50.7 kJ·mol-1,故D正确。
2
11.已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1,CO(g)+
O2(g)===CO2(g) ΔH=-282.8 kJ·mol-1。现有CO、H2、CO2组成的混合气体67.2 L(标准状况下),经完全燃烧后放出的总热量为710.0 kJ,并生成18 g液态水,则燃烧前混合气体中CO的体积分数为
A.80% B.50%
C.60% D.20%
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
由于CO2在O2中不燃烧,
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
12.SO2的催化氧化反应是合成硫酸的重要步骤,下面是该反应中的能量变化示意图。已知:SO3(g)+H2O(l)===H2SO4(aq) ΔH4=-d kJ·mol-1,且a、b、c、d均为正值。下列说法错误的是
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
D.2SO2(g)+O2(g)+2H2O(l)===2H2SO4(aq) ΔH=-(c+d) kJ·mol-1
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
由盖斯定律可得2SO2(g)+O2(g)+2H2O(l)===2H2SO4(aq) ΔH=
-(c+2d) kJ·mol-1,D错误。
2
13.回答下列问题:
(1)中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
试写出25 ℃、101 kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的 热化学方程式:_______________________________________________
__________________。
8CO2(g)+25H2(g)===C8H18(l)+16H2O(l) ΔH=
-(25a-b) kJ·mol-1
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
根据盖斯定律,由①×25-②得8CO2(g)+25H2(g)===C8H18(l)+16H2O(l) ΔH=25ΔH1-ΔH2=-(25a-b) kJ·mol-1。
2
(2)化学反应原理研究物质转化过程中的规律并在生产生活中有广泛的应用。汽车排气管内的催化转化器可实现尾气无毒处理。
已知:N2(g)+O2(g)===2NO(g) ΔH=+180.5 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1
CO2(g)===C(s)+O2(g) ΔH=+393.5 kJ·mol-1
则反应2NO(g)+2CO(g)===N2(g)+2CO2(g)的ΔH=________ kJ·mol-1。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
-746.5
将反应从上到下依次编号为①②③,根据盖斯定律,由-(①+②+③×2)得反应2NO(g)+2CO(g)===N2(g)+2CO2(g)的ΔH=-746.5 kJ·mol-1。
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(3)合成氨在工业生产中具有重要意义。在合成氨工业中I2O5常用于定量测量CO的含量。已知:2I2(s)+5O2(g)===2I2O5(s) ΔH=-76 kJ·mol-1;2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1。则该测定反应的热化学方程式为____________________________________________________。
5CO(g)+I2O5(s)===5CO2(g)+I2(s) ΔH=-1 377 kJ·mol-1
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(4)氮及其化合物与人类生产、生活密切相关。氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:CO(g)+NO2(g)===NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)===N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用CO将NO2还原为N2,当消耗标准状况下3.36 L CO时,放出的热量
为_____________ kJ(用含有a和b的代数式表示,不用化简)。
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
14.为了合理利用化学能,确保安全生产,进行化工设计时需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常可以通过实验进行测定,也可通过理论进行推算。
(1)实验测得,5 g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ热量,则表示甲醇燃烧热的热化学方程式为
_______________________________________________________。
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
5 g CH3OH液体在氧气中充分燃烧生成CO2气体和液态水时放出113.5 kJ热量,
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)现有如下两个热化学方程式:
2H2(g)+O2(g)===2H2O(g) ΔH1=a kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=b kJ·mol-1
则a____ (填“>”“=”或“<”)b。
>
将两个热化学方程式进行比较,由于H2O由气态变成液态放出热量,故ΔH1>ΔH2,则a>b。
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键断裂和生成物的化学键形成的过程。在化学反应过程中,断裂化学键需要吸收能量,形成化学键又会释放能量。
已知:N2(g)+3H2(g) 2NH3(g) ΔH=a kJ·mol-1,根据上表中所列键能数据可计算出a=______。
-93
化学键 H—H N—H N≡N
键能/(kJ·mol-1) 436 391 945
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
15.CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式分别为①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1;
②2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1;
③C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1。
(1)在深海中存在一种甲烷细菌,它们依靠甲烷与O2在酶的催化作用下产生的能量存活,在甲烷细菌使1 mol甲烷生成CO2气体与液态水的过程中,放出的能量______(填“>”“<”或“=”)890.3 kJ。
=
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
反应热与反应条件无关,由CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,得到甲烷细菌使1 mol甲烷生成CO2气体与液态水放出的能量为890.3 kJ。
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)甲烷与CO2可用于生产合成气(主要成分是一氧化碳和氢气):CH4(g)+CO2(g) 2CO(g)+2H2(g),1 g CH4完全反应可释放15.46 kJ的热量,则:
①下图能表示该反应过程中能量变化的是_____(填字母)。
D
1 g CH4完全反应可释放15.46 kJ的热量,计算1 mol甲烷完全反应放出的热量为247.36 kJ,图D正确。
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化曲线如图所示,则CH4的转化率为______。
63%
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(3)C(s)与H2(g)很难发生反应,所以C(s)+2H2(g)===CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)===CH4(g)的反应热ΔH=______________。
-74.8 kJ·mol-1
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(4)目前对题干所述的三种物质的研究是燃料研究的重点,下列关于这三种物质的研究方向中可行的是____ (填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4反应生
产合成气(CO、H2)
D.用固态碳合成C60,以C60作为燃料
C
返回
2
