1.2.2 ΔH的大小比较及热化学方程式的再书写 课件(共66张PPT)23-24学年化学人教版高二选择性必修第一册
文档属性
| 名称 | 1.2.2 ΔH的大小比较及热化学方程式的再书写 课件(共66张PPT)23-24学年化学人教版高二选择性必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-22 23:40:32 | ||
图片预览










文档简介
(共66张PPT)
第2课时 ΔH的大小比较及热化学
方程式的再书写
第一章 第二节
1.掌握ΔH的大小比较方法。
2.掌握热化学方程式的书写方法。
核心素养
发展目标
ΔH的大小比较
01
“四根据”破解热化学方程式的书写
课时对点练
02
课时对点练
03
内容索引
04
CONTENTS
目 录
01
一、ΔH的大小比较
1.看符号比较ΔH
ΔH的大小比较时包含“+”“-”的比较。
吸热反应ΔH>0,放热反应ΔH<0,可判断吸热反应的ΔH>放热反应的ΔH。
2.看化学计量数比较ΔH
同一化学反应:ΔH与化学计量数成正比。
如:H2(g)+ O2(g)===H2O(l) ΔH1=-a kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-b kJ·mol-1
可判断:b=2a,所以ΔH1_____ΔH2。
>
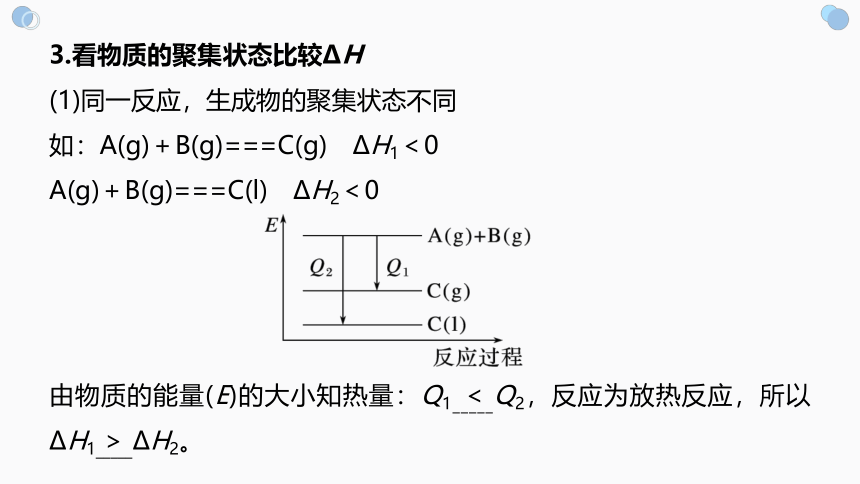
3.看物质的聚集状态比较ΔH
(1)同一反应,生成物的聚集状态不同
如:A(g)+B(g)===C(g) ΔH1<0
A(g)+B(g)===C(l) ΔH2<0
由物质的能量(E)的大小知热量:Q1_____Q2,反应为放热反应,所以ΔH1_____ΔH2。
<
>
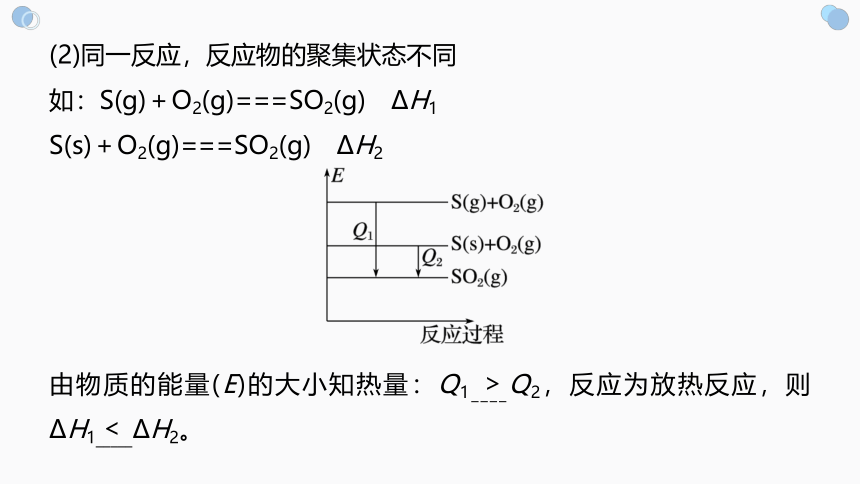
(2)同一反应,反应物的聚集状态不同
如:S(g)+O2(g)===SO2(g) ΔH1
S(s)+O2(g)===SO2(g) ΔH2
由物质的能量(E)的大小知热量:Q1____Q2,反应为放热反应,则ΔH1_____ΔH2。
>
<
4.看反应之间的联系比较ΔH
如:C(s)+O2(g)===CO2(g) ΔH1
ΔH2+ΔH3=ΔH1,又因为ΔH3<0,所以ΔH2____ΔH1。
>
5.看可逆反应比较ΔH
如:工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为可逆反应,现将2 mol SO2、1 mol O2充入一密闭容器中充分反应后,放出的热量为98.3 kJ,2SO2(g)+O2(g) 2SO3(g) ΔH=-Q kJ·
mol-1,则Q___98.3。
6.看中和反应的酸碱比较ΔH
生成1 mol H2O时:强酸和强碱的稀溶液的中和反应反应热ΔH=
-57.3 kJ·mol-1;弱酸、弱碱电离时吸热,反应时放出的总热量小于57.3 kJ;浓硫酸稀释时放热,反应时放出的总热量大于57.3 kJ。
>
(1)ΔH的大小比较时包含“+”“-”的比较。
(2)物质的聚集状态、化学计量数不同,则ΔH不同。
(3)先画出物质的能量(E)的草图,比较热量的大小,再根据吸、放热加上“+”“-”,进行比较。
(4)可逆反应的ΔH为完全反应时的值,因不能完全反应,吸收或放出的能量一般小于|ΔH|。
方法提升
应用体验
1.已知:C(s,金刚石)===C(s,石墨) ΔH=-1.9 kJ·mol-1
C(s,金刚石)+O2(g)===CO2(g) ΔH1
C(s,石墨)+O2(g)===CO2(g) ΔH2
根据上述反应所得出的结论正确的是
A.ΔH1=ΔH2 B.ΔH1>ΔH2
C.ΔH1<ΔH2 D.金刚石比石墨稳定
√
已知:C(s,金刚石)===C(s,石墨) ΔH=-1.9 kJ·mol-1,则等量的金刚石和石墨,金刚石的能量高,燃烧放出的热量多,则ΔH1<ΔH2<0,能量越高越不稳定,则石墨比金刚石稳定。
应用体验
2.下列选项中ΔH2>ΔH1的是
A.H2(g)+Cl2(g)===2HCl(g) ΔH1 H2(g)+Cl2(g)===2HCl(l) ΔH2
B.H2O(l)===H2(g)+ O2(g) ΔH1 2H2(g)+O2(g)===2H2O(l) ΔH2
C.已知2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s) ΔH<0
D.已知:弱酸电离时吸热
HCl(aq)+NaOH(aq)===NaCl(aq)+H2O(l) ΔH1
CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l) ΔH2
√
气态HCl的能量高于液态HCl,所以生成HCl气体时放出的热量少,又因为这两个反应的反应热均为负值,故ΔH1>ΔH2,A项不符合题意;
水分解反应的反应热为正值,燃烧反应的反应热为负值,即ΔH1>ΔH2,B项不符合题意;
由盖斯定律得ΔH2-ΔH1=ΔH<0,所以ΔH2<ΔH1,C项不符合题意;
醋酸是弱酸,电离时吸热,则醋酸与氢氧化钠溶液反应比盐酸与氢氧化钠溶液反应放出的热量少,又因为这两个反应的反应热均为负值,则ΔH2>ΔH1,D项符合题意。
返回
二
02
二、“四根据”破解热化学方程式的书写
例1
(2022·河南濮阳高二月考)根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,写出表示硫燃烧的热化学方程式:________________________________________。
S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1
16 g固体硫为0.5 mol,完全燃烧时放出148.4 kJ的热量,则1 mol固体硫完全燃烧时放出296.8 kJ的热量,则热化学方程式是S(s)+O2(g)===
SO2(g) ΔH=-296.8 kJ·mol-1。
1.根据反应的热量变化
(2)在1.01×105 Pa时,4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,表示氢气燃烧的热化学方程式为________________________
___________________。
(3)1 mol N2与适量的O2完全反应生成NO,吸收180 kJ热量,反应的热化学方程式为_________________________________________。
2H2(g)+O2(g)===2H2O(l)
ΔH=-572 kJ·mol-1
N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1
ΔH与化学方程式一一对应,利用已知的质量或物质的量及对应的能量变化换算成与化学方程式的计量数对应的ΔH,一定要标注物质的聚集状态。
特别提醒
例2
SF6是一种优良的绝缘气体,分子结构中只存在S—F。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F需吸收的能量分别为160 kJ、330 kJ。则S(s)与F2(g)反应生成SF6(g)的热化学方程式为_________________________________________。
S(s)+3F2(g)===SF6(g) ΔH=-1 220 kJ·mol-1
2.根据化学键的键能
(1)明确每种物质化学键的种类和数目,并按照化学计量数表示的物质的量计算。
(2)ΔH=E(反应物的总键能)-E(生成物的总键能)。
方法提升
例3
当今世界,能源的发展日益成为全世界、全人类共同关心的问题。乙烷、二甲醚的燃烧热数值较大,可用作燃料,如图是乙烷、二甲醚燃烧过程中的能量变化图,请回答下列问题:
3.根据能量图像
(1)a=___。
(2)乙烷的燃烧热为______ kJ·mol-1。
(3)写出二甲醚完全燃烧时的热化学方程式:___________________________
_______________________________。
1 560
CH3OCH3(g)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1 455 kJ·mol-1
例4
火箭升空需要高能的燃料,经常用N2O4和N2H4作为燃料,工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。
已知:①N2(g)+2O2(g)===2NO2(g) ΔH=+67.7 kJ·mol-1
②N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534.0 kJ·mol-1
4.根据盖斯定律
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:____________________________________________________
______。
2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1 083.0 kJ·
mol-1
由盖斯定律可知,将②×2-①-③×2得2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=2×(-534.0 kJ·mol-1)-67.7 kJ·mol-1-2×(-26.35 kJ·
mol-1)=-1 083.0 kJ·mol-1。
应用体验
1.在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化,SO2被还原为S。已知:
①C(s)+ O2(g)===CO(g) ΔH1=-126.4 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
③S(s)+O2(g)===SO2(g) ΔH3=-296.8 kJ·mol-1
则SO2氧化CO的热化学方程式为________________________________
____________________。
SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=-237.4 kJ·mol-1
应用体验
2.(2022·福建漳州检测)一定条件下,在水溶液中1 mol Cl-、 (x=1,2,3,4)的能量(单位:kJ)相对大小如图所示。
反应B―→A+C的热化学方程式为_______________________________
___________________(用离子符号表示)。
ΔH=-117 kJ·mol-1
返回
01
课时对点练
1
2
3
4
5
6
7
8
9
题组一 ΔH的大小比较
10
11
12
13
14
15
对点训练
下列关系正确的是
A.a<c<0 B.b>d>0
C.2a=b<0 D.2c=d>0
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
热化学方程式中化学计量数表示物质的量,水从气态变为液态放热,①与③比较,③放出的热量多,所以0>a>c,②与④比较,④放出的热量多,所以0>b>d,热化学方程式中化学计量数变化,焓变随之变化,所以b=2a<0,d=2c<0。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2.已知强酸与强碱的稀溶液发生中和反应生成可溶性盐的热化学方程式用离子方程式可表示为H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·
mol-1,又知弱电解质的电离是吸热过程。向1 L 0.5 mol·L-1NaOH溶液中分别加入下列物质:①稀醋酸、②浓硫酸、③稀硝酸,恰好完全反应时的焓变分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的关系是
A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH3<ΔH2
C.ΔH1=ΔH3>ΔH2 D.ΔH1>ΔH3>ΔH2
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
因为稀醋酸是弱酸,电离时吸热,浓硫酸溶于水时会放出较多热量,故发生中和反应时放出的热量:Q(浓硫酸)>Q(稀硝酸)>Q(稀醋酸),又因放热反应中焓变为负值,则ΔH2<ΔH3<ΔH1。
2
3.下列依据热化学方程式得出的结论正确的是
A.已知Ni(CO)4(s)===Ni(s)+4CO(g) ΔH=Q kJ·mol-1,则Ni(s)+4CO(g)
===Ni(CO)4(s) ΔH=-Q kJ·mol-1
B.在一定温度和压强下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分
反应生成NH3(g),放出热量19.3 kJ,则其热化学方程式为
NH3(g) ΔH=-19.3 kJ·mol-1
C.已知2H2(g)+O2(g)===2H2O(l) ΔH1,2H2(g)+O2(g)===2H2O(g) ΔH2,
则ΔH1>ΔH2
D.已知C(s,石墨)===C(s,金刚石) ΔH>0,则金刚石比石墨稳定
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
合成氨的反应是可逆反应,不能进行完全,B错误;
H2O(g)转化为H2O(l)放热,且氢气燃烧的焓变ΔH<0,所以ΔH1<ΔH2,C错误;
由C(s,石墨)===C(s,金刚石) ΔH>0可知,1 mol石墨的能量小于
1 mol金刚石的能量,则石墨比金刚石稳定,D错误。
题组二 热化学方程式的理解及书写
4.下列关于热化学方程式的说法正确的是
A.若H2的燃烧热为a kJ·mol-1,则热化学方程式为H2+Cl2===2HCl ΔH=-a kJ·
mol-1
B.若1 mol SO2和0.5 mol O2完全反应放热98.3 kJ,则热化学方程式为2SO2(g)+
O2(g) 2SO3(g) ΔH=-98.3 kJ·mol-1
C.若H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则稀硫酸与稀
Ba(OH)2溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+
2H2O(l) ΔH=-114.6 kJ·mol-1
D.若31 g白磷的能量比31 g红磷多b kJ,则白磷转化为红磷的热化学方程式为
P4(s,白磷)===4P(s,红磷) ΔH=-4b kJ·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
H2的燃烧热是指1 mol H2在氧气中完全燃烧生成H2O(l)时放出的热量,A错误;
反应热应与化学方程式中的化学计量数要相对应,B错误;
稀硫酸与Ba(OH)2溶液发生中和反应时除产生2 mol的H2O(l)放出热量外,反应产生BaSO4沉淀时也会放出热量,反应放出热量越多,则反应热越小,故稀硫酸与稀Ba(OH)2溶液反应,H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l) ΔH<-114.6 kJ·mol-1,C错误;
1 mol白磷的质量是124 g,若31 g白磷的能量比31 g红磷多b kJ,则1 mol白磷的能量比等量的红磷的能量多4b kJ,故白磷转化为红磷的热化学方程式为P4(s,白磷)===4P(s,红磷) ΔH=-4b kJ·mol-1,D正确。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
5.已知:2C(s)+O2(g)===2CO(g) ΔH=-Q1 kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH=-Q2 kJ·mol-1
S(s)+O2(g)===SO2(g) ΔH=-Q3 kJ·mol-1
CO与镍反应会造成镍催化剂中毒,为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫,则对应反应的热化学方程式为
A.S(s)+2CO(g)===SO2(g)+2C(s) ΔH=(2Q1-2Q2-Q3) kJ·mol-1
B.S(s)+2CO(g)===SO2(g)+2C(s) ΔH=(Q1-Q3) kJ·mol-1
C.SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(Q1-2Q2+Q3) kJ·mol-1
D.SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-Q2+2Q3) kJ·mol-1
√
2
6.S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(s,单斜)+O2(g)===SO2(g) ΔH1=-297.16 kJ·mol-1
②S(s,正交)+O2(g)===SO2(g) ΔH2=-296.83 kJ·mol-1
③S(s,单斜)===S(s,正交) ΔH3
下列说法正确的是
A.ΔH3=+0.33 kJ·mol-1
B.单斜硫转化为正交硫的反应是吸热反应
C.S(s,单斜)===S(s,正交) ΔH3<0,正交硫比单斜硫稳定
D.S(s,单斜)===S(s,正交) ΔH3>0,单斜硫比正交硫稳定
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
根据盖斯定律得:③=①-②,则ΔH3=ΔH1-ΔH2=-0.33 kJ·mol-1,说明反应③为放热反应,单斜硫的能量比正交硫高,正交硫更稳定。
2
7.煤燃烧排放的烟气中含有的SO2和NOx会污染大气。采用NaClO、Ca(ClO)2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,发生的相关反应如下:
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
④SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)===CaSO4(s)+H2O(l)+Cl-(aq) ΔH4=d kJ·mol-1
下列有关说法正确的是
A.随着吸收反应的进行,吸收剂溶液的pH逐渐减小
B.反应①②均为氧化还原反应
C.反应Ca(OH)2(aq)+H2SO4(aq)===CaSO4(s)+2H2O(l)的ΔH=-c kJ·mol-1
D.d=a+b+c
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
A项,由反应①和④可知,随着吸收反应的进行,不断消耗OH-,因此吸收剂溶液的pH逐渐减小,正确;
B项,反应①元素化合价没有发生变化,不是氧化还原反应,错误;
C项,反应Ca(OH)2(aq)+H2SO4(aq)===CaSO4(s)+2H2O(l)的离子方程式为Ca2++ +2OH-+2H+===CaSO4↓+2H2O,该离子反应不是反应③的逆反应,因此该反应的ΔH≠-c kJ·mol-1,错误;
D项,根据盖斯定律,可得④=①+②-③,所以d=a+b-c,错误。
8.向Na2CO3溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法正确的是
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
C.ΔH1>ΔH2;ΔH2<ΔH3
D.H2CO3(aq)===CO2(g)+H2O(l),若使用催化剂,则ΔH3变小
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
由图像可知,能量差值越大,反应热的绝对值越大,ΔH1、ΔH2都为放热反应,则ΔH1<ΔH2,C错误;
加入催化剂,反应热不变,D错误。
2
9.(2022·晋中高二检测)根据碘与氢气反应的热化学方程式:
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
下列判断正确的是
A.反应(ⅰ)中的I2为固态,反应(ⅱ)中的I2为气态
B.1 mol固态碘与1 mol气态碘所含的能量相差35.96 kJ
C.反应(ⅰ)的生成物比反应(ⅱ)的生成物稳定
D.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
反应(ⅰ)放出能量,反应(ⅱ)吸收能量,故(ⅰ)中I2的能量高,为气态,(ⅱ)中I2为固态,故A项错误;
两个反应的生成物为相同状态的同种物质,其稳定性相同,故C项错误;
254 g I2(g)和2 g H2(g)的物质的量均为1 mol,因反应(ⅰ)是可逆反应,转化率达不到100%,则反应放热小于9.48 kJ,故D项错误。
10.已知溴跟氢气反应的热化学方程式如下(Q1、Q2、Q3均为正值):
①H2(g)+Br2(g)===2HBr(l) ΔH1=-Q1 kJ·mol-1
②H2(g)+Br2(g)===2HBr(g) ΔH2=-Q2 kJ·mol-1
③H2(g)+Br2(l)===2HBr(g) ΔH3=-Q3 kJ·mol-1
下列判断正确的是
A.Q1>Q2>Q3
B.Q1与Q3的相对大小无法判断
C.溴蒸气转化为液态溴ΔH=(Q2-Q3) kJ·mol-1
D.H2(g)和Br2(g)反应生成HBr(g)时放出Q2 kJ热量
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
对点训练
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2 mol HBr(g)具有的总能量大于2 mol HBr(l)具有的总能量,则Q1>Q2,1 mol Br2(g)具有的总能量大于1 mol Br2(l)具有的总能量,则Q2>Q3,所以Q1>Q2>Q3,A项正确、B项错误;
根据盖斯定律,由②-③得Br2(g)===Br2(l) ΔH=-(Q2-Q3) kJ·mol-1,C项错误;
由H2(g)+Br2(g)===2HBr(g) ΔH2=-Q2 kJ·mol-1可知,1 mol H2(g)和1 mol Br2(g)反应生成2 mol HBr(g)时放出Q2 kJ的热量,D项错误。
2
11.已知:2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的图示与过程如下:
过程Ⅰ:……
过程Ⅱ:3FeO(s)+H2O(l)===H2(g)+Fe3O4(s)
ΔH=+129.2 kJ·mol-1
下列说法不正确的是
A.该过程能量转化形式是太阳能→化学能→热能
B.过程Ⅰ的热化学方程式为Fe3O4(s)===3FeO(s)+ O2(g) ΔH=+156.6 kJ·mol-1
C.氢气的燃烧热ΔH=-285.8 kJ·mol-1
D.铁氧化合物循环制H2具有成本低、产物易分离等优点
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
过程Ⅰ中Fe3O4分解为FeO、O2,该反应为吸热反应,由题意知过程Ⅱ中发生的反应也是吸热反应,因此不存在化学能→热能的转化,A项错误;
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
由2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1可知,2 mol H2完全燃烧生成2 mol液态水放出571.6 kJ的热量,则1 mol H2完全燃烧生成1 mol液态水放出285.8 kJ的热量,故氢气的燃烧热ΔH=-285.8 kJ·mol-1,C项正确;
过程Ⅱ为3FeO(s)+H2O(l)===H2(g)+Fe3O4(s) ΔH=+129.2 kJ·mol-1,产物中氢气为气体,而Fe3O4为固体,故铁氧化合物循环制H2的产物易分离,且整个过程是利用太阳能完成的,成本低,D项正确。
12.化学反应放出或吸收的能量称为反应热。反应热(ΔH)又因化学反应的分类给予不同的名称。如我们学过的燃烧热(ΔHc),由稳定单质化合生成1 mol纯物质的热效应称为生成热(ΔHf),断裂化学键时所吸收的能量称为键能(ΔHb),下面两个图中的数据分别表示水与二氧化碳各1 mol分解时能量变化的示意图,图中的各数据均以kJ为单位,下列说法正确的是
A.H2O(g)的生成热:ΔHf=+243 kJ·mol-1
B.CO(g)的燃烧热:ΔHc=-570 kJ·mol-1
C.O—H的键能:ΔHb=+436 kJ·mol-1
D.CO(g)+H2O(g)===CO2(g)+H2(g)
ΔH=-42 kJ·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
13.依据题意,写出下列反应的热化学方程式。
(1)若适量的N2和O2完全反应生成NO2,每生成23 g NO2需要吸收16.95 kJ热量。则该反应的热化学方程式为__________________________________
_______________。
(2)用NA表示阿伏加德罗常数的值,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。则该反应
的热化学方程式为___________________________________________________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
N2(g)+2O2(g)===2NO2(g) ΔH=
+67.8 kJ·mol-1
(3)已知拆开1 mol H—H、1 mol N—H、1 mol N≡N分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_________________________________________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
14.(1)用O2将HCl转化为Cl2的过程如图所示。
2
其中,过程①的热化学方程式为2HCl(g)+CuO(s)===H2O(g)+CuCl2(s) ΔH1,过程②生成1 mol Cl2的反应热为ΔH2,则由HCl(g)生成Cl2(g)的热
化学方程式为________________________________________________(反
应热用ΔH1和ΔH2表示)。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)已知:
①CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206 kJ·mol-1
②CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802 kJ·mol-1
写出由CO2(g)和H2O(g)生成CO(g)的热化学方程式:__________________
______________________________________________。
CO2(g)+3H2O(g)
===2O2(g)+CO(g)+3H2(g) ΔH=+1 008 kJ·mol-1
根据盖斯定律,由①-②得CO2(g)+3H2O(g)===2O2(g)+CO(g)+3H2(g) ΔH=+206 kJ·mol-1-(-802 kJ·mol-1)=+1 008 kJ·mol-1。
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
15.热力学标准态(298.15 K、101 kPa)下,由稳定单质发生反应生成1 mol化合物的反应热叫作该化合物的生成热(ΔH)。图甲为第ⅥA族元素氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
2
(1)①请你归纳非金属元素氢化物的稳定性与氢化物的生成热ΔH的关系:________________________________。
非金属元素氢化物越稳定,ΔH越小
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
②硒化氢在上述条件下发生分解反应的热化学方程式为______________
__________________________。
H2Se(g)===Se(s)+H2(g) ΔH=-81 kJ·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)在25 ℃、101 kPa下,已知SiH4气体在氧气中完全燃烧后恢复至原状态,平均每转移1 mol电子放热190.0 kJ,该反应的热化学方程式是_______________________________________________________。
2
SiH4(g)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1 520.0 kJ·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(3)根据图乙写出反应CO(g)+2H2(g)===CH3OH(g)的热化学方程式:____________________________________________。
2
CO(g)+2H2(g)===CH3OH(g) ΔH=-91 kJ·mol-1
ΔH=419 kJ·mol-1-510 kJ·mol-1=-91 kJ·mol-1,故该反应的热化学方程式为CO(g)+2H2(g)===CH3OH(g) ΔH=-91 kJ·mol-1。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(4)由金红石(TiO2)制取单质Ti的步骤为
2
已知:Ⅰ.C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
Ⅱ.2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Ⅲ.TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH=+141 kJ·mol-1
①TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH=_____________。
-80 kJ·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
根据盖斯定律,由2×Ⅰ-Ⅱ+Ⅲ可得:TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g) ΔH=-80 kJ·mol-1。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
②反应TiCl4+2Mg 2MgCl2+Ti在Ar气氛中进行的理由是________
____________________________________。
防止高温下Mg、Ti与空气中的O2(或CO2、N2)作用
2
返回
第2课时 ΔH的大小比较及热化学
方程式的再书写
第一章 第二节
1.掌握ΔH的大小比较方法。
2.掌握热化学方程式的书写方法。
核心素养
发展目标
ΔH的大小比较
01
“四根据”破解热化学方程式的书写
课时对点练
02
课时对点练
03
内容索引
04
CONTENTS
目 录
01
一、ΔH的大小比较
1.看符号比较ΔH
ΔH的大小比较时包含“+”“-”的比较。
吸热反应ΔH>0,放热反应ΔH<0,可判断吸热反应的ΔH>放热反应的ΔH。
2.看化学计量数比较ΔH
同一化学反应:ΔH与化学计量数成正比。
如:H2(g)+ O2(g)===H2O(l) ΔH1=-a kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-b kJ·mol-1
可判断:b=2a,所以ΔH1_____ΔH2。
>
3.看物质的聚集状态比较ΔH
(1)同一反应,生成物的聚集状态不同
如:A(g)+B(g)===C(g) ΔH1<0
A(g)+B(g)===C(l) ΔH2<0
由物质的能量(E)的大小知热量:Q1_____Q2,反应为放热反应,所以ΔH1_____ΔH2。
<
>
(2)同一反应,反应物的聚集状态不同
如:S(g)+O2(g)===SO2(g) ΔH1
S(s)+O2(g)===SO2(g) ΔH2
由物质的能量(E)的大小知热量:Q1____Q2,反应为放热反应,则ΔH1_____ΔH2。
>
<
4.看反应之间的联系比较ΔH
如:C(s)+O2(g)===CO2(g) ΔH1
ΔH2+ΔH3=ΔH1,又因为ΔH3<0,所以ΔH2____ΔH1。
>
5.看可逆反应比较ΔH
如:工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为可逆反应,现将2 mol SO2、1 mol O2充入一密闭容器中充分反应后,放出的热量为98.3 kJ,2SO2(g)+O2(g) 2SO3(g) ΔH=-Q kJ·
mol-1,则Q___98.3。
6.看中和反应的酸碱比较ΔH
生成1 mol H2O时:强酸和强碱的稀溶液的中和反应反应热ΔH=
-57.3 kJ·mol-1;弱酸、弱碱电离时吸热,反应时放出的总热量小于57.3 kJ;浓硫酸稀释时放热,反应时放出的总热量大于57.3 kJ。
>
(1)ΔH的大小比较时包含“+”“-”的比较。
(2)物质的聚集状态、化学计量数不同,则ΔH不同。
(3)先画出物质的能量(E)的草图,比较热量的大小,再根据吸、放热加上“+”“-”,进行比较。
(4)可逆反应的ΔH为完全反应时的值,因不能完全反应,吸收或放出的能量一般小于|ΔH|。
方法提升
应用体验
1.已知:C(s,金刚石)===C(s,石墨) ΔH=-1.9 kJ·mol-1
C(s,金刚石)+O2(g)===CO2(g) ΔH1
C(s,石墨)+O2(g)===CO2(g) ΔH2
根据上述反应所得出的结论正确的是
A.ΔH1=ΔH2 B.ΔH1>ΔH2
C.ΔH1<ΔH2 D.金刚石比石墨稳定
√
已知:C(s,金刚石)===C(s,石墨) ΔH=-1.9 kJ·mol-1,则等量的金刚石和石墨,金刚石的能量高,燃烧放出的热量多,则ΔH1<ΔH2<0,能量越高越不稳定,则石墨比金刚石稳定。
应用体验
2.下列选项中ΔH2>ΔH1的是
A.H2(g)+Cl2(g)===2HCl(g) ΔH1 H2(g)+Cl2(g)===2HCl(l) ΔH2
B.H2O(l)===H2(g)+ O2(g) ΔH1 2H2(g)+O2(g)===2H2O(l) ΔH2
C.已知2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s) ΔH<0
D.已知:弱酸电离时吸热
HCl(aq)+NaOH(aq)===NaCl(aq)+H2O(l) ΔH1
CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l) ΔH2
√
气态HCl的能量高于液态HCl,所以生成HCl气体时放出的热量少,又因为这两个反应的反应热均为负值,故ΔH1>ΔH2,A项不符合题意;
水分解反应的反应热为正值,燃烧反应的反应热为负值,即ΔH1>ΔH2,B项不符合题意;
由盖斯定律得ΔH2-ΔH1=ΔH<0,所以ΔH2<ΔH1,C项不符合题意;
醋酸是弱酸,电离时吸热,则醋酸与氢氧化钠溶液反应比盐酸与氢氧化钠溶液反应放出的热量少,又因为这两个反应的反应热均为负值,则ΔH2>ΔH1,D项符合题意。
返回
二
02
二、“四根据”破解热化学方程式的书写
例1
(2022·河南濮阳高二月考)根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,写出表示硫燃烧的热化学方程式:________________________________________。
S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1
16 g固体硫为0.5 mol,完全燃烧时放出148.4 kJ的热量,则1 mol固体硫完全燃烧时放出296.8 kJ的热量,则热化学方程式是S(s)+O2(g)===
SO2(g) ΔH=-296.8 kJ·mol-1。
1.根据反应的热量变化
(2)在1.01×105 Pa时,4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,表示氢气燃烧的热化学方程式为________________________
___________________。
(3)1 mol N2与适量的O2完全反应生成NO,吸收180 kJ热量,反应的热化学方程式为_________________________________________。
2H2(g)+O2(g)===2H2O(l)
ΔH=-572 kJ·mol-1
N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1
ΔH与化学方程式一一对应,利用已知的质量或物质的量及对应的能量变化换算成与化学方程式的计量数对应的ΔH,一定要标注物质的聚集状态。
特别提醒
例2
SF6是一种优良的绝缘气体,分子结构中只存在S—F。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F需吸收的能量分别为160 kJ、330 kJ。则S(s)与F2(g)反应生成SF6(g)的热化学方程式为_________________________________________。
S(s)+3F2(g)===SF6(g) ΔH=-1 220 kJ·mol-1
2.根据化学键的键能
(1)明确每种物质化学键的种类和数目,并按照化学计量数表示的物质的量计算。
(2)ΔH=E(反应物的总键能)-E(生成物的总键能)。
方法提升
例3
当今世界,能源的发展日益成为全世界、全人类共同关心的问题。乙烷、二甲醚的燃烧热数值较大,可用作燃料,如图是乙烷、二甲醚燃烧过程中的能量变化图,请回答下列问题:
3.根据能量图像
(1)a=___。
(2)乙烷的燃烧热为______ kJ·mol-1。
(3)写出二甲醚完全燃烧时的热化学方程式:___________________________
_______________________________。
1 560
CH3OCH3(g)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1 455 kJ·mol-1
例4
火箭升空需要高能的燃料,经常用N2O4和N2H4作为燃料,工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。
已知:①N2(g)+2O2(g)===2NO2(g) ΔH=+67.7 kJ·mol-1
②N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534.0 kJ·mol-1
4.根据盖斯定律
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:____________________________________________________
______。
2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1 083.0 kJ·
mol-1
由盖斯定律可知,将②×2-①-③×2得2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=2×(-534.0 kJ·mol-1)-67.7 kJ·mol-1-2×(-26.35 kJ·
mol-1)=-1 083.0 kJ·mol-1。
应用体验
1.在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化,SO2被还原为S。已知:
①C(s)+ O2(g)===CO(g) ΔH1=-126.4 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
③S(s)+O2(g)===SO2(g) ΔH3=-296.8 kJ·mol-1
则SO2氧化CO的热化学方程式为________________________________
____________________。
SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=-237.4 kJ·mol-1
应用体验
2.(2022·福建漳州检测)一定条件下,在水溶液中1 mol Cl-、 (x=1,2,3,4)的能量(单位:kJ)相对大小如图所示。
反应B―→A+C的热化学方程式为_______________________________
___________________(用离子符号表示)。
ΔH=-117 kJ·mol-1
返回
01
课时对点练
1
2
3
4
5
6
7
8
9
题组一 ΔH的大小比较
10
11
12
13
14
15
对点训练
下列关系正确的是
A.a<c<0 B.b>d>0
C.2a=b<0 D.2c=d>0
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
热化学方程式中化学计量数表示物质的量,水从气态变为液态放热,①与③比较,③放出的热量多,所以0>a>c,②与④比较,④放出的热量多,所以0>b>d,热化学方程式中化学计量数变化,焓变随之变化,所以b=2a<0,d=2c<0。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2.已知强酸与强碱的稀溶液发生中和反应生成可溶性盐的热化学方程式用离子方程式可表示为H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·
mol-1,又知弱电解质的电离是吸热过程。向1 L 0.5 mol·L-1NaOH溶液中分别加入下列物质:①稀醋酸、②浓硫酸、③稀硝酸,恰好完全反应时的焓变分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的关系是
A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH3<ΔH2
C.ΔH1=ΔH3>ΔH2 D.ΔH1>ΔH3>ΔH2
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
因为稀醋酸是弱酸,电离时吸热,浓硫酸溶于水时会放出较多热量,故发生中和反应时放出的热量:Q(浓硫酸)>Q(稀硝酸)>Q(稀醋酸),又因放热反应中焓变为负值,则ΔH2<ΔH3<ΔH1。
2
3.下列依据热化学方程式得出的结论正确的是
A.已知Ni(CO)4(s)===Ni(s)+4CO(g) ΔH=Q kJ·mol-1,则Ni(s)+4CO(g)
===Ni(CO)4(s) ΔH=-Q kJ·mol-1
B.在一定温度和压强下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分
反应生成NH3(g),放出热量19.3 kJ,则其热化学方程式为
NH3(g) ΔH=-19.3 kJ·mol-1
C.已知2H2(g)+O2(g)===2H2O(l) ΔH1,2H2(g)+O2(g)===2H2O(g) ΔH2,
则ΔH1>ΔH2
D.已知C(s,石墨)===C(s,金刚石) ΔH>0,则金刚石比石墨稳定
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
合成氨的反应是可逆反应,不能进行完全,B错误;
H2O(g)转化为H2O(l)放热,且氢气燃烧的焓变ΔH<0,所以ΔH1<ΔH2,C错误;
由C(s,石墨)===C(s,金刚石) ΔH>0可知,1 mol石墨的能量小于
1 mol金刚石的能量,则石墨比金刚石稳定,D错误。
题组二 热化学方程式的理解及书写
4.下列关于热化学方程式的说法正确的是
A.若H2的燃烧热为a kJ·mol-1,则热化学方程式为H2+Cl2===2HCl ΔH=-a kJ·
mol-1
B.若1 mol SO2和0.5 mol O2完全反应放热98.3 kJ,则热化学方程式为2SO2(g)+
O2(g) 2SO3(g) ΔH=-98.3 kJ·mol-1
C.若H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则稀硫酸与稀
Ba(OH)2溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+
2H2O(l) ΔH=-114.6 kJ·mol-1
D.若31 g白磷的能量比31 g红磷多b kJ,则白磷转化为红磷的热化学方程式为
P4(s,白磷)===4P(s,红磷) ΔH=-4b kJ·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
H2的燃烧热是指1 mol H2在氧气中完全燃烧生成H2O(l)时放出的热量,A错误;
反应热应与化学方程式中的化学计量数要相对应,B错误;
稀硫酸与Ba(OH)2溶液发生中和反应时除产生2 mol的H2O(l)放出热量外,反应产生BaSO4沉淀时也会放出热量,反应放出热量越多,则反应热越小,故稀硫酸与稀Ba(OH)2溶液反应,H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l) ΔH<-114.6 kJ·mol-1,C错误;
1 mol白磷的质量是124 g,若31 g白磷的能量比31 g红磷多b kJ,则1 mol白磷的能量比等量的红磷的能量多4b kJ,故白磷转化为红磷的热化学方程式为P4(s,白磷)===4P(s,红磷) ΔH=-4b kJ·mol-1,D正确。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
5.已知:2C(s)+O2(g)===2CO(g) ΔH=-Q1 kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH=-Q2 kJ·mol-1
S(s)+O2(g)===SO2(g) ΔH=-Q3 kJ·mol-1
CO与镍反应会造成镍催化剂中毒,为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫,则对应反应的热化学方程式为
A.S(s)+2CO(g)===SO2(g)+2C(s) ΔH=(2Q1-2Q2-Q3) kJ·mol-1
B.S(s)+2CO(g)===SO2(g)+2C(s) ΔH=(Q1-Q3) kJ·mol-1
C.SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(Q1-2Q2+Q3) kJ·mol-1
D.SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-Q2+2Q3) kJ·mol-1
√
2
6.S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(s,单斜)+O2(g)===SO2(g) ΔH1=-297.16 kJ·mol-1
②S(s,正交)+O2(g)===SO2(g) ΔH2=-296.83 kJ·mol-1
③S(s,单斜)===S(s,正交) ΔH3
下列说法正确的是
A.ΔH3=+0.33 kJ·mol-1
B.单斜硫转化为正交硫的反应是吸热反应
C.S(s,单斜)===S(s,正交) ΔH3<0,正交硫比单斜硫稳定
D.S(s,单斜)===S(s,正交) ΔH3>0,单斜硫比正交硫稳定
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
根据盖斯定律得:③=①-②,则ΔH3=ΔH1-ΔH2=-0.33 kJ·mol-1,说明反应③为放热反应,单斜硫的能量比正交硫高,正交硫更稳定。
2
7.煤燃烧排放的烟气中含有的SO2和NOx会污染大气。采用NaClO、Ca(ClO)2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,发生的相关反应如下:
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
④SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)===CaSO4(s)+H2O(l)+Cl-(aq) ΔH4=d kJ·mol-1
下列有关说法正确的是
A.随着吸收反应的进行,吸收剂溶液的pH逐渐减小
B.反应①②均为氧化还原反应
C.反应Ca(OH)2(aq)+H2SO4(aq)===CaSO4(s)+2H2O(l)的ΔH=-c kJ·mol-1
D.d=a+b+c
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
A项,由反应①和④可知,随着吸收反应的进行,不断消耗OH-,因此吸收剂溶液的pH逐渐减小,正确;
B项,反应①元素化合价没有发生变化,不是氧化还原反应,错误;
C项,反应Ca(OH)2(aq)+H2SO4(aq)===CaSO4(s)+2H2O(l)的离子方程式为Ca2++ +2OH-+2H+===CaSO4↓+2H2O,该离子反应不是反应③的逆反应,因此该反应的ΔH≠-c kJ·mol-1,错误;
D项,根据盖斯定律,可得④=①+②-③,所以d=a+b-c,错误。
8.向Na2CO3溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法正确的是
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
C.ΔH1>ΔH2;ΔH2<ΔH3
D.H2CO3(aq)===CO2(g)+H2O(l),若使用催化剂,则ΔH3变小
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
由图像可知,能量差值越大,反应热的绝对值越大,ΔH1、ΔH2都为放热反应,则ΔH1<ΔH2,C错误;
加入催化剂,反应热不变,D错误。
2
9.(2022·晋中高二检测)根据碘与氢气反应的热化学方程式:
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
下列判断正确的是
A.反应(ⅰ)中的I2为固态,反应(ⅱ)中的I2为气态
B.1 mol固态碘与1 mol气态碘所含的能量相差35.96 kJ
C.反应(ⅰ)的生成物比反应(ⅱ)的生成物稳定
D.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
反应(ⅰ)放出能量,反应(ⅱ)吸收能量,故(ⅰ)中I2的能量高,为气态,(ⅱ)中I2为固态,故A项错误;
两个反应的生成物为相同状态的同种物质,其稳定性相同,故C项错误;
254 g I2(g)和2 g H2(g)的物质的量均为1 mol,因反应(ⅰ)是可逆反应,转化率达不到100%,则反应放热小于9.48 kJ,故D项错误。
10.已知溴跟氢气反应的热化学方程式如下(Q1、Q2、Q3均为正值):
①H2(g)+Br2(g)===2HBr(l) ΔH1=-Q1 kJ·mol-1
②H2(g)+Br2(g)===2HBr(g) ΔH2=-Q2 kJ·mol-1
③H2(g)+Br2(l)===2HBr(g) ΔH3=-Q3 kJ·mol-1
下列判断正确的是
A.Q1>Q2>Q3
B.Q1与Q3的相对大小无法判断
C.溴蒸气转化为液态溴ΔH=(Q2-Q3) kJ·mol-1
D.H2(g)和Br2(g)反应生成HBr(g)时放出Q2 kJ热量
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
对点训练
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2 mol HBr(g)具有的总能量大于2 mol HBr(l)具有的总能量,则Q1>Q2,1 mol Br2(g)具有的总能量大于1 mol Br2(l)具有的总能量,则Q2>Q3,所以Q1>Q2>Q3,A项正确、B项错误;
根据盖斯定律,由②-③得Br2(g)===Br2(l) ΔH=-(Q2-Q3) kJ·mol-1,C项错误;
由H2(g)+Br2(g)===2HBr(g) ΔH2=-Q2 kJ·mol-1可知,1 mol H2(g)和1 mol Br2(g)反应生成2 mol HBr(g)时放出Q2 kJ的热量,D项错误。
2
11.已知:2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的图示与过程如下:
过程Ⅰ:……
过程Ⅱ:3FeO(s)+H2O(l)===H2(g)+Fe3O4(s)
ΔH=+129.2 kJ·mol-1
下列说法不正确的是
A.该过程能量转化形式是太阳能→化学能→热能
B.过程Ⅰ的热化学方程式为Fe3O4(s)===3FeO(s)+ O2(g) ΔH=+156.6 kJ·mol-1
C.氢气的燃烧热ΔH=-285.8 kJ·mol-1
D.铁氧化合物循环制H2具有成本低、产物易分离等优点
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
过程Ⅰ中Fe3O4分解为FeO、O2,该反应为吸热反应,由题意知过程Ⅱ中发生的反应也是吸热反应,因此不存在化学能→热能的转化,A项错误;
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
由2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1可知,2 mol H2完全燃烧生成2 mol液态水放出571.6 kJ的热量,则1 mol H2完全燃烧生成1 mol液态水放出285.8 kJ的热量,故氢气的燃烧热ΔH=-285.8 kJ·mol-1,C项正确;
过程Ⅱ为3FeO(s)+H2O(l)===H2(g)+Fe3O4(s) ΔH=+129.2 kJ·mol-1,产物中氢气为气体,而Fe3O4为固体,故铁氧化合物循环制H2的产物易分离,且整个过程是利用太阳能完成的,成本低,D项正确。
12.化学反应放出或吸收的能量称为反应热。反应热(ΔH)又因化学反应的分类给予不同的名称。如我们学过的燃烧热(ΔHc),由稳定单质化合生成1 mol纯物质的热效应称为生成热(ΔHf),断裂化学键时所吸收的能量称为键能(ΔHb),下面两个图中的数据分别表示水与二氧化碳各1 mol分解时能量变化的示意图,图中的各数据均以kJ为单位,下列说法正确的是
A.H2O(g)的生成热:ΔHf=+243 kJ·mol-1
B.CO(g)的燃烧热:ΔHc=-570 kJ·mol-1
C.O—H的键能:ΔHb=+436 kJ·mol-1
D.CO(g)+H2O(g)===CO2(g)+H2(g)
ΔH=-42 kJ·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
13.依据题意,写出下列反应的热化学方程式。
(1)若适量的N2和O2完全反应生成NO2,每生成23 g NO2需要吸收16.95 kJ热量。则该反应的热化学方程式为__________________________________
_______________。
(2)用NA表示阿伏加德罗常数的值,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。则该反应
的热化学方程式为___________________________________________________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
N2(g)+2O2(g)===2NO2(g) ΔH=
+67.8 kJ·mol-1
(3)已知拆开1 mol H—H、1 mol N—H、1 mol N≡N分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_________________________________________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
14.(1)用O2将HCl转化为Cl2的过程如图所示。
2
其中,过程①的热化学方程式为2HCl(g)+CuO(s)===H2O(g)+CuCl2(s) ΔH1,过程②生成1 mol Cl2的反应热为ΔH2,则由HCl(g)生成Cl2(g)的热
化学方程式为________________________________________________(反
应热用ΔH1和ΔH2表示)。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)已知:
①CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206 kJ·mol-1
②CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802 kJ·mol-1
写出由CO2(g)和H2O(g)生成CO(g)的热化学方程式:__________________
______________________________________________。
CO2(g)+3H2O(g)
===2O2(g)+CO(g)+3H2(g) ΔH=+1 008 kJ·mol-1
根据盖斯定律,由①-②得CO2(g)+3H2O(g)===2O2(g)+CO(g)+3H2(g) ΔH=+206 kJ·mol-1-(-802 kJ·mol-1)=+1 008 kJ·mol-1。
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
15.热力学标准态(298.15 K、101 kPa)下,由稳定单质发生反应生成1 mol化合物的反应热叫作该化合物的生成热(ΔH)。图甲为第ⅥA族元素氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
2
(1)①请你归纳非金属元素氢化物的稳定性与氢化物的生成热ΔH的关系:________________________________。
非金属元素氢化物越稳定,ΔH越小
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
②硒化氢在上述条件下发生分解反应的热化学方程式为______________
__________________________。
H2Se(g)===Se(s)+H2(g) ΔH=-81 kJ·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)在25 ℃、101 kPa下,已知SiH4气体在氧气中完全燃烧后恢复至原状态,平均每转移1 mol电子放热190.0 kJ,该反应的热化学方程式是_______________________________________________________。
2
SiH4(g)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1 520.0 kJ·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(3)根据图乙写出反应CO(g)+2H2(g)===CH3OH(g)的热化学方程式:____________________________________________。
2
CO(g)+2H2(g)===CH3OH(g) ΔH=-91 kJ·mol-1
ΔH=419 kJ·mol-1-510 kJ·mol-1=-91 kJ·mol-1,故该反应的热化学方程式为CO(g)+2H2(g)===CH3OH(g) ΔH=-91 kJ·mol-1。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(4)由金红石(TiO2)制取单质Ti的步骤为
2
已知:Ⅰ.C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
Ⅱ.2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Ⅲ.TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH=+141 kJ·mol-1
①TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH=_____________。
-80 kJ·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
根据盖斯定律,由2×Ⅰ-Ⅱ+Ⅲ可得:TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g) ΔH=-80 kJ·mol-1。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
②反应TiCl4+2Mg 2MgCl2+Ti在Ar气氛中进行的理由是________
____________________________________。
防止高温下Mg、Ti与空气中的O2(或CO2、N2)作用
2
返回
