4.2.1元素性质的周期性变化规律 课件(共30张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 4.2.1元素性质的周期性变化规律 课件(共30张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 37.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-22 19:19:44 | ||
图片预览



文档简介
(共30张PPT)
第一节 铁及其化合物
第四章 物质结构 元素周期律
第1课时 元素性质的周期性变化规律
目录
CONTENT
二、元素周期律
第四章 物质结构 元素周期律
一、原子结构的周期性变化
1.
2.
3.
4.
学习目标
认识原子结构、元素性质呈周期性变化的规律
掌握同周期主族元素金属性和非金属性的递变规律
建构微观原子结构特点决定宏观性质的探究思路和模式
认识同周期元素的核外电子排布、化合价、原子半径
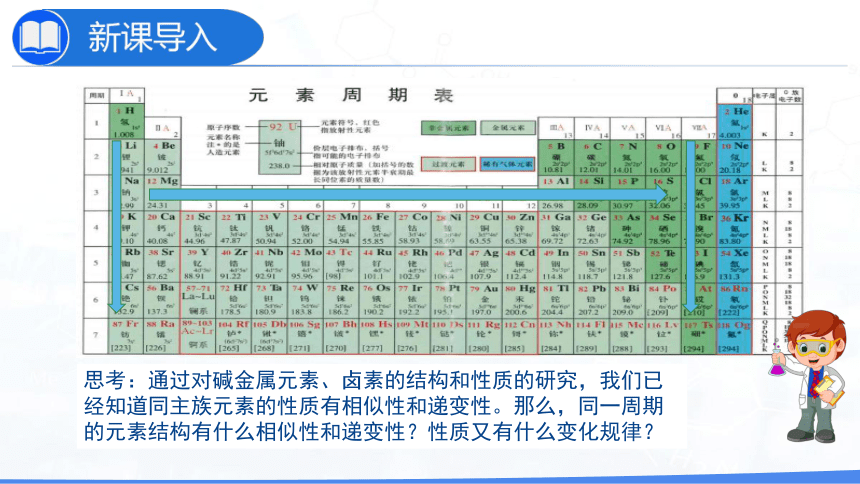
思考:通过对碱金属元素、卤素的结构和性质的研究,我们已经知道同主族元素的性质有相似性和递变性。那么,同一周期的元素结构有什么相似性和递变性?性质又有什么变化规律?
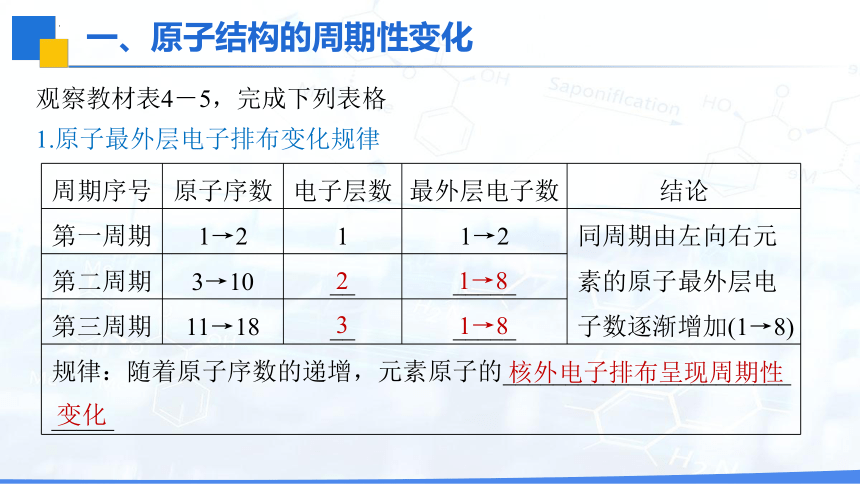
观察教材表4-5,完成下列表格
1.原子最外层电子排布变化规律
周期序号 原子序数 电子层数 最外层电子数 结论
第一周期 1→2 1 1→2 同周期由左向右元素的原子最外层电子数逐渐增加(1→8)
第二周期 3→10 __ _____ 第三周期 11→18 __ _____ 规律:随着原子序数的递增,元素原子的_______________________ _____ 1→8
1→8
核外电子排布呈现周期性
变化
2
3
一、原子结构的周期性变化
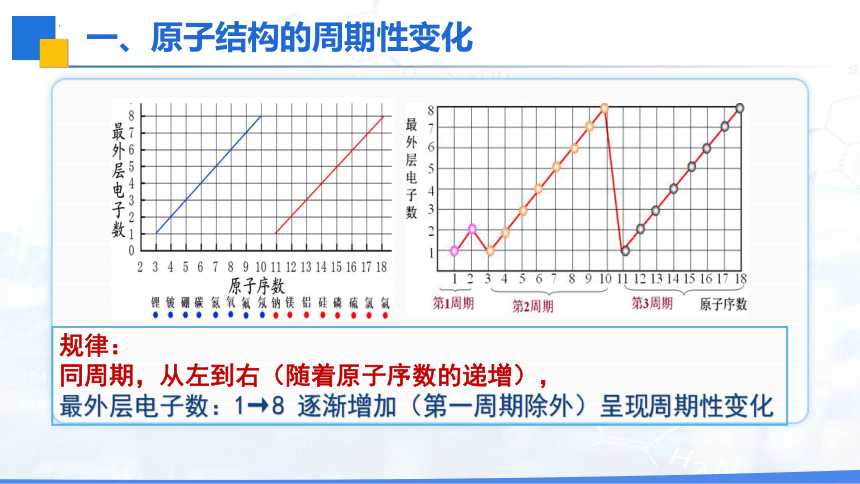
规律:
同周期,从左到右(随着原子序数的递增),
最外层电子数:1→8 逐渐增加(第一周期除外)呈现周期性变化
一、原子结构的周期性变化
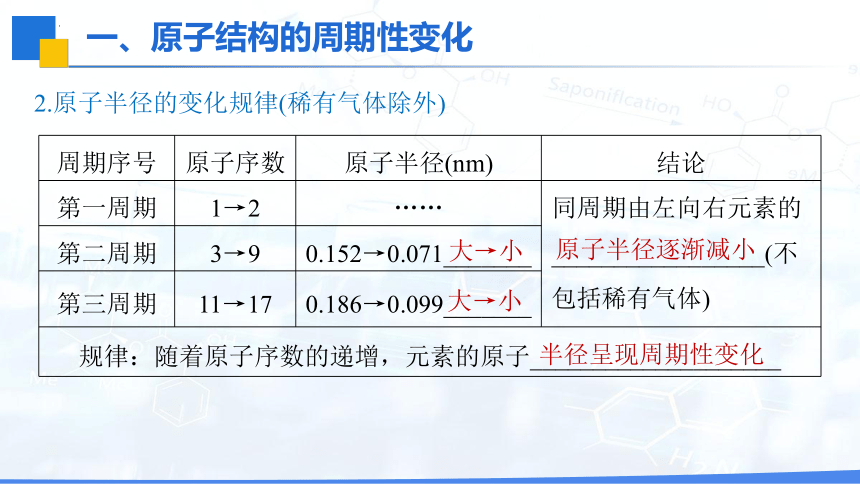
2.原子半径的变化规律(稀有气体除外)
周期序号 原子序数 原子半径(nm) 结论
第一周期 1→2 …… 同周期由左向右元素的_________________(不包括稀有气体)
第二周期 3→9 0.152→0.071_______ 第三周期 11→17 0.186→0.099_______ 规律:随着原子序数的递增,元素的原子____________________ 大→小
大→小
原子半径逐渐减小
半径呈现周期性变化
一、原子结构的周期性变化
一、原子结构的周期性变化
2.原子半径的变化规律(稀有气体除外)
一、原子结构的周期性变化
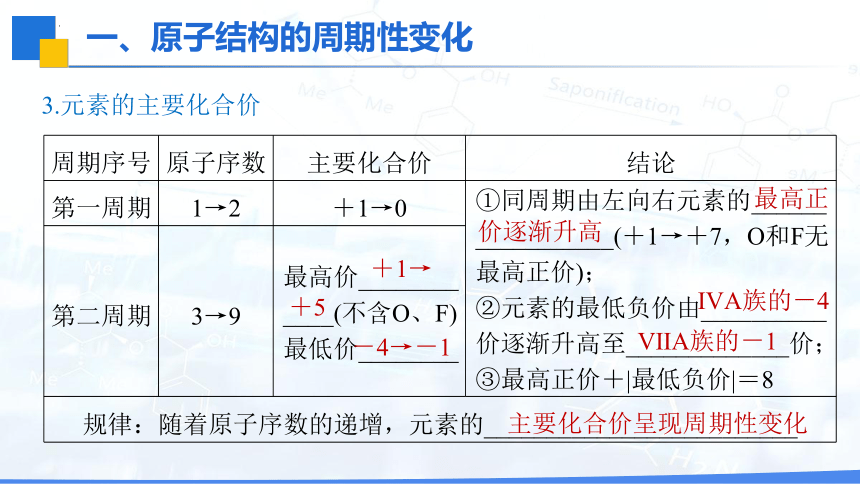
3.元素的主要化合价
周期序号 原子序数 主要化合价 结论
第一周期 1→2 +1→0 ①同周期由左向右元素的______
___________(+1→+7,O和F无最高正价);
②元素的最低负价由__________价逐渐升高至_____________价;
③最高正价+|最低负价|=8
第二周期 3→9 最高价________ ____(不含O、F) 最低价________ 规律:随着原子序数的递增,元素的_________________________ +1→
+5
-4→-1
最高正
价逐渐升高
ⅣA族的-4
ⅦA族的-1
主要化合价呈现周期性变化
一、原子结构的周期性变化
锂
铍
硼
氧
氟
钠
镁
铝
硅
磷
硫
氯
碳
氮
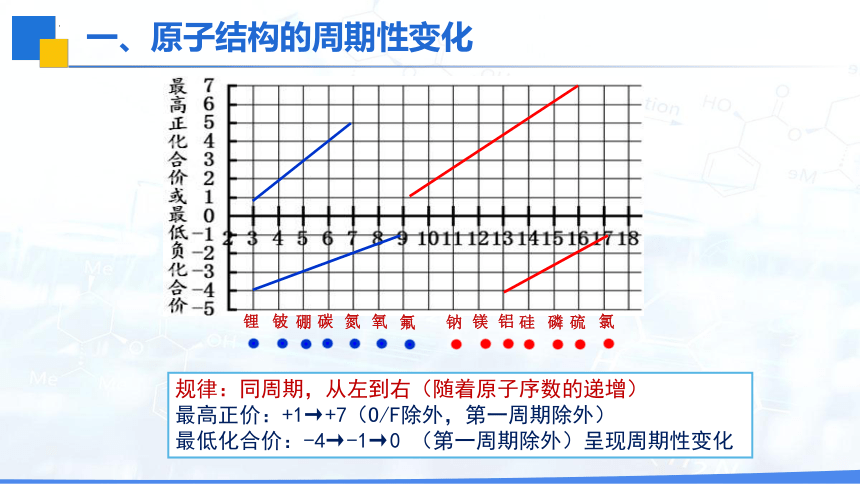
规律:同周期,从左到右(随着原子序数的递增)
最高正价:+1→+7(O/F除外,第一周期除外)
最低化合价:-4→-1→0 (第一周期除外)呈现周期性变化
一、原子结构的周期性变化
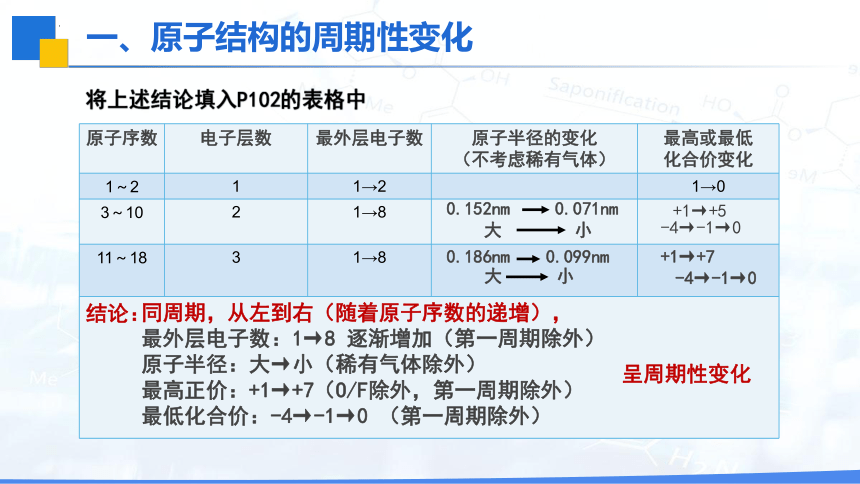
将上述结论填入P102的表格中
原子序数 电子层数 最外层电子数 原子半径的变化 (不考虑稀有气体) 最高或最低
化合价变化
1~2 1 1→2 1→0
3~10 2 1→8
11~18 3 1→8
-4→-1→0
+1→+5
0.152nm 0.071nm
大 小
-4→-1→0
+1→+7
0.186nm 0.099nm
大 小
结论:
同周期,从左到右(随着原子序数的递增),
最外层电子数:1→8 逐渐增加(第一周期除外)
原子半径:大→小(稀有气体除外)
最高正价:+1→+7(O/F除外,第一周期除外)
最低化合价:-4→-1→0 (第一周期除外)
呈周期性变化
1.(1)同周期元素随核电荷数增加原子半径逐渐减小的原因是什么?
提示 同周期元素电子层数相同,核电荷数增多,即原子核所带正电荷增多,原子核对核外电子吸引力增大,原子半径减小。
(2)电子层数多的元素原子半径一定大于电子层数少的元素吗?
提示 不一定,如第二周期的Li比第三周期的S、Cl等原子半径大。
非金属性逐渐( )
得电子能力逐渐( )
吸引力( )
同周期左到右:电子层数同,原子半径↘
递增)
减弱
减弱
增强
增强
失电子能力逐渐( )
金属性逐渐( )
1.主族元素主要化合价的确定方法
(1)最高正价=主族的序号=最外层电子数(O、F除外)。
(2)最低负价=最高正价-8(H、O、F除外)。
(3)H最高价为+1,最低价为-1;O最低价为-2;F无正化合价,最低价为-1。
2.氢化物及其最高价含氧酸的关系
ⅣA ⅤA ⅥA ⅦA
氢化物 RH4 RH3 H2R HR
最高价氧化物对应的水化物 H2RO3或H4RO4 H3RO4或HRO3 H2RO4 HRO4
一、原子结构的周期性变化
二、元素周期律
1、第三周期元素的金属性和非金属性
(1)第三周期元素电子层数_____,由左向右元素的原子最外层电子数_________,原子半径依次_____,失电子的能力依次_____,得电子的能力依次_____,预测它们的金属性依次_____,非金属性依次_____。
相同
逐渐
增加
减小
减弱
增强
减弱
增强
(2)Na、Mg、Al金属性的比较。①与水反应。钠与冷水剧烈反应,生成强碱NaOH和氢气,同时放出大量的热。而镁与冷水反应缓慢,加热至水沸腾,Mg可与水反应,生成____________和氢气。
②最高价氢氧化物的生成与溶解。
Al(OH)3 :__________________________________________。
Al(OH)3+NaOH===NaAlO2+2H2O
Mg(OH)2
二、元素周期律
②氢氧化铝既能与酸反应生成盐和水,又能与强碱溶液反应生成盐和水,Al(OH)3为两性氢氧化物。反应的离子方程式分别为:____________________________、_________________________
Al(OH)3+3H+===Al3++3H2O
(3)两性氢氧化物
概念:既能与强酸反应又能与强碱反应,且均生成盐和水的氢氧化物。
氢氧化铝的两性
①向AlCl3溶液中加入过量氨水,现象:_____________,
反应方程式:____________________________________。
产生白色沉淀
AlCl3+3NH3·H2O ==== 3NH4Cl+Al(OH)3↓
二、元素周期律
单质与水反应的难易程度:Na>Mg
③现象:加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,滴加酚酞溶液变为_____色。
④结论:镁与_______几乎不反应,能与热水反应,反应的化学方程式为
______________________________。
粉红
冷水
二、元素周期律
Al Mg
原理 最高价氧化物对应水化物的碱性强弱 实验操作
(4)镁、铝元素金属性强弱的实验探究
二、元素周期律
沉淀溶 解情况 沉淀________ 沉淀________ 沉淀_____ 沉淀_______
相关反应的化学方程式 _______________________________ ____________________________________ ___________________________________
实验结论 金属性:Mg___Al 逐渐溶解
逐渐溶解
溶解
不溶解
Al(OH)3+3HCl===AlCl3+3H2O
Al(OH)3+NaOH===
NaAlO22H2O
Mg(OH)2+2HCl===
MgCl2+2H2O
>
金属元素性质 Na Mg Al
最高价氧化物对应水化物碱性
NaOH
强碱
Mg(OH)2
中强碱
Al(OH)3两性
氢氧化物(弱碱性)
二、元素周期律
元素 Si P S Cl
最高价氧化物对应的水化物(含氧酸) 名称 ______ ______ ______ __________
化学式 ______ ______ ______ __________
酸性强弱 ______ ______ ______ ______(酸性比H2SO4强)
硅酸
磷酸
硫酸
高氯酸
H2SiO3
H3PO4
H2SO4
HClO4
弱酸
中强酸
强酸
强酸
增强
(5)硅、磷、硫、氯的非金属性的递变规律
结论:Si、P、S、Cl的非金属性逐渐_________。
根据实验,可得出第三周期元素金属性、非金属性的递变规律:
金属性逐渐减弱,非金属性逐渐增强
二、元素周期律
(7)同周期元素性质递变规律
同一周期从左到右,元素金属性逐渐_____,非金属性逐渐_____。
(8)元素周期律
①内容:元素的性质随着原子序数的递增而呈周期性的变化。
②实质:元素性质的周期性变化是原子的______________的周期性变化的必然结果。
减弱
增强
核外电子排布
(6)元素性质与原子结构的关系
在同一周期中,各元素的原子核外电子层数相同,但从左到右,核电荷数依次增多,原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强。因此,金属性逐渐减弱,非金属性逐渐增强。
同周期、同主族元素性质的递变规律
项目 同周期(自左至右) 同主族(从上到下)
原子半径 减小 增大
主要化合价 +1→+7 -4→-1 (F,O无最高正价) 相似
金属性 减弱 增强
非金属性 增强 减弱
最高价氧 化物对应 水化物、氢化物 酸性逐渐增强 碱性逐渐减弱 稳定性逐渐增强 还原性逐渐减弱 酸性逐渐减弱
碱性逐渐增强
稳定性逐渐减弱
还原性逐渐增强
(1)Al(OH)3是两性氢氧化物,与氨水、盐酸均可反应( )
(2)盐酸可以与Na2CO3溶液反应生成CO2,可由此推出非金属性
Cl>C( )
(3)第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性( )
(4)第二周期元素从左至右金属性逐渐减弱,非金属性逐渐增强( )
√
×
×
×
(5)从原子结构角度解释同周期元素从左至右金属性减弱,非金属性增强的原因。
提示 同一周期电子层数相同,从左至右随核电荷数增加,原子半径逐渐减小,原子核对最外层电子吸引力逐渐增强,失电子能力逐渐减弱,金属性逐渐减弱,得电子能力逐渐增强,非金属性逐渐增强。
1.同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
A.最高价含氧酸的酸性:H3ZO4>H2YO4>HXO4
B.非金属性:X>Y>Z
C.气态氢化物的稳定性按X、Y、Z顺序逐渐增强
D.元素的最低负化合价的绝对值按X、Y、Z顺序逐渐减小
B
2.某主族元素的最高正价与最低负价的代数和为4,则该元素原子的最外层电子数为( )
A.4 B.5 C.6 D.7
D
3.元素性质呈周期性变化的决定因素是( )
A.元素原子半径大小呈周期性变化
B.元素相对原子质量依次增大
C.元素原子核外电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化
C
4.元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是七种短周期的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
元素代号 A B C D E F G
原子半径/nm 0.037 0.160 0.143 0.102 0.099 0.074 0.075
主要化合价 +1 +2 +3 +6、-2 +7、-1 -2 +5、-3
(1)C元素在元素周期表中的位置是第____周期_____族。
三
ⅢA
(2)B的原子结构示意图为________。
谢谢
第一节 铁及其化合物
第四章 物质结构 元素周期律
第1课时 元素性质的周期性变化规律
目录
CONTENT
二、元素周期律
第四章 物质结构 元素周期律
一、原子结构的周期性变化
1.
2.
3.
4.
学习目标
认识原子结构、元素性质呈周期性变化的规律
掌握同周期主族元素金属性和非金属性的递变规律
建构微观原子结构特点决定宏观性质的探究思路和模式
认识同周期元素的核外电子排布、化合价、原子半径
思考:通过对碱金属元素、卤素的结构和性质的研究,我们已经知道同主族元素的性质有相似性和递变性。那么,同一周期的元素结构有什么相似性和递变性?性质又有什么变化规律?
观察教材表4-5,完成下列表格
1.原子最外层电子排布变化规律
周期序号 原子序数 电子层数 最外层电子数 结论
第一周期 1→2 1 1→2 同周期由左向右元素的原子最外层电子数逐渐增加(1→8)
第二周期 3→10 __ _____ 第三周期 11→18 __ _____ 规律:随着原子序数的递增,元素原子的_______________________ _____ 1→8
1→8
核外电子排布呈现周期性
变化
2
3
一、原子结构的周期性变化
规律:
同周期,从左到右(随着原子序数的递增),
最外层电子数:1→8 逐渐增加(第一周期除外)呈现周期性变化
一、原子结构的周期性变化
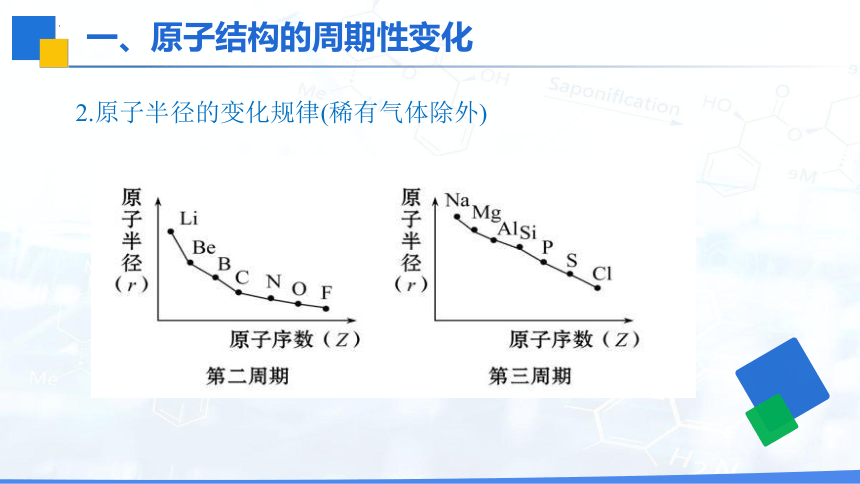
2.原子半径的变化规律(稀有气体除外)
周期序号 原子序数 原子半径(nm) 结论
第一周期 1→2 …… 同周期由左向右元素的_________________(不包括稀有气体)
第二周期 3→9 0.152→0.071_______ 第三周期 11→17 0.186→0.099_______ 规律:随着原子序数的递增,元素的原子____________________ 大→小
大→小
原子半径逐渐减小
半径呈现周期性变化
一、原子结构的周期性变化
一、原子结构的周期性变化
2.原子半径的变化规律(稀有气体除外)
一、原子结构的周期性变化
3.元素的主要化合价
周期序号 原子序数 主要化合价 结论
第一周期 1→2 +1→0 ①同周期由左向右元素的______
___________(+1→+7,O和F无最高正价);
②元素的最低负价由__________价逐渐升高至_____________价;
③最高正价+|最低负价|=8
第二周期 3→9 最高价________ ____(不含O、F) 最低价________ 规律:随着原子序数的递增,元素的_________________________ +1→
+5
-4→-1
最高正
价逐渐升高
ⅣA族的-4
ⅦA族的-1
主要化合价呈现周期性变化
一、原子结构的周期性变化
锂
铍
硼
氧
氟
钠
镁
铝
硅
磷
硫
氯
碳
氮
规律:同周期,从左到右(随着原子序数的递增)
最高正价:+1→+7(O/F除外,第一周期除外)
最低化合价:-4→-1→0 (第一周期除外)呈现周期性变化
一、原子结构的周期性变化
将上述结论填入P102的表格中
原子序数 电子层数 最外层电子数 原子半径的变化 (不考虑稀有气体) 最高或最低
化合价变化
1~2 1 1→2 1→0
3~10 2 1→8
11~18 3 1→8
-4→-1→0
+1→+5
0.152nm 0.071nm
大 小
-4→-1→0
+1→+7
0.186nm 0.099nm
大 小
结论:
同周期,从左到右(随着原子序数的递增),
最外层电子数:1→8 逐渐增加(第一周期除外)
原子半径:大→小(稀有气体除外)
最高正价:+1→+7(O/F除外,第一周期除外)
最低化合价:-4→-1→0 (第一周期除外)
呈周期性变化
1.(1)同周期元素随核电荷数增加原子半径逐渐减小的原因是什么?
提示 同周期元素电子层数相同,核电荷数增多,即原子核所带正电荷增多,原子核对核外电子吸引力增大,原子半径减小。
(2)电子层数多的元素原子半径一定大于电子层数少的元素吗?
提示 不一定,如第二周期的Li比第三周期的S、Cl等原子半径大。
非金属性逐渐( )
得电子能力逐渐( )
吸引力( )
同周期左到右:电子层数同,原子半径↘
递增)
减弱
减弱
增强
增强
失电子能力逐渐( )
金属性逐渐( )
1.主族元素主要化合价的确定方法
(1)最高正价=主族的序号=最外层电子数(O、F除外)。
(2)最低负价=最高正价-8(H、O、F除外)。
(3)H最高价为+1,最低价为-1;O最低价为-2;F无正化合价,最低价为-1。
2.氢化物及其最高价含氧酸的关系
ⅣA ⅤA ⅥA ⅦA
氢化物 RH4 RH3 H2R HR
最高价氧化物对应的水化物 H2RO3或H4RO4 H3RO4或HRO3 H2RO4 HRO4
一、原子结构的周期性变化
二、元素周期律
1、第三周期元素的金属性和非金属性
(1)第三周期元素电子层数_____,由左向右元素的原子最外层电子数_________,原子半径依次_____,失电子的能力依次_____,得电子的能力依次_____,预测它们的金属性依次_____,非金属性依次_____。
相同
逐渐
增加
减小
减弱
增强
减弱
增强
(2)Na、Mg、Al金属性的比较。①与水反应。钠与冷水剧烈反应,生成强碱NaOH和氢气,同时放出大量的热。而镁与冷水反应缓慢,加热至水沸腾,Mg可与水反应,生成____________和氢气。
②最高价氢氧化物的生成与溶解。
Al(OH)3 :__________________________________________。
Al(OH)3+NaOH===NaAlO2+2H2O
Mg(OH)2
二、元素周期律
②氢氧化铝既能与酸反应生成盐和水,又能与强碱溶液反应生成盐和水,Al(OH)3为两性氢氧化物。反应的离子方程式分别为:____________________________、_________________________
Al(OH)3+3H+===Al3++3H2O
(3)两性氢氧化物
概念:既能与强酸反应又能与强碱反应,且均生成盐和水的氢氧化物。
氢氧化铝的两性
①向AlCl3溶液中加入过量氨水,现象:_____________,
反应方程式:____________________________________。
产生白色沉淀
AlCl3+3NH3·H2O ==== 3NH4Cl+Al(OH)3↓
二、元素周期律
单质与水反应的难易程度:Na>Mg
③现象:加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,滴加酚酞溶液变为_____色。
④结论:镁与_______几乎不反应,能与热水反应,反应的化学方程式为
______________________________。
粉红
冷水
二、元素周期律
Al Mg
原理 最高价氧化物对应水化物的碱性强弱 实验操作
(4)镁、铝元素金属性强弱的实验探究
二、元素周期律
沉淀溶 解情况 沉淀________ 沉淀________ 沉淀_____ 沉淀_______
相关反应的化学方程式 _______________________________ ____________________________________ ___________________________________
实验结论 金属性:Mg___Al 逐渐溶解
逐渐溶解
溶解
不溶解
Al(OH)3+3HCl===AlCl3+3H2O
Al(OH)3+NaOH===
NaAlO22H2O
Mg(OH)2+2HCl===
MgCl2+2H2O
>
金属元素性质 Na Mg Al
最高价氧化物对应水化物碱性
NaOH
强碱
Mg(OH)2
中强碱
Al(OH)3两性
氢氧化物(弱碱性)
二、元素周期律
元素 Si P S Cl
最高价氧化物对应的水化物(含氧酸) 名称 ______ ______ ______ __________
化学式 ______ ______ ______ __________
酸性强弱 ______ ______ ______ ______(酸性比H2SO4强)
硅酸
磷酸
硫酸
高氯酸
H2SiO3
H3PO4
H2SO4
HClO4
弱酸
中强酸
强酸
强酸
增强
(5)硅、磷、硫、氯的非金属性的递变规律
结论:Si、P、S、Cl的非金属性逐渐_________。
根据实验,可得出第三周期元素金属性、非金属性的递变规律:
金属性逐渐减弱,非金属性逐渐增强
二、元素周期律
(7)同周期元素性质递变规律
同一周期从左到右,元素金属性逐渐_____,非金属性逐渐_____。
(8)元素周期律
①内容:元素的性质随着原子序数的递增而呈周期性的变化。
②实质:元素性质的周期性变化是原子的______________的周期性变化的必然结果。
减弱
增强
核外电子排布
(6)元素性质与原子结构的关系
在同一周期中,各元素的原子核外电子层数相同,但从左到右,核电荷数依次增多,原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强。因此,金属性逐渐减弱,非金属性逐渐增强。
同周期、同主族元素性质的递变规律
项目 同周期(自左至右) 同主族(从上到下)
原子半径 减小 增大
主要化合价 +1→+7 -4→-1 (F,O无最高正价) 相似
金属性 减弱 增强
非金属性 增强 减弱
最高价氧 化物对应 水化物、氢化物 酸性逐渐增强 碱性逐渐减弱 稳定性逐渐增强 还原性逐渐减弱 酸性逐渐减弱
碱性逐渐增强
稳定性逐渐减弱
还原性逐渐增强
(1)Al(OH)3是两性氢氧化物,与氨水、盐酸均可反应( )
(2)盐酸可以与Na2CO3溶液反应生成CO2,可由此推出非金属性
Cl>C( )
(3)第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性( )
(4)第二周期元素从左至右金属性逐渐减弱,非金属性逐渐增强( )
√
×
×
×
(5)从原子结构角度解释同周期元素从左至右金属性减弱,非金属性增强的原因。
提示 同一周期电子层数相同,从左至右随核电荷数增加,原子半径逐渐减小,原子核对最外层电子吸引力逐渐增强,失电子能力逐渐减弱,金属性逐渐减弱,得电子能力逐渐增强,非金属性逐渐增强。
1.同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
A.最高价含氧酸的酸性:H3ZO4>H2YO4>HXO4
B.非金属性:X>Y>Z
C.气态氢化物的稳定性按X、Y、Z顺序逐渐增强
D.元素的最低负化合价的绝对值按X、Y、Z顺序逐渐减小
B
2.某主族元素的最高正价与最低负价的代数和为4,则该元素原子的最外层电子数为( )
A.4 B.5 C.6 D.7
D
3.元素性质呈周期性变化的决定因素是( )
A.元素原子半径大小呈周期性变化
B.元素相对原子质量依次增大
C.元素原子核外电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化
C
4.元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是七种短周期的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
元素代号 A B C D E F G
原子半径/nm 0.037 0.160 0.143 0.102 0.099 0.074 0.075
主要化合价 +1 +2 +3 +6、-2 +7、-1 -2 +5、-3
(1)C元素在元素周期表中的位置是第____周期_____族。
三
ⅢA
(2)B的原子结构示意图为________。
谢谢
