化学人教版(2019)必修第一册1.3氧化还原反应(共73张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3氧化还原反应(共73张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 21.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-25 00:00:00 | ||
图片预览



文档简介
(共73张PPT)
化学必修一 第1章 第3节氧化还原反应 (4课时)
第1课时 氧化还原反应
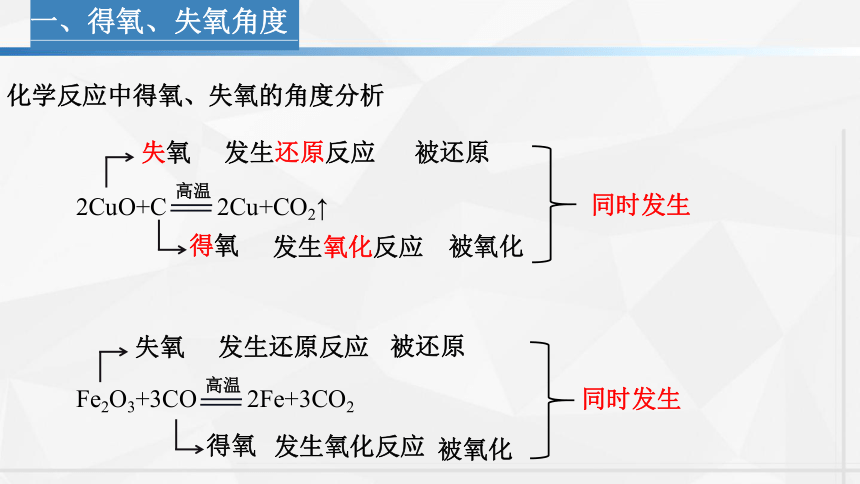
一、得氧、失氧角度
2CuO+C 2Cu+CO2↑
高温
失氧
发生还原反应
得氧
发生氧化反应
化学反应中得氧、失氧的角度分析
被还原
被氧化
Fe2O3+3CO 2Fe+3CO2
高温
失氧
发生还原反应
得氧
发生氧化反应
被还原
被氧化
同时发生
同时发生
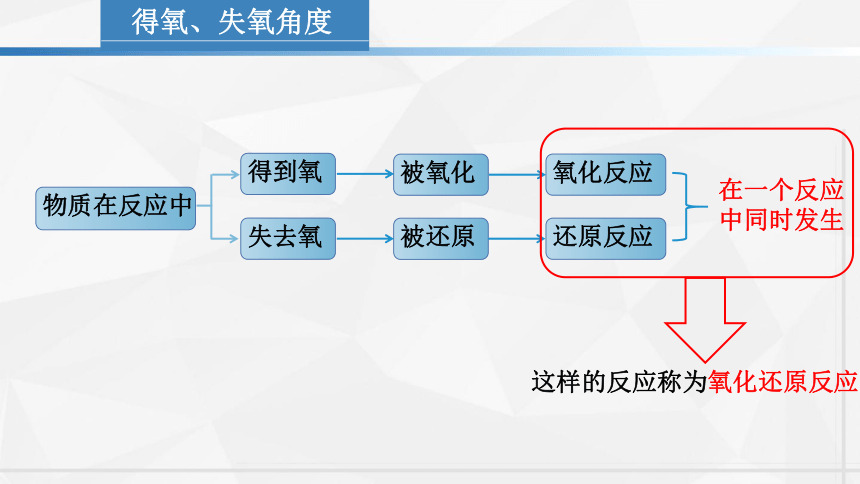
得氧、失氧角度
物质在反应中
得到氧
失去氧
被氧化
被还原
氧化反应
还原反应
在一个反应
中同时发生
这样的反应称为氧化还原反应
二、化合价变化角度
2CuO+C 2Cu+CO2↑
高温
+2 0 0 +4
化合价降低
化合价升高
Cu元素:
被还原
发生还原反应
C元素:
被氧化
发生氧化反应
同时发生
Fe2O3+3CO 2Fe+3CO2
高温
+3 +2 0 +4
化合价降低
Fe元素:
被还原
发生还原反应
化合价升高
C元素:
被氧化
发生氧化反应
同时发生
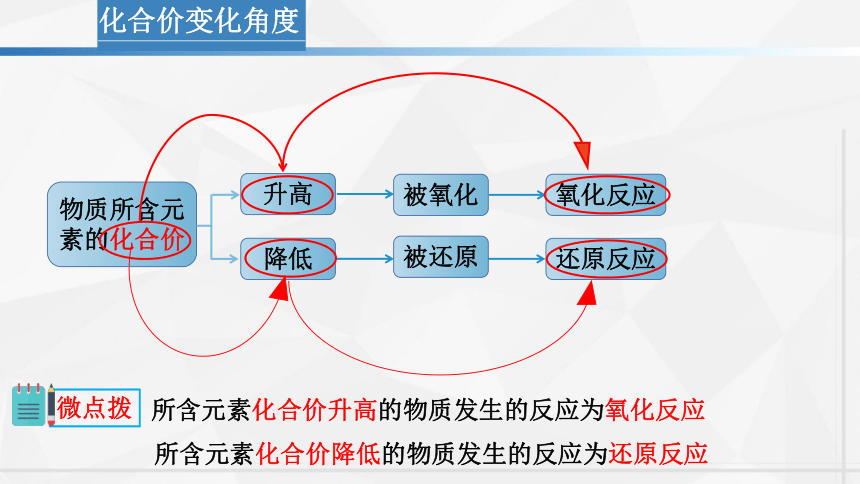
化合价变化角度
物质所含元素的化合价
升高
降低
被氧化
被还原
氧化反应
还原反应
所含元素化合价升高的物质发生的反应为氧化反应
微点拨
所含元素化合价降低的物质发生的反应为还原反应
化合价变化角度
虽然没有物质得氧、失氧,但反应前后却有元素化合价的变化
微点拨
Fe+ CuSO4 FeSO4+Cu
0 +2 +2 0
化合价升高
化合价降低
Fe元素:
被氧化
发生氧化反应
Cu元素:
被还原
发生还原反应
反应前后有元素的化合价发生变化,是氧化还原反应的重要特征。
这样的反应也属于氧化还原反应
本质?
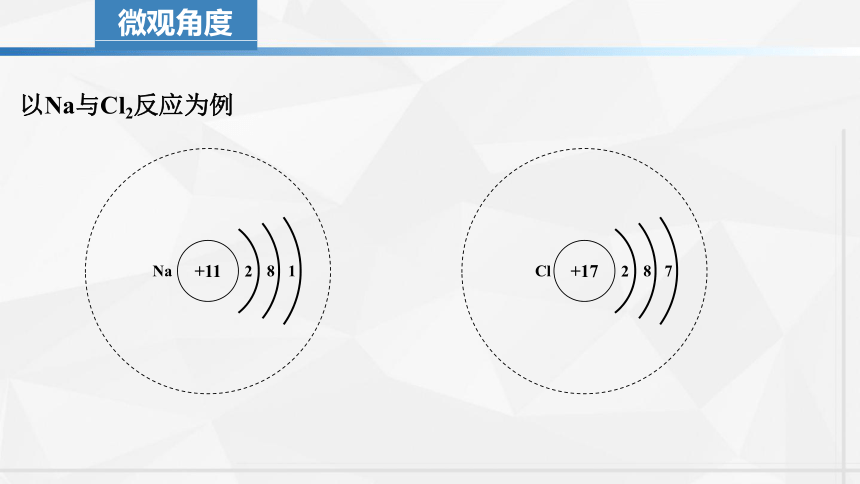
微观角度
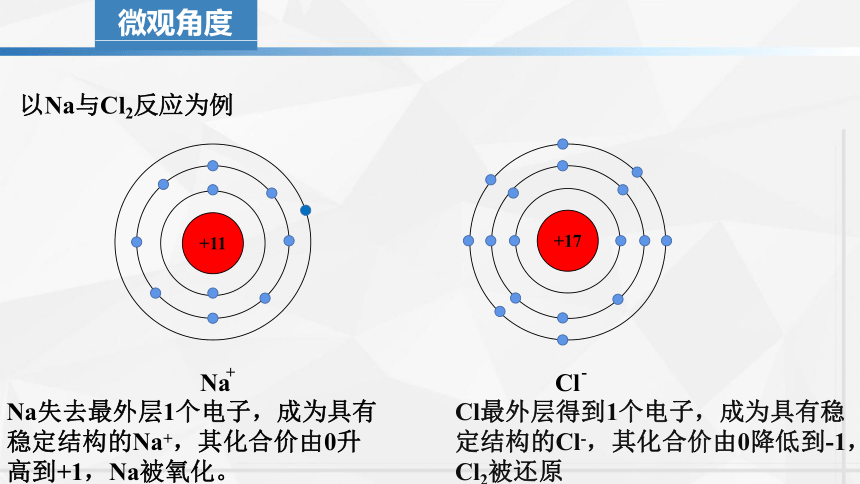
以Na与Cl2反应为例
+11
8
2
1
Na
+17
8
2
7
Cl
微观角度
以Na与Cl2反应为例
+11
+17
Cl
Na
-
+
Na失去最外层1个电子,成为具有稳定结构的Na+,其化合价由0升高到+1,Na被氧化。
Cl最外层得到1个电子,成为具有稳定结构的Cl-,其化合价由0降低到-1,Cl2被还原
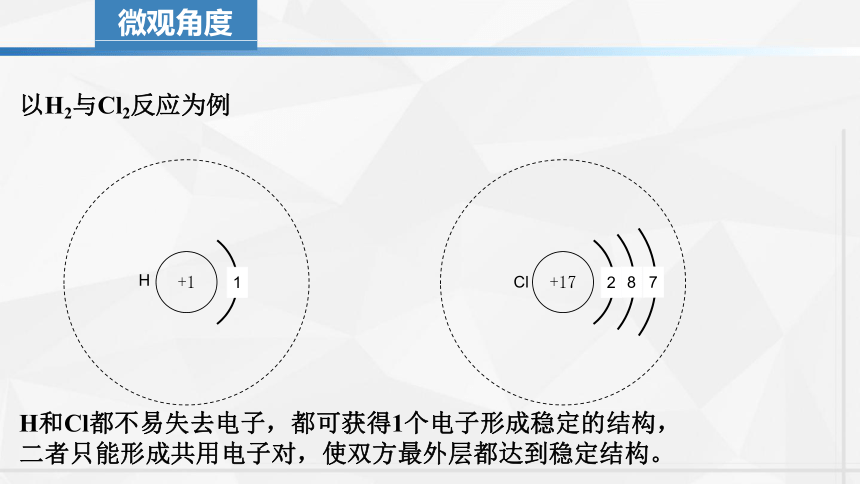
微观角度
以H2与Cl2反应为例
+1
H
+17
Cl
1
2
8
7
H和Cl都不易失去电子,都可获得1个电子形成稳定的结构,
二者只能形成共用电子对,使双方最外层都达到稳定结构。
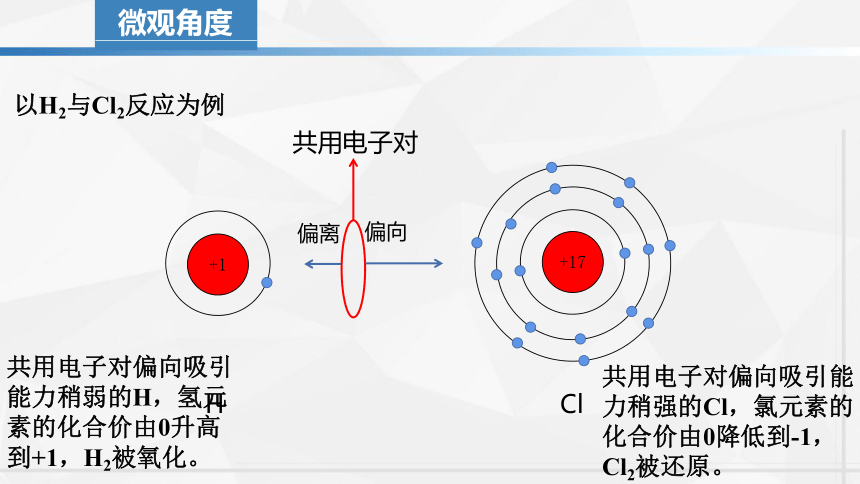
微观角度
以H2与Cl2反应为例
+1
+17
Cl
H
共用电子对
偏向
偏离
共用电子对偏向吸引能力稍弱的H,氢元素的化合价由0升高到+1,H2被氧化。
共用电子对偏向吸引能力稍强的Cl,氯元素的化合价由0降低到-1,Cl2被还原。
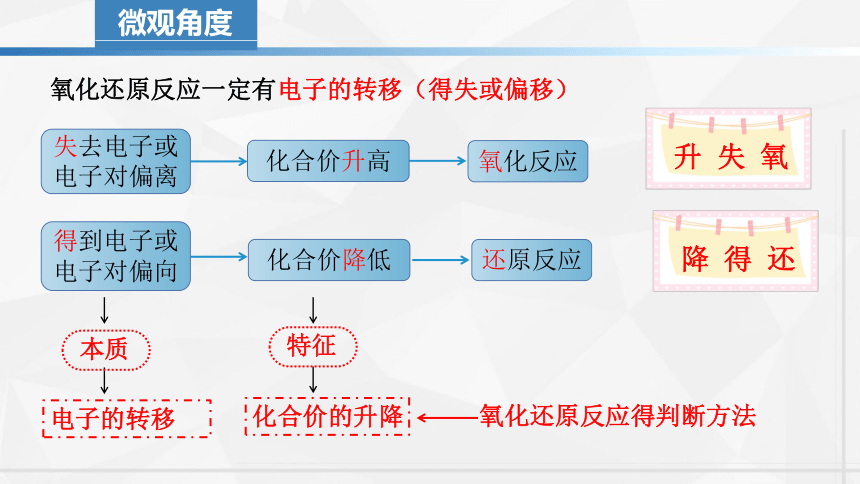
微观角度
失去电子或
电子对偏离
得到电子或
电子对偏向
氧化反应
还原反应
氧化还原反应一定有电子的转移(得失或偏移)
化合价升高
化合价降低
升 失 氧
降 得 还
电子的转移
化合价的升降
本质
特征
氧化还原反应得判断方法
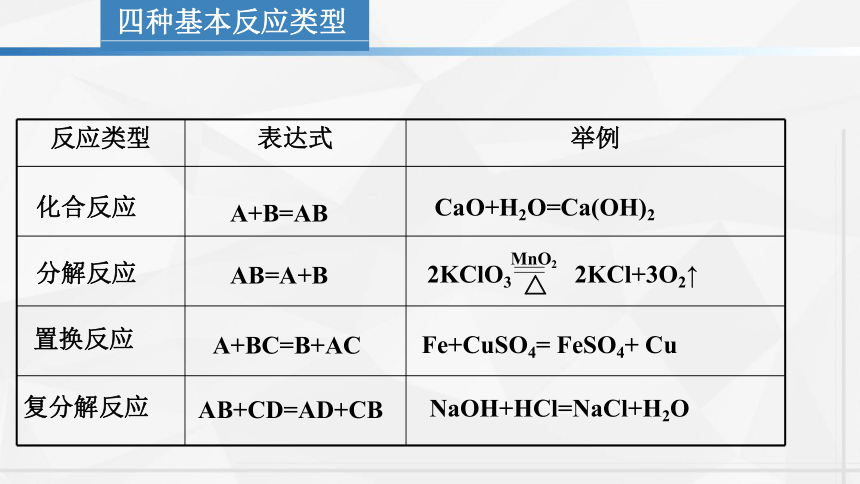
四种基本反应类型
反应类型 表达式 举例
化合反应
分解反应
置换反应
复分解反应
AB=A+B
A+BC=B+AC
AB+CD=AD+CB
A+B=AB
CaO+H2O=Ca(OH)2
2KClO3 2KCl+3O2↑
△
MnO2
Fe+CuSO4= FeSO4+ Cu
NaOH+HCl=NaCl+H2O
化合反应
分解反应
反应类型的关系
氧化还原反应
置换反应
复分解反应
有单质生成的分解反应
有单质参加的化合反应
分解
化合
氧化还原反应
置换
复分解反应
得氧失氧角度
A
化合价变化角度
B
微观角度
C
本质与特征
D
四种基本反应类型
E
反应类型之间的关系
E
F
化学必修一 第1章 第3节氧化还原反应
第2课时 氧化剂 还原剂
基本概念
1.氧化剂
在氧化还原反应中,所含元素的化合价降低,即得电子(或电子对偏向)的物质叫做氧化剂
2.还原剂
在氧化还原反应中,所含元素的化合价升高,即失电子(或电子对偏离)的物质叫做还原剂。
3.氧化产物
还原剂被氧化生成的物质,即化合价升高的元素应的产物。
4.还原产物
氧化剂被还原生成的物质,即化合价降低的元素应的产物
基本概念
5.氧化性
物质得到电子(或电子对偏向)的能力
6.还原性
物质失去电子(或电子对偏离)的能力
微点拨
氧化剂和氧化产物具有氧化性,氧化剂的氧化性强于氧化产物
还原剂和还原产物具有还原性,还原剂的还原性强于还原产物
氧化性和还原性强弱与得失电子的难易程度有关,与得失电子数目无关
基本概念
氧化剂
还原剂
+
还原产物
+
氧化产物
化合价升高
失去电子
被氧化
化合价降低
得到电子
被还原
e-
微点拨
在有些反应中,氧化剂和还原剂可能是同一种物质
氧化产物和还原产物也可能是同一种物质
基本概念
氧化剂:
降 得 还
化合价降低
得电子
被还原
发生还原反应
得到还原产物
还原剂:
升 失 氧
化合价升高
失电子
被氧化
发生氧化反应
得到氧化产物
物质类型 实例 还原产物
活泼的
非金属单质
元素处于高价时的物质
某些氧化物和过氧化物
强氧化性酸
卤素单质(X2)
X-
O2
O2-、O22-、OH-、H2O
KMnO4(H+)
Mn2+
HNO3
NO2、NO
浓硫酸
SO2
Fe3+
Fe2+、Fe
MnO2
Mn2+
H2O2
H2O
Na2O2
O2-、OH-、H2O
HClO
Cl-、Cl2
1.常见的氧化剂
常见的氧化剂和还原剂
2.常见的还原剂
物质类型 实例 氧化产物
活泼的金属单质
Na、Fe、Al
Na+、Fe2+或Fe3+、Al3+
某些非金属单质
H2、C、S
H+、CO或CO2、SO2
变价元素中低价态的物质
氧化物
氢化物
离子
CO
CO2
SO2
SO3或SO42-
NH3
N2或NO
H2S
S
SO32-
SO42-
Fe2+
Fe3+
I-
I2
常见的氧化剂和还原剂
(5)在氧化还原反应中,若有一种元素被氧化,
则一定有另一种元素被还原。 ( )
(4)所含元素价态越高,化合物的氧化性一定越强。 ( )
(3)物质氧化性或还原性的强弱取决于得失电子数目的多少。( )
(2)在氧化还原反应中,非金属单质一定只作氧化剂。 ( )
(1)某元素由化合态变为游离态时,该元素一定被还原 ( )
课堂检测
1.判断正误(正确的打“√”,错误的打“×”)。
×
×
×
×
×
双线桥
①标变价
书写步骤
②画箭头(反应物指向生成物) ③算数目 ④说变化
一价氢、氯、钾、钠、银;二价氧、钙,镁、钡、锌;
三铝,四硅、五价磷;
说变价也不难,二三铁、二四碳、二四六硫都齐全;
铜汞二价最常见;单质元素价为零;
负一硝酸氢氧根;负二碳酸硫酸根;
负三记住磷酸根;正一价的是氨根。
双线桥
①标变价
书写步骤
2CuO+C 2Cu+CO2↑
高温
+2 0 0 +4
②画箭头(反应物指向生成物)
③算数目
得电子数=失电子数=转移电子数
=
×
每个原子的转移电子数
原子个数
化合价变化
Cu:
+2→0
↑2e-
×2
C:
0→+4
↑4e-
×1
④说变化
得到 2×2e-
失去 4e-
双线桥
(1)箭头必须由反应物指向生成物,且两端对准发生价态变化的同种元素。
(2)箭头方向不代表电子转移方向,仅表示同种元素电子转移的前后变化。
(3)在“桥”上标明电子的“得”与“失”,且得失电子总数相等。
微点拨
用双线桥法表示下列反应的电子转移的方向与数目。
(1)2KClO3 2KCl+3O2↑
(2)3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O
(3)4NH3+5O2 4NO+6H2O
(4)Cl2+H2O===HCl+HClO
课堂检测
单线桥
箭头由失电子原子指向得电子原子,线桥上只标电子转移的数目,不标“得”“失”字样。
氧化剂 + 还原剂 = 还原产物 + 氧化产物
ne-
用单线桥法标出反应电子转移的方向和数目:
2CuO+C 2Cu+CO2↑
高温
4e-
用单线桥法表示下列反应的电子转移的方向与数目。
(1)2KClO3 2KCl+3O2↑
(2)3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O
(3)4NH3+5O2 4NO+6H2O
课堂检测
12e-
6e-
20e-
基本概念
A
常见氧化剂和还原剂
B
双线桥
C
单线桥
D
化学必修一 第1章 第3节氧化还原反应
3 氧化还原反应的应用
氧化性、还原性强弱比较
根据反应方程式判断
氧化剂 + 还原剂 = 还原产物 + 氧化产物
失电子,化合价升高,被氧化
得电子,化合价降低,被还原
氧化性:氧化剂大于氧化产物; 还原性:还原剂大于还原产物。
微点拨
氧化性强
氧化性弱
还原性强
还原性弱
已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+,Sn2++2Fe3+===2Fe2++Sn4+。由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )A.Sn2+、Fe2+、Ce3+
B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+
D.Fe2+、Sn2+、Ce3+
A
课堂检测
根据金属和非金属活动性顺序表
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
K+
Ca+
Na+
Mg+
Al3+
Zn2+
Fe2+
Sn2+
Pb2+
(H+)
Cu2+
Hg2+
Ag+
单质的还原性逐渐减弱
阳离子的氧化性逐渐增强
单质易失电子,
对应阳离子不易得电子
F2 Cl2 Br2 I2 S
F-
Cl-
Br-
I-
S2-
单质的氧化性逐渐减弱
即“易失不易得,易得不易失”
单质易得电子,
对应阴离子不易失电子
阴离子的还原性逐渐增强
根据反应条件
反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强,
如是否加热、有无催化剂和反应物浓度大小等。
由化学方程式知氧化性: KMnO4>Cl2,MnO2>Cl2,O2>Cl2,由反应条件知氧化性:KMnO4>MnO2>O2。
2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
MnO2+4HCl MnCl2 +Cl2↑+2H2O
O2+4HCl 2Cl2+2H2O
根据反应条件
再如
F2+H2 2HF
暗处
Cl2+H2 2HCl
光照
由反应条件知氧化性F2>Cl2
根据反应条件
同一种物质,浓度越大,氧化性(或还原性)越强。
如氧化性:浓H2SO4>稀H2SO4,浓HNO3>稀HNO3;
还原性:浓HCI>稀HCI
同一种物质,温度越高其氧化性越强。
如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强
同一种物质,所处环境酸(碱)性越强其氧化性(还原性)越强。
浓度
温度
酸碱性
教材延伸
根据产物中变价元素的价态
(1)相同条件下不同氧化剂作用于同一种还原剂,
氧化产物价态高的其氧化性强。
氧化性:Cl2>S
例如:根据2Fe+3Cl2 2FeCl3
Fe+S FeS
(2)相同条件下不同还原剂作用于同一种氧化剂,
还原产物价态低的其还原性强。
例如:根据Cu+2Fe3+===Cu2++2Fe2+
3Zn+2Fe3+===3Zn2++2Fe
还原性:Zn>Cu
氧化还原反应的规律
价态规律
处于中间价态的元素,既有氧化性、又有还原性。
价态决定性质
最低价
最高价
中间价
只有还原性
只有氧化性
既有氧化性
又有还原性
处于最高价态的元素,只有氧化性;
处于最低价态的元素,只有还原性;
价态规律
价态不交叉规律
含同种元素但价态不同的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价 → 中间价”,而不会出现交叉现象
简记为“只靠拢,不交叉”。称为价态归中反应。
KClO3+6HCl=3Cl2↑+KCl+3H2O
+5 -1 0 -1
-1
0
+5
×
得到 5e-
失去 5×e-
价态规律
价态不交叉规律
物质所含元素能生成多种价态的产物时,“中间价→ 高价+低价”,
发生的氧化还原反应称为歧化反应。
Cl2+2NaOH = NaCl+NaClO+H2O
0 -1 +1
得到e-
失去e-
价态规律
价态不交叉规律
H2S + H2SO4(浓) = S↓ + SO2↑+ 2H2O
-2 +6 0 +4
-2
0
+4
+6
×
得到 2e-
失去 2e-
“只靠拢,不交叉”“就近变价”
价态规律
同种元素相邻价态间不发生氧化还原反应
如Fe3+(强氧化性)和Fe2+(强还原性)
之间不发生氧化还原反应
再如浓硫酸(强氧化性)和SO2(强还原性)
之间不发生氧化还原反应
先后律
当一种氧化剂遇到几种还原剂,若均能反应,先跟还原性强的反应。
强者优先
当一种还原剂遇到几种氧化剂,若均能反应,先跟氧化性强的反应。
应用:判断多种物质组成的混合物中氧化还原反应发生的先后顺序。
例如:Cl2通入FeBr2和FeI2混合溶液发生反应
已知还原性顺序:I->Fe2+>Br-
反应顺序依次为:
Cl2+2I-=I2+2Cl-
Cl2+2Fe2+-=2Fe3++2Cl-
Cl2+2Br-=Br2+2Cl-
微点拨
课堂检测
(1)向含相同物质的量浓度的S2-、I-、Br-溶液中,缓慢通入氯气,
还原性强的离子优先反应,先后顺序: ;
(2)向含等物质的量浓度的、Cu2+、H+、Ag+溶液中,缓慢加入足量的铁粉,氧化性强的离子优先发生反应,先后顺序为
。
S2-、I-、Br-
Ag+、Cu2+、H+
强弱律
氧化剂 + 还原剂 = 还原产物 + 氧化产物
氧化性强
氧化性弱
还原性强
还原性弱
规律:在氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性,
还原剂的还原性强于还原产物的还原性。
微点拨
应用:
①比较物质的氧化性或还原性强弱
②判断氧化还原反应能否发生或反应方程式的正误
课堂检测
已知I-、Fe2+、SO2和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O===2Fe2++SO42-+4H+
B.I2+SO2+2H2O===H2SO4+2HI
C.H2O2+H2SO4===SO2↑+O2↑+2H2O
D.2Fe3++H2O2===2Fe2++O2↑+2H+
C
守恒律
微观上
宏观上
元素失去电子数
元素得到电子数
元素化合价升高的总数
元素化合价降低的总数
每个原子的转移电子数
×
原子个数
微点拨
应用:
①有关氧化还原反应的计算
②氧化还原反应方程式的配平
课堂检测
B
Na2S在碱性溶液中与NaClO反应,而NaClO 被还原为NaCl,若反应中Na2S与NaClO的个数之比为1∶4,则反应后硫元素的化合价为( )
A.+2 B.+6
C.+4 D.0
1.现有下列三个氧化还原反应:
①2FeCl3+2KI===2FeCl2+2KCl+I2②2FeCl2+Cl2===2FeCl3③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中含有Fe2+、Cl-和I-,要除去I-而不氧化Fe2+和Cl-,可以加入的试剂是( )A.Cl2 B.KMnO4 C.FeCl3 D.HCl
C
2.某同学设计完成了以下两个实验:
①向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色(生成了HIO3)。
②向盛有KBr溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成红棕色。继续向试管中滴加氯水,振荡,CCl4层的颜色没有变化。下列说法不正确的是( )
A.实验①生成HIO3时发生的反应为:I2+5Cl2+6H2O=2HIO3+10HClB.实验②中当CCl4层变成红棕色时可通过分液的方法获得Br2的CCl4溶液
C.由上述实验得出Cl2、Br2、I2的氧化性由强到弱的顺序是:Cl2>Br2>I2D.由上述实验得出Cl2、HIO3、HBrO3氧化性由强到弱的顺序是:
HBrO3>Cl2>HIO3
C
3.已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G―→Q+NaCl
②Q+H2O―→X+H2
③Y+NaOH―→G+Q+H2O
④Z+NaOH―→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是 ( )
A.G、Y、Q、Z、X B.X、Z、Q、G、Y
C.X、Z、Q、Y、G D.G、Q、Y、Z、X
A
4.根据反应①→④,可以判断下列4种物质的氧化性由强到弱的
正确顺序是( )①Cl2+2KI===2KCl+I2②2FeCl2+Cl2===2FeCl3③2FeCl3+2HI===2FeCl2+2HCl+I2④H2S+I2===S+2HIA.S>I2>Fe3+>Cl2 B.Cl2>Fe3+>I2>SC.Fe3+>Cl2>S>I2 D.Cl2>I2>Fe3+>S
B
01
02
03
04
根据反应方程式判断
根据金属和非金属活动性顺序表
氧化性、还原性强弱比较
根据反应条件
根据产物中变价元素的价态
价态律
A
优先律
B
强弱律
C
守恒律
D
氧化还原反应的规律
化学必修一 第1章 第3节氧化还原反应
4 氧化还原反应的配平
氧化还原反应的配平方法
基本原则
配平三大原则
电子守恒
原子守恒
电荷守恒
氧化剂和还原剂得失电子总数相等,化合价升高总数=化合价降低总数
反应前后原子的种类和个数不变
离子反应前后,阴、阳离子所带电荷总数相等
氧化还原方程式配平的基本原则
配平步骤
检查质量、电荷、电子是否守恒
配
平
五
大
步
骤
标变价
列得失
配系数
通过求最小公倍数使化合价升降总数相等
确定氧化剂、还原剂、氧化产物、还原产物的化学计量数,观察法配平其他物质的化学计量数
氧化还原方程式配平的一般步骤
查守恒
求总数
标明反应前后变价元素的化合价
列出化合价的变化值
配平举例
【例】配平化学方程式:
H2S+HNO3→S↓+NO↑+H2O
H2S+ HNO3→ S↓+ NO↑+ H2O
-2 +5 0 +2
↑2e-
S :
0
-2
↓3e-
N :
+2
+5
从而确定氧化剂(或还原产物)和还原剂(或氧化产物)的化学计量数。故H2S(或S)的化学计量数为3,HNO3(或NO)的化学计量数为2。
×3
(求最小公倍数)
×2
3
3
2
2
列得失
求总数
标变价
配平举例
先配平变价元素,再利用原子守恒配平其他元素。
其他原子在配平时相等,最后利用O原子守恒来进行验证。
H2S+ HNO3→ S↓+ NO↑+ H2O
3
3
2
2
4
=
配系数
【例】配平化学方程式:
H2S+HNO3→S↓+NO↑+H2O
查守恒
配平技巧
逆向配平
歧化反应
分解反应
氧化剂和还原剂是同一种物质
(1) Cl2+ KOH= KCl+ KClO3+ H2O
0 -1 +5
↑e-
Cl :
-1
0
↓5e-
Cl :
+5
0
×5
×1
5
1
3
6
3
(2) Cu(NO3)2= CuO+ NO2 ↑ + O2 ↑
↑e-
N:
+4
+5
↓2e-
O:
0
-2
×4
×2
+5 -2 +4 0
×1
4
1
2
2
补加配平
部分被氧化或被还原的反应可用补加配平法
(1) Cu+ HNO3= Cu(NO3)2+ NO ↑ + H2 O
0 +5 +2 +5 +2
↑2e-
Cu :
+2
0
↓3e-
N :
+2
+5
×3
×2
3
3
2
(3×2+2)
4
(2) KMnO4+ HCl(浓)= KCl+ MnCl2+ Cl2 ↑ + H2O
+7 -1 -1 +2 -1 0
↑ e-
Cl :
0
-1
↓5e-
Mn :
+2
+7
×2
×2
×5
5
2
2
2
(2+2×2+5×2)
8
整体配平
一种物质中多种元素变化可用整体配平法
(1) FeS2+ O2= Fe2O3+ SO2
+2 -1 0 +3 +4 -2
↑ e-
Fe :
+3
+2
↑5e-
S :
+4
-1
×11
×2
↓2e-
O :
-2
0
×1
↑ 11e-
×2
×4
4
11
2
8
(2) Cu2S+ HNO3= Cu(NO3)2+ H2SO4+ NO↑+ H2O
+1 -2 +5 +2 +6 +2
↑ e-
Cu:
+2
+1
↑8e-
S :
+6
-2
×10
×1
↓3e-
N :
+2
+5
×2
↑ 10e-
×3
3
3
6
10
22
8
缺项配平
先用“化合价升降法”配平含有变价元素的物质的化学计量数,
然后由原子守恒确定未知物,再根据原子守恒进行配平。
缺项方程式是指某些反应物或生成物的分子式没有写出来,一般为水、酸或碱
配平方法
补项原则
条件 补项原则
酸性条件下 缺H(氢)或多O(氧)补H+
少O(氧)补H2O(水)
碱性条件下 缺H(氢)或多O(氧)补H2O(水)
少O(氧)补OH-
缺项配平
NaBiO3+ Mn2++ → Na++ Bi3++ +
【例】将NaBiO3固体(黄色,微溶)加入MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的例子方程式
分析:
(1)由溶液显紫色可推知有MnO4-生成,确定变价元素物质的化学计量数:
MnO4-
5
5
2
2
Bi(+5→+3)? 2×5(化学计量数5配在NaBiO3和Bi3+前)
Mn(+2→+7)?5×2(化学计量数2配在Mn2+和MnO4-前)
(2)据补项原则,在酸性条件下,方程式左边多O,故应补H+,而方程式右边少O,故应补H2O,再根据原子守恒配平H+和H2O之前的化学计量数:
H+
H2O
14
5
=
5
1.(1) HCl(浓)+ MnO2 Cl2↑+ MnCl2+ H2O
(2) KI+ KIO3+ H2SO4= I2+ K2SO4+ H2O
(3) MnO4-+ H++ Cl-= Mn2++ Cl2↑+ H2O
4
1
1
1
2
5
1
3
3
3
3
2
16
10
2
5
8
2.(1) S+ KOH= K2S+ K2SO3+ H2O
(2) P4+ KOH+ H2O= K3PO4+ PH3
3
6
2
1
3
2
9
3
3
5
3.请配平一下离子方程 式。
(1)在酸性条件下,K2Cr2O7与FeSO4反应的离子方程式为
____Cr2O72-+ ___Fe2++___ ______===____Cr3++___Fe3++___H2O,
(2)在酸性条件下,SO2通入FeCl3溶液中反应离子方程式为
___Fe3++___SO2+___ _____===___Fe2++___SO42- +___ ___
1
6
14
H+
2
6
7
2
1
H2O
2
2
1
H+
4
电子守恒
原子守恒
电荷守恒
配平原则
标变价
列得失
求总数
配系数
查守恒
配平步骤
歧化反应
分解反应
逆向配平
部分被氧化或被还原的反应
补加配平
一种物质多种元素变化
整体配平
缺项方程式是指某些反应物或生成物的分子式没有写出来,一般为水、酸或碱
缺项配平
谢
谢
指
导
化学必修一 第1章 第3节氧化还原反应 (4课时)
第1课时 氧化还原反应
一、得氧、失氧角度
2CuO+C 2Cu+CO2↑
高温
失氧
发生还原反应
得氧
发生氧化反应
化学反应中得氧、失氧的角度分析
被还原
被氧化
Fe2O3+3CO 2Fe+3CO2
高温
失氧
发生还原反应
得氧
发生氧化反应
被还原
被氧化
同时发生
同时发生
得氧、失氧角度
物质在反应中
得到氧
失去氧
被氧化
被还原
氧化反应
还原反应
在一个反应
中同时发生
这样的反应称为氧化还原反应
二、化合价变化角度
2CuO+C 2Cu+CO2↑
高温
+2 0 0 +4
化合价降低
化合价升高
Cu元素:
被还原
发生还原反应
C元素:
被氧化
发生氧化反应
同时发生
Fe2O3+3CO 2Fe+3CO2
高温
+3 +2 0 +4
化合价降低
Fe元素:
被还原
发生还原反应
化合价升高
C元素:
被氧化
发生氧化反应
同时发生
化合价变化角度
物质所含元素的化合价
升高
降低
被氧化
被还原
氧化反应
还原反应
所含元素化合价升高的物质发生的反应为氧化反应
微点拨
所含元素化合价降低的物质发生的反应为还原反应
化合价变化角度
虽然没有物质得氧、失氧,但反应前后却有元素化合价的变化
微点拨
Fe+ CuSO4 FeSO4+Cu
0 +2 +2 0
化合价升高
化合价降低
Fe元素:
被氧化
发生氧化反应
Cu元素:
被还原
发生还原反应
反应前后有元素的化合价发生变化,是氧化还原反应的重要特征。
这样的反应也属于氧化还原反应
本质?
微观角度
以Na与Cl2反应为例
+11
8
2
1
Na
+17
8
2
7
Cl
微观角度
以Na与Cl2反应为例
+11
+17
Cl
Na
-
+
Na失去最外层1个电子,成为具有稳定结构的Na+,其化合价由0升高到+1,Na被氧化。
Cl最外层得到1个电子,成为具有稳定结构的Cl-,其化合价由0降低到-1,Cl2被还原
微观角度
以H2与Cl2反应为例
+1
H
+17
Cl
1
2
8
7
H和Cl都不易失去电子,都可获得1个电子形成稳定的结构,
二者只能形成共用电子对,使双方最外层都达到稳定结构。
微观角度
以H2与Cl2反应为例
+1
+17
Cl
H
共用电子对
偏向
偏离
共用电子对偏向吸引能力稍弱的H,氢元素的化合价由0升高到+1,H2被氧化。
共用电子对偏向吸引能力稍强的Cl,氯元素的化合价由0降低到-1,Cl2被还原。
微观角度
失去电子或
电子对偏离
得到电子或
电子对偏向
氧化反应
还原反应
氧化还原反应一定有电子的转移(得失或偏移)
化合价升高
化合价降低
升 失 氧
降 得 还
电子的转移
化合价的升降
本质
特征
氧化还原反应得判断方法
四种基本反应类型
反应类型 表达式 举例
化合反应
分解反应
置换反应
复分解反应
AB=A+B
A+BC=B+AC
AB+CD=AD+CB
A+B=AB
CaO+H2O=Ca(OH)2
2KClO3 2KCl+3O2↑
△
MnO2
Fe+CuSO4= FeSO4+ Cu
NaOH+HCl=NaCl+H2O
化合反应
分解反应
反应类型的关系
氧化还原反应
置换反应
复分解反应
有单质生成的分解反应
有单质参加的化合反应
分解
化合
氧化还原反应
置换
复分解反应
得氧失氧角度
A
化合价变化角度
B
微观角度
C
本质与特征
D
四种基本反应类型
E
反应类型之间的关系
E
F
化学必修一 第1章 第3节氧化还原反应
第2课时 氧化剂 还原剂
基本概念
1.氧化剂
在氧化还原反应中,所含元素的化合价降低,即得电子(或电子对偏向)的物质叫做氧化剂
2.还原剂
在氧化还原反应中,所含元素的化合价升高,即失电子(或电子对偏离)的物质叫做还原剂。
3.氧化产物
还原剂被氧化生成的物质,即化合价升高的元素应的产物。
4.还原产物
氧化剂被还原生成的物质,即化合价降低的元素应的产物
基本概念
5.氧化性
物质得到电子(或电子对偏向)的能力
6.还原性
物质失去电子(或电子对偏离)的能力
微点拨
氧化剂和氧化产物具有氧化性,氧化剂的氧化性强于氧化产物
还原剂和还原产物具有还原性,还原剂的还原性强于还原产物
氧化性和还原性强弱与得失电子的难易程度有关,与得失电子数目无关
基本概念
氧化剂
还原剂
+
还原产物
+
氧化产物
化合价升高
失去电子
被氧化
化合价降低
得到电子
被还原
e-
微点拨
在有些反应中,氧化剂和还原剂可能是同一种物质
氧化产物和还原产物也可能是同一种物质
基本概念
氧化剂:
降 得 还
化合价降低
得电子
被还原
发生还原反应
得到还原产物
还原剂:
升 失 氧
化合价升高
失电子
被氧化
发生氧化反应
得到氧化产物
物质类型 实例 还原产物
活泼的
非金属单质
元素处于高价时的物质
某些氧化物和过氧化物
强氧化性酸
卤素单质(X2)
X-
O2
O2-、O22-、OH-、H2O
KMnO4(H+)
Mn2+
HNO3
NO2、NO
浓硫酸
SO2
Fe3+
Fe2+、Fe
MnO2
Mn2+
H2O2
H2O
Na2O2
O2-、OH-、H2O
HClO
Cl-、Cl2
1.常见的氧化剂
常见的氧化剂和还原剂
2.常见的还原剂
物质类型 实例 氧化产物
活泼的金属单质
Na、Fe、Al
Na+、Fe2+或Fe3+、Al3+
某些非金属单质
H2、C、S
H+、CO或CO2、SO2
变价元素中低价态的物质
氧化物
氢化物
离子
CO
CO2
SO2
SO3或SO42-
NH3
N2或NO
H2S
S
SO32-
SO42-
Fe2+
Fe3+
I-
I2
常见的氧化剂和还原剂
(5)在氧化还原反应中,若有一种元素被氧化,
则一定有另一种元素被还原。 ( )
(4)所含元素价态越高,化合物的氧化性一定越强。 ( )
(3)物质氧化性或还原性的强弱取决于得失电子数目的多少。( )
(2)在氧化还原反应中,非金属单质一定只作氧化剂。 ( )
(1)某元素由化合态变为游离态时,该元素一定被还原 ( )
课堂检测
1.判断正误(正确的打“√”,错误的打“×”)。
×
×
×
×
×
双线桥
①标变价
书写步骤
②画箭头(反应物指向生成物) ③算数目 ④说变化
一价氢、氯、钾、钠、银;二价氧、钙,镁、钡、锌;
三铝,四硅、五价磷;
说变价也不难,二三铁、二四碳、二四六硫都齐全;
铜汞二价最常见;单质元素价为零;
负一硝酸氢氧根;负二碳酸硫酸根;
负三记住磷酸根;正一价的是氨根。
双线桥
①标变价
书写步骤
2CuO+C 2Cu+CO2↑
高温
+2 0 0 +4
②画箭头(反应物指向生成物)
③算数目
得电子数=失电子数=转移电子数
=
×
每个原子的转移电子数
原子个数
化合价变化
Cu:
+2→0
↑2e-
×2
C:
0→+4
↑4e-
×1
④说变化
得到 2×2e-
失去 4e-
双线桥
(1)箭头必须由反应物指向生成物,且两端对准发生价态变化的同种元素。
(2)箭头方向不代表电子转移方向,仅表示同种元素电子转移的前后变化。
(3)在“桥”上标明电子的“得”与“失”,且得失电子总数相等。
微点拨
用双线桥法表示下列反应的电子转移的方向与数目。
(1)2KClO3 2KCl+3O2↑
(2)3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O
(3)4NH3+5O2 4NO+6H2O
(4)Cl2+H2O===HCl+HClO
课堂检测
单线桥
箭头由失电子原子指向得电子原子,线桥上只标电子转移的数目,不标“得”“失”字样。
氧化剂 + 还原剂 = 还原产物 + 氧化产物
ne-
用单线桥法标出反应电子转移的方向和数目:
2CuO+C 2Cu+CO2↑
高温
4e-
用单线桥法表示下列反应的电子转移的方向与数目。
(1)2KClO3 2KCl+3O2↑
(2)3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O
(3)4NH3+5O2 4NO+6H2O
课堂检测
12e-
6e-
20e-
基本概念
A
常见氧化剂和还原剂
B
双线桥
C
单线桥
D
化学必修一 第1章 第3节氧化还原反应
3 氧化还原反应的应用
氧化性、还原性强弱比较
根据反应方程式判断
氧化剂 + 还原剂 = 还原产物 + 氧化产物
失电子,化合价升高,被氧化
得电子,化合价降低,被还原
氧化性:氧化剂大于氧化产物; 还原性:还原剂大于还原产物。
微点拨
氧化性强
氧化性弱
还原性强
还原性弱
已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+,Sn2++2Fe3+===2Fe2++Sn4+。由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )A.Sn2+、Fe2+、Ce3+
B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+
D.Fe2+、Sn2+、Ce3+
A
课堂检测
根据金属和非金属活动性顺序表
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
K+
Ca+
Na+
Mg+
Al3+
Zn2+
Fe2+
Sn2+
Pb2+
(H+)
Cu2+
Hg2+
Ag+
单质的还原性逐渐减弱
阳离子的氧化性逐渐增强
单质易失电子,
对应阳离子不易得电子
F2 Cl2 Br2 I2 S
F-
Cl-
Br-
I-
S2-
单质的氧化性逐渐减弱
即“易失不易得,易得不易失”
单质易得电子,
对应阴离子不易失电子
阴离子的还原性逐渐增强
根据反应条件
反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强,
如是否加热、有无催化剂和反应物浓度大小等。
由化学方程式知氧化性: KMnO4>Cl2,MnO2>Cl2,O2>Cl2,由反应条件知氧化性:KMnO4>MnO2>O2。
2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
MnO2+4HCl MnCl2 +Cl2↑+2H2O
O2+4HCl 2Cl2+2H2O
根据反应条件
再如
F2+H2 2HF
暗处
Cl2+H2 2HCl
光照
由反应条件知氧化性F2>Cl2
根据反应条件
同一种物质,浓度越大,氧化性(或还原性)越强。
如氧化性:浓H2SO4>稀H2SO4,浓HNO3>稀HNO3;
还原性:浓HCI>稀HCI
同一种物质,温度越高其氧化性越强。
如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强
同一种物质,所处环境酸(碱)性越强其氧化性(还原性)越强。
浓度
温度
酸碱性
教材延伸
根据产物中变价元素的价态
(1)相同条件下不同氧化剂作用于同一种还原剂,
氧化产物价态高的其氧化性强。
氧化性:Cl2>S
例如:根据2Fe+3Cl2 2FeCl3
Fe+S FeS
(2)相同条件下不同还原剂作用于同一种氧化剂,
还原产物价态低的其还原性强。
例如:根据Cu+2Fe3+===Cu2++2Fe2+
3Zn+2Fe3+===3Zn2++2Fe
还原性:Zn>Cu
氧化还原反应的规律
价态规律
处于中间价态的元素,既有氧化性、又有还原性。
价态决定性质
最低价
最高价
中间价
只有还原性
只有氧化性
既有氧化性
又有还原性
处于最高价态的元素,只有氧化性;
处于最低价态的元素,只有还原性;
价态规律
价态不交叉规律
含同种元素但价态不同的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价 → 中间价”,而不会出现交叉现象
简记为“只靠拢,不交叉”。称为价态归中反应。
KClO3+6HCl=3Cl2↑+KCl+3H2O
+5 -1 0 -1
-1
0
+5
×
得到 5e-
失去 5×e-
价态规律
价态不交叉规律
物质所含元素能生成多种价态的产物时,“中间价→ 高价+低价”,
发生的氧化还原反应称为歧化反应。
Cl2+2NaOH = NaCl+NaClO+H2O
0 -1 +1
得到e-
失去e-
价态规律
价态不交叉规律
H2S + H2SO4(浓) = S↓ + SO2↑+ 2H2O
-2 +6 0 +4
-2
0
+4
+6
×
得到 2e-
失去 2e-
“只靠拢,不交叉”“就近变价”
价态规律
同种元素相邻价态间不发生氧化还原反应
如Fe3+(强氧化性)和Fe2+(强还原性)
之间不发生氧化还原反应
再如浓硫酸(强氧化性)和SO2(强还原性)
之间不发生氧化还原反应
先后律
当一种氧化剂遇到几种还原剂,若均能反应,先跟还原性强的反应。
强者优先
当一种还原剂遇到几种氧化剂,若均能反应,先跟氧化性强的反应。
应用:判断多种物质组成的混合物中氧化还原反应发生的先后顺序。
例如:Cl2通入FeBr2和FeI2混合溶液发生反应
已知还原性顺序:I->Fe2+>Br-
反应顺序依次为:
Cl2+2I-=I2+2Cl-
Cl2+2Fe2+-=2Fe3++2Cl-
Cl2+2Br-=Br2+2Cl-
微点拨
课堂检测
(1)向含相同物质的量浓度的S2-、I-、Br-溶液中,缓慢通入氯气,
还原性强的离子优先反应,先后顺序: ;
(2)向含等物质的量浓度的、Cu2+、H+、Ag+溶液中,缓慢加入足量的铁粉,氧化性强的离子优先发生反应,先后顺序为
。
S2-、I-、Br-
Ag+、Cu2+、H+
强弱律
氧化剂 + 还原剂 = 还原产物 + 氧化产物
氧化性强
氧化性弱
还原性强
还原性弱
规律:在氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性,
还原剂的还原性强于还原产物的还原性。
微点拨
应用:
①比较物质的氧化性或还原性强弱
②判断氧化还原反应能否发生或反应方程式的正误
课堂检测
已知I-、Fe2+、SO2和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O===2Fe2++SO42-+4H+
B.I2+SO2+2H2O===H2SO4+2HI
C.H2O2+H2SO4===SO2↑+O2↑+2H2O
D.2Fe3++H2O2===2Fe2++O2↑+2H+
C
守恒律
微观上
宏观上
元素失去电子数
元素得到电子数
元素化合价升高的总数
元素化合价降低的总数
每个原子的转移电子数
×
原子个数
微点拨
应用:
①有关氧化还原反应的计算
②氧化还原反应方程式的配平
课堂检测
B
Na2S在碱性溶液中与NaClO反应,而NaClO 被还原为NaCl,若反应中Na2S与NaClO的个数之比为1∶4,则反应后硫元素的化合价为( )
A.+2 B.+6
C.+4 D.0
1.现有下列三个氧化还原反应:
①2FeCl3+2KI===2FeCl2+2KCl+I2②2FeCl2+Cl2===2FeCl3③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中含有Fe2+、Cl-和I-,要除去I-而不氧化Fe2+和Cl-,可以加入的试剂是( )A.Cl2 B.KMnO4 C.FeCl3 D.HCl
C
2.某同学设计完成了以下两个实验:
①向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色(生成了HIO3)。
②向盛有KBr溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成红棕色。继续向试管中滴加氯水,振荡,CCl4层的颜色没有变化。下列说法不正确的是( )
A.实验①生成HIO3时发生的反应为:I2+5Cl2+6H2O=2HIO3+10HClB.实验②中当CCl4层变成红棕色时可通过分液的方法获得Br2的CCl4溶液
C.由上述实验得出Cl2、Br2、I2的氧化性由强到弱的顺序是:Cl2>Br2>I2D.由上述实验得出Cl2、HIO3、HBrO3氧化性由强到弱的顺序是:
HBrO3>Cl2>HIO3
C
3.已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G―→Q+NaCl
②Q+H2O―→X+H2
③Y+NaOH―→G+Q+H2O
④Z+NaOH―→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是 ( )
A.G、Y、Q、Z、X B.X、Z、Q、G、Y
C.X、Z、Q、Y、G D.G、Q、Y、Z、X
A
4.根据反应①→④,可以判断下列4种物质的氧化性由强到弱的
正确顺序是( )①Cl2+2KI===2KCl+I2②2FeCl2+Cl2===2FeCl3③2FeCl3+2HI===2FeCl2+2HCl+I2④H2S+I2===S+2HIA.S>I2>Fe3+>Cl2 B.Cl2>Fe3+>I2>SC.Fe3+>Cl2>S>I2 D.Cl2>I2>Fe3+>S
B
01
02
03
04
根据反应方程式判断
根据金属和非金属活动性顺序表
氧化性、还原性强弱比较
根据反应条件
根据产物中变价元素的价态
价态律
A
优先律
B
强弱律
C
守恒律
D
氧化还原反应的规律
化学必修一 第1章 第3节氧化还原反应
4 氧化还原反应的配平
氧化还原反应的配平方法
基本原则
配平三大原则
电子守恒
原子守恒
电荷守恒
氧化剂和还原剂得失电子总数相等,化合价升高总数=化合价降低总数
反应前后原子的种类和个数不变
离子反应前后,阴、阳离子所带电荷总数相等
氧化还原方程式配平的基本原则
配平步骤
检查质量、电荷、电子是否守恒
配
平
五
大
步
骤
标变价
列得失
配系数
通过求最小公倍数使化合价升降总数相等
确定氧化剂、还原剂、氧化产物、还原产物的化学计量数,观察法配平其他物质的化学计量数
氧化还原方程式配平的一般步骤
查守恒
求总数
标明反应前后变价元素的化合价
列出化合价的变化值
配平举例
【例】配平化学方程式:
H2S+HNO3→S↓+NO↑+H2O
H2S+ HNO3→ S↓+ NO↑+ H2O
-2 +5 0 +2
↑2e-
S :
0
-2
↓3e-
N :
+2
+5
从而确定氧化剂(或还原产物)和还原剂(或氧化产物)的化学计量数。故H2S(或S)的化学计量数为3,HNO3(或NO)的化学计量数为2。
×3
(求最小公倍数)
×2
3
3
2
2
列得失
求总数
标变价
配平举例
先配平变价元素,再利用原子守恒配平其他元素。
其他原子在配平时相等,最后利用O原子守恒来进行验证。
H2S+ HNO3→ S↓+ NO↑+ H2O
3
3
2
2
4
=
配系数
【例】配平化学方程式:
H2S+HNO3→S↓+NO↑+H2O
查守恒
配平技巧
逆向配平
歧化反应
分解反应
氧化剂和还原剂是同一种物质
(1) Cl2+ KOH= KCl+ KClO3+ H2O
0 -1 +5
↑e-
Cl :
-1
0
↓5e-
Cl :
+5
0
×5
×1
5
1
3
6
3
(2) Cu(NO3)2= CuO+ NO2 ↑ + O2 ↑
↑e-
N:
+4
+5
↓2e-
O:
0
-2
×4
×2
+5 -2 +4 0
×1
4
1
2
2
补加配平
部分被氧化或被还原的反应可用补加配平法
(1) Cu+ HNO3= Cu(NO3)2+ NO ↑ + H2 O
0 +5 +2 +5 +2
↑2e-
Cu :
+2
0
↓3e-
N :
+2
+5
×3
×2
3
3
2
(3×2+2)
4
(2) KMnO4+ HCl(浓)= KCl+ MnCl2+ Cl2 ↑ + H2O
+7 -1 -1 +2 -1 0
↑ e-
Cl :
0
-1
↓5e-
Mn :
+2
+7
×2
×2
×5
5
2
2
2
(2+2×2+5×2)
8
整体配平
一种物质中多种元素变化可用整体配平法
(1) FeS2+ O2= Fe2O3+ SO2
+2 -1 0 +3 +4 -2
↑ e-
Fe :
+3
+2
↑5e-
S :
+4
-1
×11
×2
↓2e-
O :
-2
0
×1
↑ 11e-
×2
×4
4
11
2
8
(2) Cu2S+ HNO3= Cu(NO3)2+ H2SO4+ NO↑+ H2O
+1 -2 +5 +2 +6 +2
↑ e-
Cu:
+2
+1
↑8e-
S :
+6
-2
×10
×1
↓3e-
N :
+2
+5
×2
↑ 10e-
×3
3
3
6
10
22
8
缺项配平
先用“化合价升降法”配平含有变价元素的物质的化学计量数,
然后由原子守恒确定未知物,再根据原子守恒进行配平。
缺项方程式是指某些反应物或生成物的分子式没有写出来,一般为水、酸或碱
配平方法
补项原则
条件 补项原则
酸性条件下 缺H(氢)或多O(氧)补H+
少O(氧)补H2O(水)
碱性条件下 缺H(氢)或多O(氧)补H2O(水)
少O(氧)补OH-
缺项配平
NaBiO3+ Mn2++ → Na++ Bi3++ +
【例】将NaBiO3固体(黄色,微溶)加入MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的例子方程式
分析:
(1)由溶液显紫色可推知有MnO4-生成,确定变价元素物质的化学计量数:
MnO4-
5
5
2
2
Bi(+5→+3)? 2×5(化学计量数5配在NaBiO3和Bi3+前)
Mn(+2→+7)?5×2(化学计量数2配在Mn2+和MnO4-前)
(2)据补项原则,在酸性条件下,方程式左边多O,故应补H+,而方程式右边少O,故应补H2O,再根据原子守恒配平H+和H2O之前的化学计量数:
H+
H2O
14
5
=
5
1.(1) HCl(浓)+ MnO2 Cl2↑+ MnCl2+ H2O
(2) KI+ KIO3+ H2SO4= I2+ K2SO4+ H2O
(3) MnO4-+ H++ Cl-= Mn2++ Cl2↑+ H2O
4
1
1
1
2
5
1
3
3
3
3
2
16
10
2
5
8
2.(1) S+ KOH= K2S+ K2SO3+ H2O
(2) P4+ KOH+ H2O= K3PO4+ PH3
3
6
2
1
3
2
9
3
3
5
3.请配平一下离子方程 式。
(1)在酸性条件下,K2Cr2O7与FeSO4反应的离子方程式为
____Cr2O72-+ ___Fe2++___ ______===____Cr3++___Fe3++___H2O,
(2)在酸性条件下,SO2通入FeCl3溶液中反应离子方程式为
___Fe3++___SO2+___ _____===___Fe2++___SO42- +___ ___
1
6
14
H+
2
6
7
2
1
H2O
2
2
1
H+
4
电子守恒
原子守恒
电荷守恒
配平原则
标变价
列得失
求总数
配系数
查守恒
配平步骤
歧化反应
分解反应
逆向配平
部分被氧化或被还原的反应
补加配平
一种物质多种元素变化
整体配平
缺项方程式是指某些反应物或生成物的分子式没有写出来,一般为水、酸或碱
缺项配平
谢
谢
指
导
