广东省惠州市博罗县2022-2023学年高一下学期6月月考化学试题(无答案)
文档属性
| 名称 | 广东省惠州市博罗县2022-2023学年高一下学期6月月考化学试题(无答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-23 11:09:35 | ||
图片预览




文档简介
博罗县2022-2023学年高一下学期6月月考
化学卷
考试时间:75分钟 总分:100分
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Cu 64 S 32 Cl 35.5
一单选题(共20题;其中1-12题每题2分,13-20题每题3分,共48分)
1.广东拥有多项非物质文化遗产,以下代表作的主要材料不属于天然有机高分子的是( )
A.东莞莞香所用的常绿乔木 B.佛山醒狮所用的铜锣 C.潮汕剪纸所用的牛皮 D.粤绣用的孔雀毛
2.《黄帝内经·素问》记载“五谷为养,五果为助,五畜为益,五菜为充”,以上食物中富含糖类、蛋白质、油脂等营养物质。下列说法正确的是( )
A.“五谷”富含淀粉,淀粉可用于生产乙醇
B.“五果”富含糖类,葡萄糖、蔗糖都能发生水解反应
C.“五畜”富含蛋白质和油脂,都是由C、H、O三种元素组成的
D.“五菜”富含纤维素,纤维素与淀粉互为同分异构体
3.下列化学用语或模型正确的是( )
A.羟基的电子式: B.的结构式:
C.乙烯的结构简式: D.分子的球棍模型:
4.科学生产中蕴藏着丰富的科学知识。化学改善人类生活,创造美好世界。下列生产、生活情境中涉及的原理不正确的是( )
A.太阳能电池板广泛应用在航天器上,利用的光电性质
B.葡萄酒中通常添加少量,∠既可以杀菌又可以防止营养成分被氧化
C.催化光解设施可处理汽车尾气中的CO、,CO和催化反应生成和
D.景德镇的瓷器可由黏土经高温烧结而成,过程中发生了化学变化
5.下列说法正确的是( )
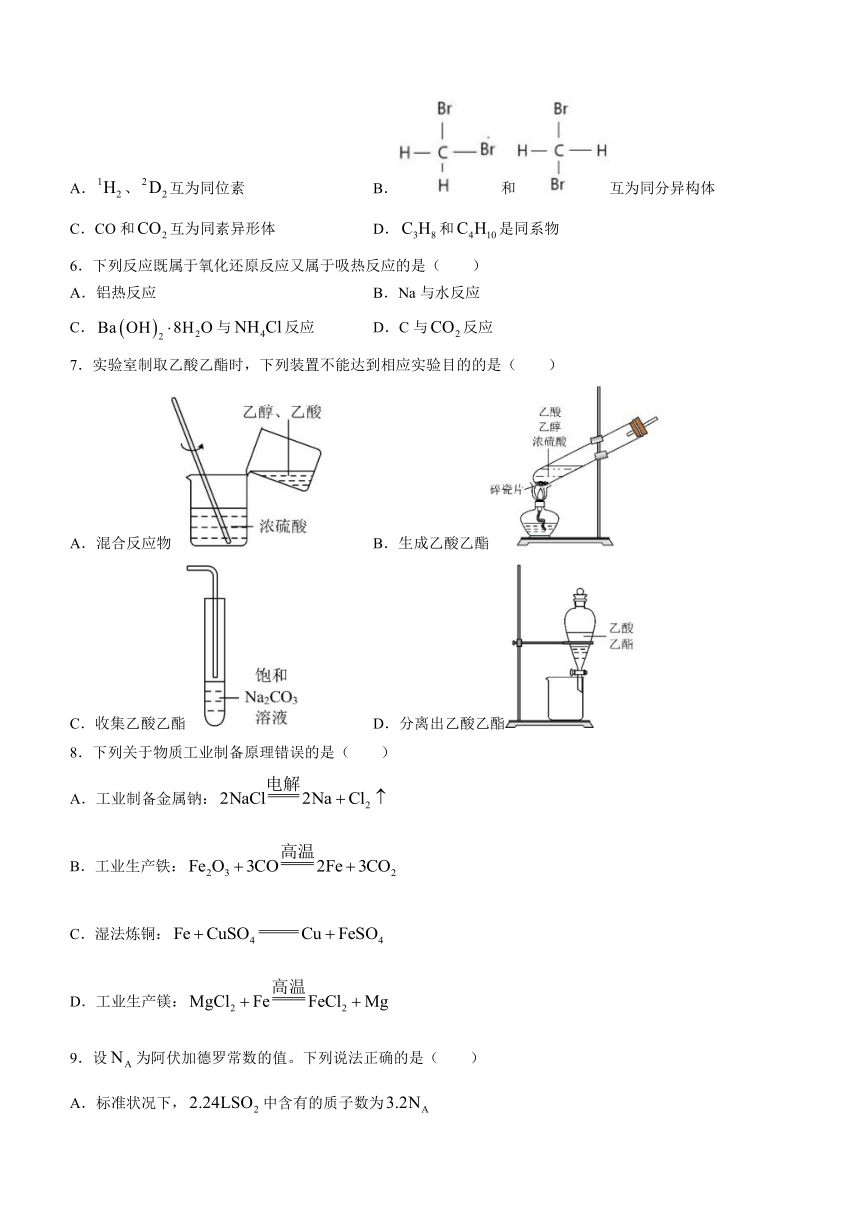
A.、互为同位素 B.和互为同分异构体
C.CO和互为同素异形体 D.和是同系物
6.下列反应既属于氧化还原反应又属于吸热反应的是( )
A.铝热反应 B.Na与水反应
C.与反应 D.C与反应
7.实验室制取乙酸乙酯时,下列装置不能达到相应实验目的的是( )
A.混合反应物 B.生成乙酸乙酯
C.收集乙酸乙酯 D.分离出乙酸乙酯
8.下列关于物质工业制备原理错误的是( )
A.工业制备金属钠:
B.工业生产铁:
C.湿法炼铜:
D.工业生产镁:
9.设为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,中含有的质子数为
B.2L0.5mol/L氨水中含有的数目为
C.在加热条件下,64g铜与足量硫粉完全反应转移电子数为
D.固体中含有的阴离子数目为
10.下列有关反应事实对应的离子方程式正确的是( )
A.用稀硫酸、双氧水溶解铜:
B.向NaOH溶液中通入过量的:
C.溶液中加入少量溶液:
D.盛放NaOH溶液的试剂瓶不能用磨口玻璃塞的原因:
11.W、X、Y、Z为原子序数依次递增的短周期主族元素,且四种元素位于三个不同周期。X的简单氢化物是天然气的主要成分,Y的最外层电子数是其内层电子数的3倍,Z的单质常用作铝热反应的引燃剂,工业上常从海水中提取Z。下列说法正确的是( )
A.原子半径: B.简单氢化物的稳定性:
C.Z的单质能与冷水发生剧烈反应 D.工业上电解熔触的ZY制备Z的单质
12.某小组拟从苦卤(含等)中提取海,设计的流程如图所示:
下列说法错误的是( )
A.提取溴包括浓缩、氧化、提取
B.步骤2利用的原理是液溴的挥发性(或低沸点性)
C.步骤1和4利用的原理是氯的失电子能力比溴的强
D.步骤3的离子方程式为
13.下列操作或装置不能达到实验目的的是( )
A B C D
探究浓硫酸的脱水性 观察氨的喷泉实验 吸收少量 制取
14.下列有机物的有关说法中不正确的是( )
A.含有2种官能团
B.的一氯代物有3种
C.有2种同分异构体
D.中所有原子不可能共平面
15.下列有关物质检验的实验结论正确的是( )
选项 实验操作及现象 实验结论
A 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 该溶液中一定含有
B 向某溶液中滴加KSCN溶液,溶液不显红色,再向溶液中加入几滴新制得氯水,溶液变为红色 该溶液中一定含有
C 将某气体通入品红溶液中,品红溶液褪色 该气体一定是
D 向某溶液中加入NaOH溶液,将湿润红色石蕊试纸放于试管口,试纸不变蓝 该溶液中一定不含
16.某化学兴趣小组的同学设计了锌铜原电池装置如图所示。下列说法错误的是( )
A.电子从锌片经导线流向铜片 B.电池工作时,铜电极上发生氧化反应
C.电池工作一段时间后,锌片质量减小 D.该装置能证明金属的活动性:
17.部分含氮物质的分类与相应氮元素化合价关系如图所示。下列说法不正确的是( )
A.常温下,a的水溶液
B.一定条件下,b可以转化为a或c,该过程属于氮的固定
C.一定条件下,c、d、e之间存在转化关系:c→d→e
D.实验室用e的浓溶液与Cu反应制备d,可用排水法收集
18.在一定温度下,恒容密闭容器内某一反应中气体M和气体N的物质的量浓度随反应时间变化的曲线如图所示,下列表述不正确的是( )
A.该反应的化学方程式为 B.的速率
C.时, D.时,该反应达到化学平衡
19.下列有关实验操作、现象和所得结论均正确的是( )
选项 实验操作 现象 结论
A 将铝片插入浓硫酸中 无明显现象 铝片和浓硫酸不反应
B 将2mL5%的溶液滴入少量的酸性高锰酸钾溶液 紫色褪去 具有氧化性
C 向0.5g淀粉中加入4mL2mol/L的溶液,加热一段时间,冷却,再加入少量新制的,加热 无砖红色沉淀生成 淀粉未水解
D 分别向两个试管中加入等体积、等浓度的稀盐酸和等质量、同规格的锌片,在其中1个试管中加入少量硫酸铜溶液 加入硫酸铜溶液的试管产生气泡速度快 构成原电池,加快了反应速率
20.某课外兴趣小组利用硫代硫酸钠与稀硫酸反应探究影响化学反应速率的因素[反应方程式为],设计了如表系列实验。下列说法不正确的是( )
实验序号 反应温度(℃) 浓度 稀硫酸
V/mL c/(mol/L) V/mL c/(mol/L) V/mL
1 20 10.0 0.10 10.0 0.50 0
2 40 0.10 0.50
3 20 0.10 4.0 0.50
A.设计该实验的基本原理为控制变量法
B.实验1和2可探究温度对反应速率的影响
C.若用实验1和3探究稀硫酸浓度对该反应速率的影响,则需,
D.通过记录产生沉淀所需的时间可以比较反应的快慢
二.填空题(共52分)
21.(13分)如图是元素周期表的一部分,表中列出了八种元素的位置:
请回答下列问题:
(1)①元素的最简单氢化物的电子式为________。
(2)在元素①-⑧中,金属性最强的元素是________(填元素符号);在元素⑤-⑧中,最高价含氧酸酸性最强的是________(填化学式)。
(3)③、④、⑤三种元素的原子半径由大到小的顺序是________(填元素符号),③和⑦的简单氢化物的稳定性较强的是________(填化学式)。
(4)④和⑤所形成的化合物属于________(填“离子”或“共价”)化合物。
(5)将等物质的量的①的最简单的氢化物和⑧的单质混合后,在漫射光的照射下充分反应,生成物中物质的量最大的是________(写分子式);
(6)⑤和⑥的最高价氧化物对应的水化物之间发生反应的离子方程式为________。
22.(13分)氯化亚砜在农药、制药行业中用途广泛。实验室合成原理为:,合成装置如图所示。
已知:①实验室通常用固体和浓硫酸在不加热时反应制备。
②是沸点为78.8℃的液体,遇水剧烈反应。
③是沸点为60℃的液体,且与互溶。
回答下列问题:
(1)仪器①名称为________。
(2)装置己中反应的化学方程式为________。
(3)装置丙的作用是________。
(4)装置丁中冷凝管的进水口为________(填“②”或“③”)。
干燥管的作用有(I)吸收逸出的、,防污染;(II)________。
(5)用液体吸收尾气可能导致倒吸,下图装置能防倒吸的是________(填标号)
(6)实验结束后,分离装置丁中液体混合物的实验操作是________。若发生反应的的体积约为896mL(标准状况),最后得到7.12g纯净,则的产率为________(保留两位有效数字)。
23.(14分)利用催化氧化反应将转化为是工业上生产硫酸的关键步骤,发生反应:。请回答下列问题:
(1)反应过程的能量变化如图所示,则该反应为________(填“放热”或“吸热”)反应。
(2)恒温恒容时,下列措施能使该反应速率增大的是________(填字母)。
a.增加的浓度 b.选择高效催化剂 c.充入氦气 d.适当降低温度
(3)下列情况能够说明该反应达到化学平衡状态的是________(填字母)。
a. b.恒温恒容时,混合气体的密度不再随时间变化
c.的物质的量不再变化 d.、、三者的浓度之比为2:1:2
(4)某次实验中,在容积为2L的恒温密闭容器中通入和,反应过程中部分物质的物质的量随反应时间的变化如图所示。
①2min时,________(填“>”、“<”或“=”)。
②用的浓度变化表示0~5min内反应的平均速率是________。
③反应达到平衡时,的转化率为________。(保留三位有效数字)
(5)制得的硫酸可以用作原电池的电解液。下图所示的原电池装置,X、Y为两金属电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示。
该装置中,X作________极(填“正”或“负”极),若两电极分别为Zn和Fe,写出Y电极的电极反应式________。
24.(12分)有机高分子材料PMA可用于制备复合玻璃,其合成路线如图所示。
回答下列问题:
(1)化合物I的分子式为________。
(2)反应②的反应类型为________
(3)化合物III中所含官能团的名称为________、________。
(4)下列有关化合物III和化合物IV的说法正确的是________。
A.化合物III可以与发生酯化反应
B.化合物III可以与NaOH发生中和反应
C.化合物IV可以使溴的四氯化碳溶液褪色
D.化合物IV不可以使酸性高镇酸钾溶液褪色
(5)写出反应④的化学方程式________。
(6)化合物VI是PMA的________(填“单体”或“链节”),PMA的结构简式为________。
化学卷
考试时间:75分钟 总分:100分
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Cu 64 S 32 Cl 35.5
一单选题(共20题;其中1-12题每题2分,13-20题每题3分,共48分)
1.广东拥有多项非物质文化遗产,以下代表作的主要材料不属于天然有机高分子的是( )
A.东莞莞香所用的常绿乔木 B.佛山醒狮所用的铜锣 C.潮汕剪纸所用的牛皮 D.粤绣用的孔雀毛
2.《黄帝内经·素问》记载“五谷为养,五果为助,五畜为益,五菜为充”,以上食物中富含糖类、蛋白质、油脂等营养物质。下列说法正确的是( )
A.“五谷”富含淀粉,淀粉可用于生产乙醇
B.“五果”富含糖类,葡萄糖、蔗糖都能发生水解反应
C.“五畜”富含蛋白质和油脂,都是由C、H、O三种元素组成的
D.“五菜”富含纤维素,纤维素与淀粉互为同分异构体
3.下列化学用语或模型正确的是( )
A.羟基的电子式: B.的结构式:
C.乙烯的结构简式: D.分子的球棍模型:
4.科学生产中蕴藏着丰富的科学知识。化学改善人类生活,创造美好世界。下列生产、生活情境中涉及的原理不正确的是( )
A.太阳能电池板广泛应用在航天器上,利用的光电性质
B.葡萄酒中通常添加少量,∠既可以杀菌又可以防止营养成分被氧化
C.催化光解设施可处理汽车尾气中的CO、,CO和催化反应生成和
D.景德镇的瓷器可由黏土经高温烧结而成,过程中发生了化学变化
5.下列说法正确的是( )
A.、互为同位素 B.和互为同分异构体
C.CO和互为同素异形体 D.和是同系物
6.下列反应既属于氧化还原反应又属于吸热反应的是( )
A.铝热反应 B.Na与水反应
C.与反应 D.C与反应
7.实验室制取乙酸乙酯时,下列装置不能达到相应实验目的的是( )
A.混合反应物 B.生成乙酸乙酯
C.收集乙酸乙酯 D.分离出乙酸乙酯
8.下列关于物质工业制备原理错误的是( )
A.工业制备金属钠:
B.工业生产铁:
C.湿法炼铜:
D.工业生产镁:
9.设为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,中含有的质子数为
B.2L0.5mol/L氨水中含有的数目为
C.在加热条件下,64g铜与足量硫粉完全反应转移电子数为
D.固体中含有的阴离子数目为
10.下列有关反应事实对应的离子方程式正确的是( )
A.用稀硫酸、双氧水溶解铜:
B.向NaOH溶液中通入过量的:
C.溶液中加入少量溶液:
D.盛放NaOH溶液的试剂瓶不能用磨口玻璃塞的原因:
11.W、X、Y、Z为原子序数依次递增的短周期主族元素,且四种元素位于三个不同周期。X的简单氢化物是天然气的主要成分,Y的最外层电子数是其内层电子数的3倍,Z的单质常用作铝热反应的引燃剂,工业上常从海水中提取Z。下列说法正确的是( )
A.原子半径: B.简单氢化物的稳定性:
C.Z的单质能与冷水发生剧烈反应 D.工业上电解熔触的ZY制备Z的单质
12.某小组拟从苦卤(含等)中提取海,设计的流程如图所示:
下列说法错误的是( )
A.提取溴包括浓缩、氧化、提取
B.步骤2利用的原理是液溴的挥发性(或低沸点性)
C.步骤1和4利用的原理是氯的失电子能力比溴的强
D.步骤3的离子方程式为
13.下列操作或装置不能达到实验目的的是( )
A B C D
探究浓硫酸的脱水性 观察氨的喷泉实验 吸收少量 制取
14.下列有机物的有关说法中不正确的是( )
A.含有2种官能团
B.的一氯代物有3种
C.有2种同分异构体
D.中所有原子不可能共平面
15.下列有关物质检验的实验结论正确的是( )
选项 实验操作及现象 实验结论
A 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 该溶液中一定含有
B 向某溶液中滴加KSCN溶液,溶液不显红色,再向溶液中加入几滴新制得氯水,溶液变为红色 该溶液中一定含有
C 将某气体通入品红溶液中,品红溶液褪色 该气体一定是
D 向某溶液中加入NaOH溶液,将湿润红色石蕊试纸放于试管口,试纸不变蓝 该溶液中一定不含
16.某化学兴趣小组的同学设计了锌铜原电池装置如图所示。下列说法错误的是( )
A.电子从锌片经导线流向铜片 B.电池工作时,铜电极上发生氧化反应
C.电池工作一段时间后,锌片质量减小 D.该装置能证明金属的活动性:
17.部分含氮物质的分类与相应氮元素化合价关系如图所示。下列说法不正确的是( )
A.常温下,a的水溶液
B.一定条件下,b可以转化为a或c,该过程属于氮的固定
C.一定条件下,c、d、e之间存在转化关系:c→d→e
D.实验室用e的浓溶液与Cu反应制备d,可用排水法收集
18.在一定温度下,恒容密闭容器内某一反应中气体M和气体N的物质的量浓度随反应时间变化的曲线如图所示,下列表述不正确的是( )
A.该反应的化学方程式为 B.的速率
C.时, D.时,该反应达到化学平衡
19.下列有关实验操作、现象和所得结论均正确的是( )
选项 实验操作 现象 结论
A 将铝片插入浓硫酸中 无明显现象 铝片和浓硫酸不反应
B 将2mL5%的溶液滴入少量的酸性高锰酸钾溶液 紫色褪去 具有氧化性
C 向0.5g淀粉中加入4mL2mol/L的溶液,加热一段时间,冷却,再加入少量新制的,加热 无砖红色沉淀生成 淀粉未水解
D 分别向两个试管中加入等体积、等浓度的稀盐酸和等质量、同规格的锌片,在其中1个试管中加入少量硫酸铜溶液 加入硫酸铜溶液的试管产生气泡速度快 构成原电池,加快了反应速率
20.某课外兴趣小组利用硫代硫酸钠与稀硫酸反应探究影响化学反应速率的因素[反应方程式为],设计了如表系列实验。下列说法不正确的是( )
实验序号 反应温度(℃) 浓度 稀硫酸
V/mL c/(mol/L) V/mL c/(mol/L) V/mL
1 20 10.0 0.10 10.0 0.50 0
2 40 0.10 0.50
3 20 0.10 4.0 0.50
A.设计该实验的基本原理为控制变量法
B.实验1和2可探究温度对反应速率的影响
C.若用实验1和3探究稀硫酸浓度对该反应速率的影响,则需,
D.通过记录产生沉淀所需的时间可以比较反应的快慢
二.填空题(共52分)
21.(13分)如图是元素周期表的一部分,表中列出了八种元素的位置:
请回答下列问题:
(1)①元素的最简单氢化物的电子式为________。
(2)在元素①-⑧中,金属性最强的元素是________(填元素符号);在元素⑤-⑧中,最高价含氧酸酸性最强的是________(填化学式)。
(3)③、④、⑤三种元素的原子半径由大到小的顺序是________(填元素符号),③和⑦的简单氢化物的稳定性较强的是________(填化学式)。
(4)④和⑤所形成的化合物属于________(填“离子”或“共价”)化合物。
(5)将等物质的量的①的最简单的氢化物和⑧的单质混合后,在漫射光的照射下充分反应,生成物中物质的量最大的是________(写分子式);
(6)⑤和⑥的最高价氧化物对应的水化物之间发生反应的离子方程式为________。
22.(13分)氯化亚砜在农药、制药行业中用途广泛。实验室合成原理为:,合成装置如图所示。
已知:①实验室通常用固体和浓硫酸在不加热时反应制备。
②是沸点为78.8℃的液体,遇水剧烈反应。
③是沸点为60℃的液体,且与互溶。
回答下列问题:
(1)仪器①名称为________。
(2)装置己中反应的化学方程式为________。
(3)装置丙的作用是________。
(4)装置丁中冷凝管的进水口为________(填“②”或“③”)。
干燥管的作用有(I)吸收逸出的、,防污染;(II)________。
(5)用液体吸收尾气可能导致倒吸,下图装置能防倒吸的是________(填标号)
(6)实验结束后,分离装置丁中液体混合物的实验操作是________。若发生反应的的体积约为896mL(标准状况),最后得到7.12g纯净,则的产率为________(保留两位有效数字)。
23.(14分)利用催化氧化反应将转化为是工业上生产硫酸的关键步骤,发生反应:。请回答下列问题:
(1)反应过程的能量变化如图所示,则该反应为________(填“放热”或“吸热”)反应。
(2)恒温恒容时,下列措施能使该反应速率增大的是________(填字母)。
a.增加的浓度 b.选择高效催化剂 c.充入氦气 d.适当降低温度
(3)下列情况能够说明该反应达到化学平衡状态的是________(填字母)。
a. b.恒温恒容时,混合气体的密度不再随时间变化
c.的物质的量不再变化 d.、、三者的浓度之比为2:1:2
(4)某次实验中,在容积为2L的恒温密闭容器中通入和,反应过程中部分物质的物质的量随反应时间的变化如图所示。
①2min时,________(填“>”、“<”或“=”)。
②用的浓度变化表示0~5min内反应的平均速率是________。
③反应达到平衡时,的转化率为________。(保留三位有效数字)
(5)制得的硫酸可以用作原电池的电解液。下图所示的原电池装置,X、Y为两金属电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示。
该装置中,X作________极(填“正”或“负”极),若两电极分别为Zn和Fe,写出Y电极的电极反应式________。
24.(12分)有机高分子材料PMA可用于制备复合玻璃,其合成路线如图所示。
回答下列问题:
(1)化合物I的分子式为________。
(2)反应②的反应类型为________
(3)化合物III中所含官能团的名称为________、________。
(4)下列有关化合物III和化合物IV的说法正确的是________。
A.化合物III可以与发生酯化反应
B.化合物III可以与NaOH发生中和反应
C.化合物IV可以使溴的四氯化碳溶液褪色
D.化合物IV不可以使酸性高镇酸钾溶液褪色
(5)写出反应④的化学方程式________。
(6)化合物VI是PMA的________(填“单体”或“链节”),PMA的结构简式为________。
同课章节目录
