4.3化学键 课件(共30张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 4.3化学键 课件(共30张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 38.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-24 12:01:08 | ||
图片预览








文档简介
(共30张PPT)
第三节 化学键
第四章 物质结构 元素周期律
目录
CONTENT
第四章 物质结构 元素周期律
一、离子键
二、共价键
1.
2.
3.
4.
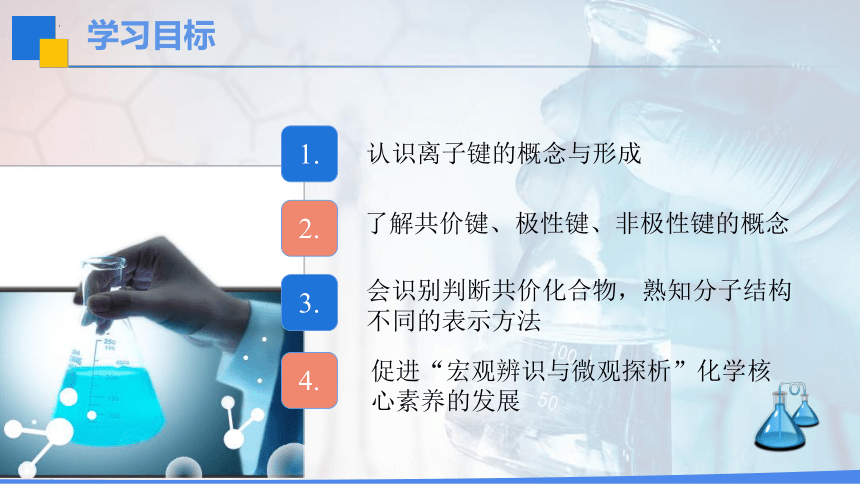
学习目标
认识离子键的概念与形成
促进“宏观辨识与微观探析”化学核心素养的发展
了解共价键、极性键、非极性键的概念
会识别判断共价化合物,熟知分子结构不同的表示方法
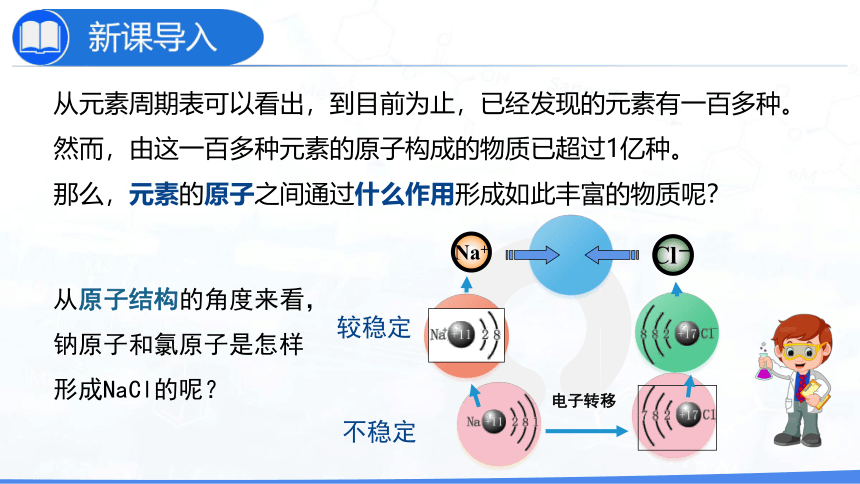
从元素周期表可以看出,到目前为止,已经发现的元素有一百多种。
然而,由这一百多种元素的原子构成的物质已超过1亿种。
那么,元素的原子之间通过什么作用形成如此丰富的物质呢?
从原子结构的角度来看,钠原子和氯原子是怎样形成NaCl的呢?
Cl-
Na+
不稳定
较稳定
电子转移
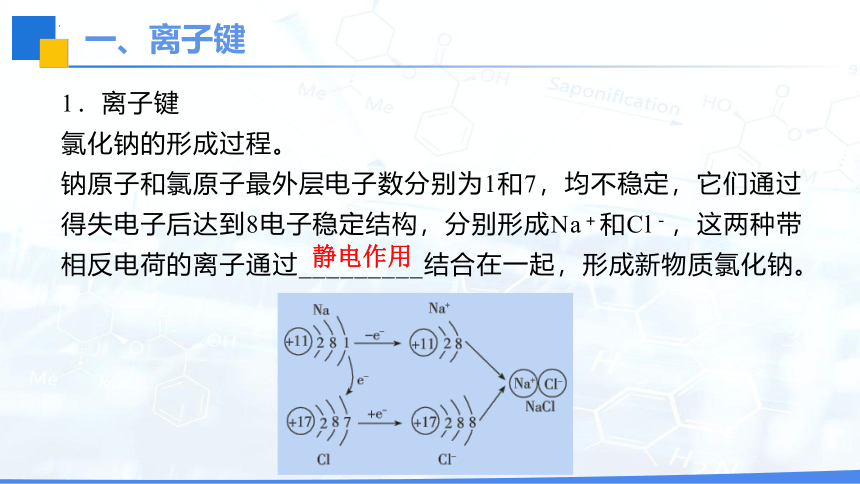
一、离子键
1.离子键
氯化钠的形成过程。
钠原子和氯原子最外层电子数分别为1和7,均不稳定,它们通过得失电子后达到8电子稳定结构,分别形成Na+和Cl-,这两种带相反电荷的离子通过_________结合在一起,形成新物质氯化钠。
静电作用
一、离子键
2.离子键和离子化合物
(1)离子键
带相反电荷离子
阳离子和阴离子
静电作用
静电引力
静电斥力
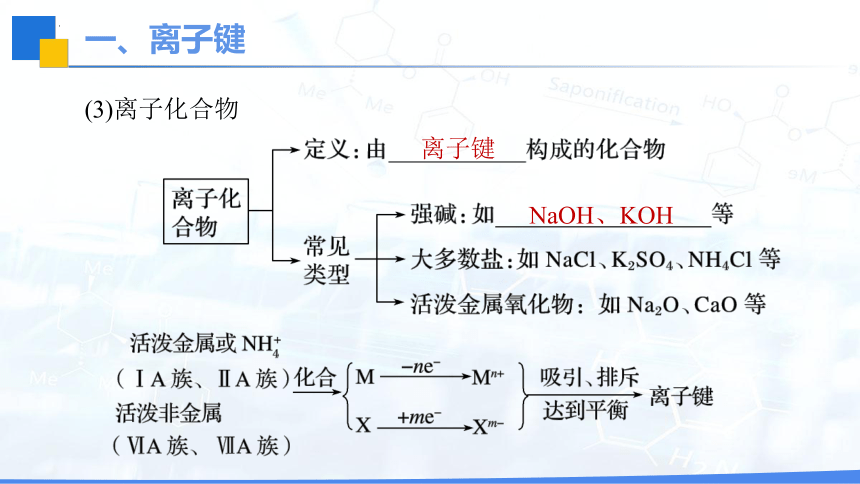
活泼金属
(2)关系:离子化合物一定含有离子键,含离子键的化合物一定是离子化合物。
一、离子键
(3)离子化合物
离子键
NaOH、KOH
一、离子键
(1)三个“一定”
(2)两个“不一定”
①离子化合物中一定含有 ;
②含有 的物质一定是离子化合物;
③ 中一定含有阴离子和阳离子。
①离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等;
②含有金属元素的化合物不一定是离子化合物,如AlCl3。
离子键
离子键
离子化合物
离子键的判定方法
一、离子键
(1)电子式的定义
在元素符号周围用“·”或“×”来表示原子的__________________的式子叫做电子式。
(2)电子式的书写
①原子的电子式:以第三周期元素为例
Na原子:____ Mg原子: 或·Mg·
Al原子:
最外层电子(价电子)
·Na
3.电子式
一、离子键
①简单阳离子的电子式:
简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子的符号表示,例如:Na+、Li+、Mg2+、Al3+等。
②简单阴离子的电子式:
画出最外层电子数,用“[ ]”括起来,并在右上角标出“ ”以表示其所带的电荷。例如:
氯离子 、硫离子 。
③离子化合物的电子式:
氧化钙: 、硫化钾 。
一、离子键
Cl
Na
Na
O
2-
Na
Cl
Mg
2
Cl
AB型
A2B型
AB2型
Mg
2
O
2-
②相同离子不能合并, 同性电荷不直接相邻
(3)离子化合物
①由阴、阳离子的电子式组成
一、离子键
(4)用电子式表示下列物质的形成过程。
左边写原子的电子式,右边写离子化合物的电子式,中间用“―→”连接,例如:
⑤NaCl:
⑥MgBr2:
①左侧写原子的电子式
④右侧写离子化合物的电子式
③中间用 连接
②用弧形箭头表示电子转移的方向
书写要点
硫原子
溴原子
氟原子
硫离子
溴离子
氟离子
铝原子
铝离子
·S·
··
··
··
Br ·
··
··
F ·
··
··
··
Al ·
·
·
[ S ]2-
··
··
:
:
[ Br ]-
··
··
:
:
[ F ]-
··
··
:
:
Al3+
写出下列微粒的电子式
氢化钠
氧化钠
Na
+
H
:
-
Na
O
2-
Na
(1)离子化合物中一定含有金属元素( )
(2)由金属元素和非金属元素形成的化合物一定是离子化合物( )
(3)单质中一定不含有离子键( )
(4)ⅠA族元素与ⅦA族元素形成的化合物一定是离子化合物( )
(5)离子键是阴离子和阳离子间的静电引力( )
×
√
判断正误
×
×
×
二、共价键
1.共价键
(1)HCl形成过程。
H原子和Cl原子最外层电子数分别为1和7,均未达到2或8的稳定结构,而H原子不易失去电子,只能通过形成共用电子对满足各自稳定结构的要求。
二、共价键
共用电子对
原子
非金属
(2)共价键的定义、成键要素及分类
二、共价键
(3)共价化合物
共用电子对
①非金属元素的多原子单质,如____________。
②共价化合物,如_________________。
③某些离子化合物,如_______________。
(4)存在
H2、O2、N2
CO2、HCl、H2SO4
NaOH、Na2CO3、NH4Cl
二、共价键
①电子式
如H2:_____;N2:_______;NH3: 。
②结构式
化学上,常用“—”表示1对__________
共用电子对
(5)共价分子结构的表示方法
物质 H2 HCl CO2 H2O CH4
结构式 ______ ________ ___________
空间构型 — — ______ ______ _________
H—H
H—Cl
O===C===O
直线形
V形
正四面体形
1.根据已知结构写出下列物质的电子式
(1)H—O—Cl: ;
(2)H2O2: 。
2.用电子式表示下列共价分子的形成过程
(1)H2:________________;
(2)NH3: ;
(3)CO2: 。
H·+·H―→H∶H
二、共价键
2.化学键
(1)化学键
相邻的原子
(2)化学反应的本质:一个化学反应过程,本质上就是旧化学键的_____和新化学键的_____过程。
断裂
形成
二、共价键
(3)化学反应:反应物中的原子重新组合为新物质的一种过程。在化学反应过程中,包含着反应物内_____________和产物中_____________。化学反应的过程,本质上就是______________和________________的过程。
(4)分子间作用力
①分子之间存在一种把分子聚集在一起的作用力,叫做分子间作用力。最初也将分子间作用力称为____________。
②范德华力比化学键弱得多,主要影响物质的熔、沸点等。
化学键的断裂
化学键的形成
旧化学键断裂
新化学键形成
范德华力
二、共价键
(5)氢键
①氢键不是化学键,通常把氢键看作是一种_____的分子间作用力。氢键比化学键___,比范德华力___。
②分子间形成的氢键会使物质的熔点和沸点_____,水分子间的氢键可使其密度在固态时_____液态时的密度。
较强
弱
强
升高
小于
【答案】不一定。如NaCl固体的熔化或溶于水都有离子键的破坏,从浓盐酸中挥发出HCl气体有共价键的形成,但这些变化都属于物理变化,非化学变化。
思考:有化学键断裂或生成的变化是否一定是化学变化?
二、共价键
离子化合物与共价化合物的比较
离子化合物 共价化合物
概念 由______构成的化合物 以___________形成分子的化合物
构成粒子 __________ _____
粒子间的作用 _______ _______
熔、沸点 较高 一般较低,少部分很高(如SiO2)
导电性 熔融状态或水溶液导电 熔融状态不导电,溶于水有的导电(如硫酸),有的不导电(如蔗糖)
离子键
共用电子对
阴、阳离子
原子
离子键
共价键
内容 离子键 共价键
概念 带相反电荷的离子之间的相互作用 原子之间通过共用电子对所形成的相互作用
成键方式 通过得失电子达到稳定结构 通过形成共用电子对达到稳定结构
成键粒子 阴、阳离子 原子
成键元素 活泼金属与活泼非金属元素 同种或不同种非金属元素
存在 离子化合物中 绝大多数非金属单质、共价化合物、某些离子化合物中
1.下列说法正确的是( )
A.离子键就是阴、阳离子间的静电引力
B.所有金属元素与所有非金属元素间都能形成离子键
C.钠原子与氯原子结合成氯化钠后体系总能量降低
D.在化合物CaCl2中,两个Cl-间也存在离子键
C
2.下列物质中,含有离子键的是( )
A.单质碘 B.HCl
C.水 D.氯化钠
D
3.下列电子式的书写正确的是( )
A.氮原子: B.O2-离子:
C.Na2O: D.CaCl2:
C
4.下列各项中,能证明HCl是共价化合物的是( )
A.HCl极易溶于水 B.液态HCl不能导电
C.HCl在水溶液中完全电离
D.HCl是无色有刺激性气味的气体
B
5.A元素原子的核电荷数为11,B元素原子的质子数为8,A和B化合形成化合物Z,下列说法中错误的是( )
A.A形成+1价阳离子
B.Z一定能与水反应
C.Z一定是MO型离子化合物
D.Z中含有离子键
C
谢谢
第三节 化学键
第四章 物质结构 元素周期律
目录
CONTENT
第四章 物质结构 元素周期律
一、离子键
二、共价键
1.
2.
3.
4.
学习目标
认识离子键的概念与形成
促进“宏观辨识与微观探析”化学核心素养的发展
了解共价键、极性键、非极性键的概念
会识别判断共价化合物,熟知分子结构不同的表示方法
从元素周期表可以看出,到目前为止,已经发现的元素有一百多种。
然而,由这一百多种元素的原子构成的物质已超过1亿种。
那么,元素的原子之间通过什么作用形成如此丰富的物质呢?
从原子结构的角度来看,钠原子和氯原子是怎样形成NaCl的呢?
Cl-
Na+
不稳定
较稳定
电子转移
一、离子键
1.离子键
氯化钠的形成过程。
钠原子和氯原子最外层电子数分别为1和7,均不稳定,它们通过得失电子后达到8电子稳定结构,分别形成Na+和Cl-,这两种带相反电荷的离子通过_________结合在一起,形成新物质氯化钠。
静电作用
一、离子键
2.离子键和离子化合物
(1)离子键
带相反电荷离子
阳离子和阴离子
静电作用
静电引力
静电斥力
活泼金属
(2)关系:离子化合物一定含有离子键,含离子键的化合物一定是离子化合物。
一、离子键
(3)离子化合物
离子键
NaOH、KOH
一、离子键
(1)三个“一定”
(2)两个“不一定”
①离子化合物中一定含有 ;
②含有 的物质一定是离子化合物;
③ 中一定含有阴离子和阳离子。
①离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等;
②含有金属元素的化合物不一定是离子化合物,如AlCl3。
离子键
离子键
离子化合物
离子键的判定方法
一、离子键
(1)电子式的定义
在元素符号周围用“·”或“×”来表示原子的__________________的式子叫做电子式。
(2)电子式的书写
①原子的电子式:以第三周期元素为例
Na原子:____ Mg原子: 或·Mg·
Al原子:
最外层电子(价电子)
·Na
3.电子式
一、离子键
①简单阳离子的电子式:
简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子的符号表示,例如:Na+、Li+、Mg2+、Al3+等。
②简单阴离子的电子式:
画出最外层电子数,用“[ ]”括起来,并在右上角标出“ ”以表示其所带的电荷。例如:
氯离子 、硫离子 。
③离子化合物的电子式:
氧化钙: 、硫化钾 。
一、离子键
Cl
Na
Na
O
2-
Na
Cl
Mg
2
Cl
AB型
A2B型
AB2型
Mg
2
O
2-
②相同离子不能合并, 同性电荷不直接相邻
(3)离子化合物
①由阴、阳离子的电子式组成
一、离子键
(4)用电子式表示下列物质的形成过程。
左边写原子的电子式,右边写离子化合物的电子式,中间用“―→”连接,例如:
⑤NaCl:
⑥MgBr2:
①左侧写原子的电子式
④右侧写离子化合物的电子式
③中间用 连接
②用弧形箭头表示电子转移的方向
书写要点
硫原子
溴原子
氟原子
硫离子
溴离子
氟离子
铝原子
铝离子
·S·
··
··
··
Br ·
··
··
F ·
··
··
··
Al ·
·
·
[ S ]2-
··
··
:
:
[ Br ]-
··
··
:
:
[ F ]-
··
··
:
:
Al3+
写出下列微粒的电子式
氢化钠
氧化钠
Na
+
H
:
-
Na
O
2-
Na
(1)离子化合物中一定含有金属元素( )
(2)由金属元素和非金属元素形成的化合物一定是离子化合物( )
(3)单质中一定不含有离子键( )
(4)ⅠA族元素与ⅦA族元素形成的化合物一定是离子化合物( )
(5)离子键是阴离子和阳离子间的静电引力( )
×
√
判断正误
×
×
×
二、共价键
1.共价键
(1)HCl形成过程。
H原子和Cl原子最外层电子数分别为1和7,均未达到2或8的稳定结构,而H原子不易失去电子,只能通过形成共用电子对满足各自稳定结构的要求。
二、共价键
共用电子对
原子
非金属
(2)共价键的定义、成键要素及分类
二、共价键
(3)共价化合物
共用电子对
①非金属元素的多原子单质,如____________。
②共价化合物,如_________________。
③某些离子化合物,如_______________。
(4)存在
H2、O2、N2
CO2、HCl、H2SO4
NaOH、Na2CO3、NH4Cl
二、共价键
①电子式
如H2:_____;N2:_______;NH3: 。
②结构式
化学上,常用“—”表示1对__________
共用电子对
(5)共价分子结构的表示方法
物质 H2 HCl CO2 H2O CH4
结构式 ______ ________ ___________
空间构型 — — ______ ______ _________
H—H
H—Cl
O===C===O
直线形
V形
正四面体形
1.根据已知结构写出下列物质的电子式
(1)H—O—Cl: ;
(2)H2O2: 。
2.用电子式表示下列共价分子的形成过程
(1)H2:________________;
(2)NH3: ;
(3)CO2: 。
H·+·H―→H∶H
二、共价键
2.化学键
(1)化学键
相邻的原子
(2)化学反应的本质:一个化学反应过程,本质上就是旧化学键的_____和新化学键的_____过程。
断裂
形成
二、共价键
(3)化学反应:反应物中的原子重新组合为新物质的一种过程。在化学反应过程中,包含着反应物内_____________和产物中_____________。化学反应的过程,本质上就是______________和________________的过程。
(4)分子间作用力
①分子之间存在一种把分子聚集在一起的作用力,叫做分子间作用力。最初也将分子间作用力称为____________。
②范德华力比化学键弱得多,主要影响物质的熔、沸点等。
化学键的断裂
化学键的形成
旧化学键断裂
新化学键形成
范德华力
二、共价键
(5)氢键
①氢键不是化学键,通常把氢键看作是一种_____的分子间作用力。氢键比化学键___,比范德华力___。
②分子间形成的氢键会使物质的熔点和沸点_____,水分子间的氢键可使其密度在固态时_____液态时的密度。
较强
弱
强
升高
小于
【答案】不一定。如NaCl固体的熔化或溶于水都有离子键的破坏,从浓盐酸中挥发出HCl气体有共价键的形成,但这些变化都属于物理变化,非化学变化。
思考:有化学键断裂或生成的变化是否一定是化学变化?
二、共价键
离子化合物与共价化合物的比较
离子化合物 共价化合物
概念 由______构成的化合物 以___________形成分子的化合物
构成粒子 __________ _____
粒子间的作用 _______ _______
熔、沸点 较高 一般较低,少部分很高(如SiO2)
导电性 熔融状态或水溶液导电 熔融状态不导电,溶于水有的导电(如硫酸),有的不导电(如蔗糖)
离子键
共用电子对
阴、阳离子
原子
离子键
共价键
内容 离子键 共价键
概念 带相反电荷的离子之间的相互作用 原子之间通过共用电子对所形成的相互作用
成键方式 通过得失电子达到稳定结构 通过形成共用电子对达到稳定结构
成键粒子 阴、阳离子 原子
成键元素 活泼金属与活泼非金属元素 同种或不同种非金属元素
存在 离子化合物中 绝大多数非金属单质、共价化合物、某些离子化合物中
1.下列说法正确的是( )
A.离子键就是阴、阳离子间的静电引力
B.所有金属元素与所有非金属元素间都能形成离子键
C.钠原子与氯原子结合成氯化钠后体系总能量降低
D.在化合物CaCl2中,两个Cl-间也存在离子键
C
2.下列物质中,含有离子键的是( )
A.单质碘 B.HCl
C.水 D.氯化钠
D
3.下列电子式的书写正确的是( )
A.氮原子: B.O2-离子:
C.Na2O: D.CaCl2:
C
4.下列各项中,能证明HCl是共价化合物的是( )
A.HCl极易溶于水 B.液态HCl不能导电
C.HCl在水溶液中完全电离
D.HCl是无色有刺激性气味的气体
B
5.A元素原子的核电荷数为11,B元素原子的质子数为8,A和B化合形成化合物Z,下列说法中错误的是( )
A.A形成+1价阳离子
B.Z一定能与水反应
C.Z一定是MO型离子化合物
D.Z中含有离子键
C
谢谢
