1.1 原子结构(解析版)
图片预览




文档简介
中小学教育资源及组卷应用平台
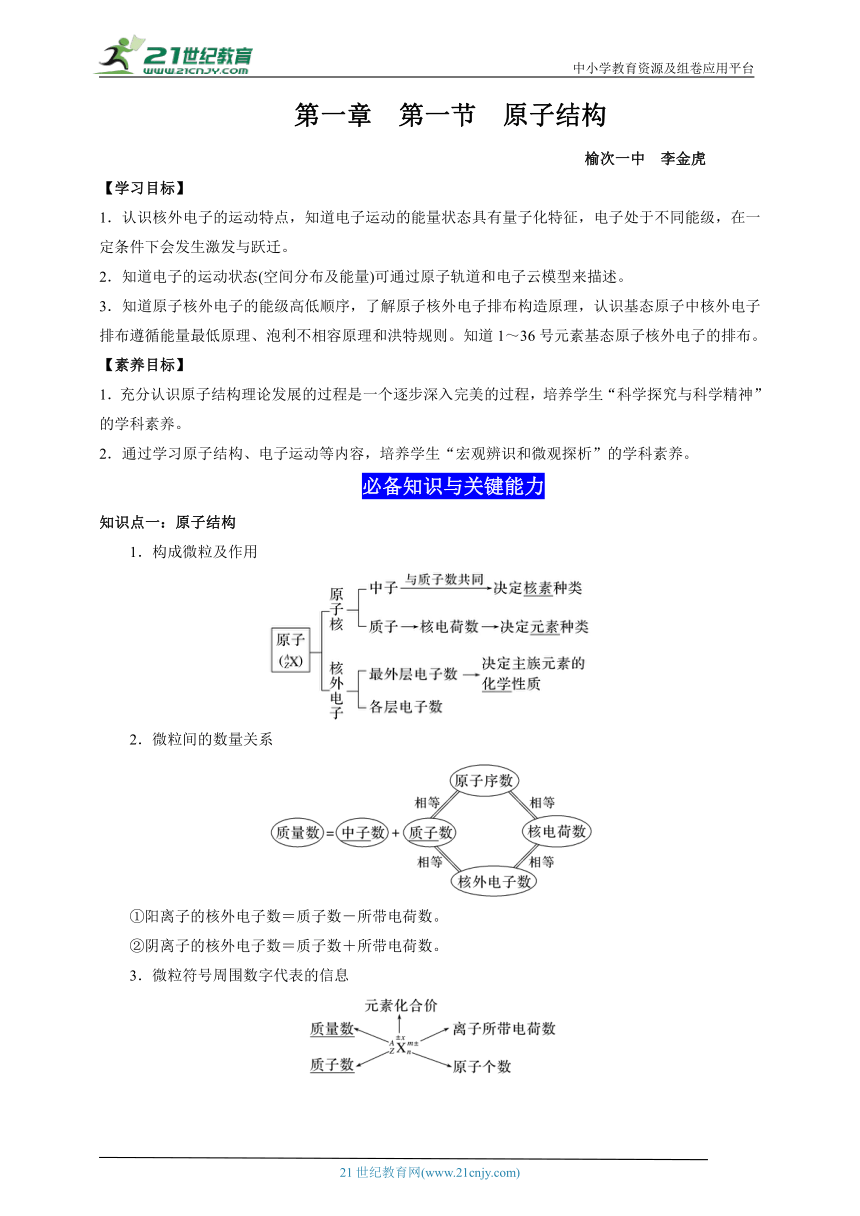
第一章 第一节 原子结构
榆次一中 李金虎
【学习目标】
1.认识核外电子的运动特点,知道电子运动的能量状态具有量子化特征,电子处于不同能级,在一定条件下会发生激发与跃迁。
2.知道电子的运动状态(空间分布及能量)可通过原子轨道和电子云模型来描述。
3.知道原子核外电子的能级高低顺序,了解原子核外电子排布构造原理,认识基态原子中核外电子排布遵循能量最低原理、泡利不相容原理和洪特规则。知道1~36号元素基态原子核外电子的排布。
【素养目标】
1.充分认识原子结构理论发展的过程是一个逐步深入完美的过程,培养学生“科学探究与科学精神”的学科素养。
2.通过学习原子结构、电子运动等内容,培养学生“宏观辨识和微观探析”的学科素养。
必备知识与关键能力
知识点一:原子结构
1.构成微粒及作用
2.微粒间的数量关系
①阳离子的核外电子数=质子数-所带电荷数。
②阴离子的核外电子数=质子数+所带电荷数。
3.微粒符号周围数字代表的信息
典例1.自从1803年英国化学家、物理学家道尔顿提出了原子学说,人类对原子结构的认识就不断深入、发展,并通过实验事实不断完善对原子结构的认识。下列关于原子结构模型的说法中,正确的是( )
A.道尔顿的原子结构模型将原子看作实心球,故不能解释任何问题
B.汤姆孙“葡萄干布丁”原子结构模型成功解释了原子中的正负粒子是可以稳定共存的
C.卢瑟福核式原子结构模型指出了原子核和核外电子的质量关系、电性关系及占有体积的关系
D.玻尔电子分层排布原子结构模型引入了量子化的概念,能够成功解释所有的原子光谱
【答案】C
【解析】道尔顿的原子理论成功解释了质量守恒定律等规律,故A选项是错误的。汤姆孙“葡萄干布丁”原子结构模型提出了正负电荷的共存问题,但同时认为在这样微小的距离上有着极大的作用力,存在着电子会被拉进去并会碰撞在带正电的核心上这样的问题,故B选项是错误的。卢瑟福通过α粒子散射实验提出了核式原子结构模型,散射实验的结果能够分析出原子核和核外电子的质量关系、电性关系及占有体积的关系,故C选项是正确的。玻尔电子分层排布原子结构模型只引入了一个量子化的概念,只能够解释氢原子光谱,而不能解释比较复杂的原子光谱,故D选项是错误的。
典例2.1911年,英国科学家卢瑟福用一束α粒子(带2个单位正电荷的氦原子核)轰击金箔时,发现绝大部分的α粒子都能顺利地穿过金箔,而且不改变原来的前进方向,小部分α粒子改变了原来的运动方向,只有万分之一的α粒子被反弹回来。这个实验不能说明( )
A.原子中存在原子核,它在原子中占极小的体积
B.原子核带正电荷
C.金原子核的质量远大于α粒子的质量
D.金原子中电子是分层排布的
【答案】D
【解析】根据实验无法解解释金原子中电子是分层排布的
知识点二:能层与能级
1.能层
(1) 能层的含义:
多电子原子的核外电子的能量是不同的,按电子的能量差异,可以将核外电子分成不同的能层。
(2)能层的表示符号
能层 一 二 三 四 五 六 七 ……
符号 K L M N O P Q ……
(3)各能层的能量与其离原子核距离的关系
原子核外各能层,随着能层数的增大,其离原子核的距离越远,能量越高。
2.能级
(1)能级的含义:
在多电子原子中,同一能层的电子,能量也可能不同,不同能量的电子分成不同的能级。
(2)能级的表示方法
通常用s、p、d、f表示
3.能层与能级的有关规律
能层 一 二 三 四 五……
符号 K L M N O……
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p ……
最多电子数 2 2 6 2 6 10 2 6 10 14 2 6 ……
电子离核远近 近→远
电子能量高低 低→高
(1)每一能层最多可容纳的电子数为2n2 个(n为能层序数)。
例如,K层最多容纳2个电子;L层最多容纳8个电子;M层最多容纳18个电子;N层最多容纳32个电子……
(2)在每一个能层中,能级符号的顺序是ns、np、nd、nf…… (n代表能层)。
(3)任一能层的能级总是从s能级开始,而且能级数等于该能层序数,即第一能层只有1个能级(1s),第二能层有2个能级(2s和2p),第三能层有3个能级(3s、3p和3d),依次类推。
(4)以s、p、d、f……排序的各能级可容纳的最多电子数依次为1、3、5、7……的二倍。
(5)英文字母相同的不同能级中所能容纳的最多电子数相同。
例如,1s、2s、3s、4s……能级最多都只能容纳2个电子。
典例3.下列有关说法正确的是( )
A.各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n-1
D.各能层含有的电子数为2n2
【答案】A
【解析】各能层含有的能级数等于其所处能层的序数,即当n=1时,它只有1个s能级,当n=2时,含有2个能级,分别为s、p能级,B、C项都不正确。电子从低能级开始填充,填满了低能级再填充较高能级,所以每个能层最多能填充2n2个电子,而不是一定含有2n2个电子,D项不正确。
典例4.下列有关电子层和能级的叙述中正确的是( )
A.M电子层有s、p共2个能级,最多能容纳8个电子
B.3d能级最多容纳5个电子,3f能级最多容纳7个电子
C.无论哪一电子层的s能级最多容纳的电子数均为2
D.每个电子层都有s、p能级,但不一定有d能级
【答案】C
【解析】A项M电子层有s、p、d共3个能级,最多容纳18个电子。B项3d能级最多容纳10个电子,从N电子层开始有f能级,最多容纳14个电子,不存在3f能级。C项每个电子层都从s能级开始,且s能级最多容纳2个电子。D项K电子层只有s能级,不含有p能级。
知识点三:电子云和原子轨道
1.电子云:由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称为电子云。
量子力学指出,不可能像描述宏观物体运动那样,确定具有一定空间运动状态(如1s、2s、3s……)的核外电子在某个时刻处于原子核外空间何处,而只能确定它出现在原子核外空间各处的概率。用P 表示电子在某处出现的概率,V表示该处的体积,则P/V称为概率密度,用 ρ表示。由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称作电子云。换句话说,电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述。
如1s电子云轮廓图的绘制:
2.原子轨道:量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。因此,常用电子云轮廓图的形状和取向来表示原子轨道的形状和取向。
原子轨道 轨道形状 轨道个数 能量关系
s 球形 1 ①同一能层各能级能量顺序:E(ns)<E(np)<E(nd)<E(nf) ②形状相同的原子轨道能量的高低:E(1s)<E(2s)<E(3s)<E(4s)…… ③同一能层内形状相同而伸展方向不同的原子轨道的能量相等,如p能级三个互相垂直的轨道npx、npy、npz的能量相同
p 哑铃形 3
d 5
f 7
【点拨】原子轨道与能层序数的关系
(1)不同能层的同种能级的原子轨道形状相同,只是半径不同。能层序数n越大,原子轨道的半径越大。如:
(2)s能级只有1个原子轨道。p能级有3个原子轨道,它们互相垂直,分别以px、py、pz表示。在同一能层中px、py、pz的能量相同。
(3)原子轨道数与能层序数(n)的关系是原子轨道为n2个。
典例5.下列有关电子云的叙述中,正确的是( )
A.电子云形象地表示了电子在核外某处单位体积内出现的概率
B.电子云直观地表示了核外电子的数目
C.1s电子云界面图是一个球面,表示在这个球面以外,电子出现的概率为零
D.电子云是电子绕核运动形成了一团带负电荷的云雾
【答案】A
【解析】为了形象地表示电子在原子核外空间的分布状况,人们常用小黑点的疏密程度来表示电子在原子核外出现概率的大小:点密集的地方,表示电子出现的概率大;点稀疏的地方,表示电子出现的概率小,这就是电子云。1s电子云界面以外,电子出现的概率不为零,只是出现的概率很小。
典例6.如图甲是氢原子的1s电子云图(即概率密度分布图),图乙、丙分别表示s、p能级的电子云轮廓图。下列有关说法正确的是( )
A.电子云图(即概率密度分布图)就是原子轨道图
B.3p2表示3p能级中有两个原子轨道
C.由图乙可知,s能级的电子云轮廓图呈圆形,有无数条对称轴
D.由图丙可知,p能级的原子轨道图呈哑铃形,且有3个伸展方向
【答案】D
【解析】电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述,图甲就是电子云图(即概率密度分布图)。由于电子云图难以绘制,所以通常把电子出现概率约为90%的空间圈出来,称为电子云轮廓图,实际上这种电子云轮廓图就是我们常说的原子轨道图,故A错误;3p2表示3p能级中容纳了两个电子,故B错误;s能级的电子云轮廓图呈球形而不是圆形,故C错误;p能级的原子轨道图呈哑铃形,有px(沿x轴方向)、py(沿y轴方向)、pz(沿z轴方向)三个伸展方向,并且互相垂直,D正确。
知识点三:构造原理和电子排布式(图)
1.基态原子的核外电子排布
(1)排布原则:
原子核外电子排布“两原理一规则” ①能量最低原理 ②泡利原理 ③洪特规则
【注意】当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低,如基态24Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,而不是1s22s22p63s23p63d44s2。
(2)填充顺序——构造原理
设想从氢原子开始,随着原子核电荷数的递增,原子核每增加一个质子,原子核外便增加一个电子,这个电子大多是按图所示的能级顺序填充的,填满一个能级再填一个新能级。这种规律称为构造原理。
构造原理示意图
2.原子核外电子排布规则的三种表示方法
原子核外电子的排布遵循能量最低原理(又叫做构造原理)、泡利原理(又叫做泡利不相容原理)和洪特规则(还有洪特规则特例)。原子核外电子排布可以用一定的图(式)表示出来。常用表示原子核外电子排布的图(式)有下列三种:
1.原子结构示意图法
如26Fe原子的结构示意图为。原子结构示意图能直观地体现原子的核电荷数和核外电子分层排布情况。
2.电子排布式法
如26Fe原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2。电子排布式能直观地体现原子核外电子分层、分能级排布情况。
3.电子排布图法
一个方框表示一个轨道,一个箭头表示一个电子,如碳的电子排布图:。电子排布图能直观地体现原子核外电子分层、分能级、分轨道排布情况以及电子的自旋状态。
综上所述可知,在原子结构示意图、电子排布式和电子排布图中,对原子核外电子排布表达的具体化程度最低的是原子结构示意图,最高的是电子排布图。对这些图(式)的应用,要根据实际需要适当选择。同时要注意将这些图(式)应用于表示与某原子相对应的离子的核外电子排布。
例:以硫原子为例,基态原子核外电子排布的表示方法
表示方法 以硫原子为例
电子排布式 1s22s22p63s23p4
简化电子排布式 [Ne]3s23p4
轨道表示式(或电子排布图)
价层电子排布式 3s23p4
【思维建模】
1.基态原子核外电子排布式书写的思维流程
在书写基态离子电子排布式时先写出基态原子核外电子排布式,再根据电子得失数目,确定基态离子电子排布式(第四周期过渡金属元素原子失电子变成离子时,要先失去4s轨道电子,后失去3d轨道电子)。
2.基态原子(价层电子)电子排布图(轨道表示式)书写的思维流程
典例7.主族元素的原子失去最外层电子形成阳离子,主族元素的原子得到电子填充在最外层形成阴离子。下列各原子或离子的电子排布式错误的是( )
A.Al 1s22s22p63s23p1 B.O2- 1s22s22p6
C.Na+ 1s22s22p6 D.Si 1s22s22p2
【答案】D
【解析】硅原子的电子排布式为1s22s22p63s23p2。
典例8.下列有关化学用语正确的是( )
A.O原子的轨道表示式为
B.氯化钠的分子式:NaCl
C.S2-的结构示意图:
D.Ca原子的电子排布式为 1s22s22p63s23p63d2
【答案】C
【解析】O原子的2s能级的2个电子应自旋相反,A错误;氯化钠是离子化合物,NaCl只是化学式,不是分子式,B错误;Ca的核电荷数为20,电子排布式应是1s22s22p63s23p64s2,D错误。
知识点四:基态与激发态与原子光谱
1.基态与激发态
2.原子光谱
(1) 原子光谱:不同元素原子的电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称原子光谱。
(2)光谱分析
在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。光谱分析的依据是每一种元素都有自己的特征谱线。做光谱分析时,可以利用吸收光谱,也可以利用发射光谱。
谱分析的应用:①通过原子光谱发现元素。例如铯(1860年)和铷(1861年)的发现,就是因为其光谱图中有特征的蓝光和红光;又如,1868年科学家们通过对太阳光谱的分析发现了稀有气体氦。②化学研究中常利用光谱分析来鉴别物质和确定其化学组成。
典例9.对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因是( )
A.电子由激发态向基态跃迁时以光的形式释放能量
B.电子由基态向激发态跃迁时吸收除红光以外的光线
C.氖原子获得电子后转变成发出红光的物质
D.在电流的作用下,氖原子与构成灯管的物质发生反应
【答案】A
【解析】在电流作用下,基态氖原子的电子吸收能量跃迁到较高能级,变为激发态原子,这一过程要吸收能量,不会发出红色光;而电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将释放能量,从而产生红光,故A项正确。
典例10.原子光谱是线状光谱,是由不连续的谱线组成的,这表明( )
A.在原子中只有某些电子能够跃迁产生光谱
B.原子中的电子可以处于某些特定的能量状态,即电子的能量是量子化的
C.原子发射的光是单色光
D.白光可以由多种单色光组成
【答案】B
【解析】光谱分为连续光谱和线状光谱,无论是单色光还是白光,都是连续光谱,原子光谱是线状光谱,也就是由具有特定频率的光形成的谱线。原子光谱之所以产生这种特定的谱线,是由于电子的能量是量子化的,电子跃迁的始态和终态的能量差也是量子化的。
核心价值与学科素养
【知识结构化】
典例11.正电子、负质子等都是反粒子。它们跟通常所说的电子、质子相比较,质量相等但电性相反。科学家设想在宇宙中可能存在完全由反粒子构成的物质——反物质;物质与反物质相遇会产生“湮灭”现象,释放出巨大的能量,在能源研究领域中前景可观。请你推测,反氢原子的结构可能是( )
A.由一个带正电荷的质子和一个带负电荷的电子构成
B.由一个带负电荷的质子和一个带正电荷的电子构成
C.由一个带正电荷的质子和一个带正电荷的电子构成
D.由一个带负电荷的质子和一个带负电荷的电子构成
【答案】B
【解析】题中给出了正电子、负质子与通常所说的电子、质子关系,据此可推知反氢原子的结构,故选B。
典例12.中国研制的第四代隐形战机歼-20在成都首次公开试飞成功。隐形战机的核心材料是金属钛,我国探明储量世界第一。下列有关推断不正确的是( )
A.钛的原子序数为22
B.钛位于元素周期表第四周期
C.钛原子核外电子排布式为1s22s22p63s23p63d4
D.钛属于过渡元素
【答案】C
【解析】依据元素周期表结构,钛是22号元素,位于第四周期第ⅣB族,它属于过渡元素。依据构造原理,4s能级能量低于3d能级,故应首先排满4s后再排3d,正确排布式为1s22s22p63s23p63d24s2。
【跟踪练习】 基础过关
1. 下列各组原子中,彼此化学性质一定相似的是( )
A.原子核外L能层的未成对电子数与M能层的未成对电子数相等的原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2p能级只有1个空轨道的X原子和3p能级只有1个空轨道的Y原子
D.最外层都只有一个电子的X、Y原子
【答案】C
【解析】L层(M层)只有1个未成对电子的可能是Li或F(Na或Cl),L层(M层)有2个未成对电子的可能是C或O(Si或S),A项错;B项中X为Mg,Y可能为Ca、Sc、Ti、V、Mn、Fe、Co、Ni、Zn等;C项为C()和Si()。
2. A、B属于短周期中不同主族的元素,A、B原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若A元素的原子序数为a,则B元素的原子序数不可能为( )
A.a-4 B.a-5
C.a+3 D.a+11
【答案】A
【解析】若成对电子和未成对电子都占据1个轨道,则为,为硼元素或铝元素;若都占据2个轨道,则为,为氧元素或硫元素。若为硼和氧,或铝和硫,(a+3)合理;若为硼和硫,(a+11)合理;若为铝和氧,(a-5)合理。
3. 构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是( )
A.E(5s)>E(4f)>E(4s)>E(3d) B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(4s)E(4s)>E(4f)>E(3d)
【答案】B
【解析】根据构造原理,各能级能量的大小顺序为1s、2s、2p、3s、3p、4s、3d、4p、5s……能量由低到高,A项和D项正确顺序为E(4f)>E(5s)>E(3d)>E(4s);对于不同能层的相同能级,能层序数越大,能量越高,所以C项错误。
4. 具有下列电子层结构的原子,其对应元素一定属于同一周期的是( )
A.两种原子的电子层上全部都是s电子
B. 3p能级上只有一个空轨道的原子和3p能级上有一个未成对电子的原子
C.最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子
D.原子核外的M层上的s能级和p能级都填满了电子,而d轨道上尚未排有电子的两种原子
【答案】B
【解析】第一周期的氢、氮和第二周期的锂、铍原子的电子层上全是s电子,显然它们分属于不同周期,故A错;3p能级只有一个空轨道的原子是硅,3p能级上有一个未成对电子的原子是铝和氯,同在第三周期,故B正确;最外层电子排布为2s22p6的原子是第二周期的氖,而最外层电子排布为2s22p6的离子可能是第二周期的氧、氟,也可能是第三周期的钠、镁、铝,故C错; 原子核外的M层上s能级和p能级都填满了电子,而d轨道上尚未排有电子的原子可能是第三周期的氩,也可能是第四周期的钾、钙,故D错。
5. 短周期元素R基态原子最外层的p能级上有2个未成对电子。则关于基态R原子的描述中正确的是( )
A.基态R原子核外电子的电子云轮廓图有两种:球形和哑铃形
B.基态R原子的价层电子排布式为ns2np2(n=2或3)
C.基态R原子的原子轨道总数为9
D.基态R原子的轨道表示式为
【答案】A
【解析】由“短周期元素R基态原子最外层的p能级上有2个未成对电子”可知,可能有两种情况:p能级上只有2个电子,R为第ⅣA族元素,C或Si;p能级上有4个电子,R为第ⅥA族元素,O或S,故只有A正确。
折 能力达成
6. 根据题给信息,回答相关问题。
(1)(2020·全国卷Ⅱ·节选)基态Ti原子的核外电子排布式为________________________。
(2)(2020·天津等级考·节选)Fe、Co、Ni在周期表中的位置为________,基态Fe原子的电子排布式为__________________________________________________________________。
(3)(2019·全国卷Ⅱ·节选)Fe成为阳离子时首先失去________轨道电子,Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为________。
(4)(2018·全国卷Ⅰ·节选)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)。
(5)(2018·全国卷Ⅱ·节选)基态Fe原子价层电子的电子排布图(轨道表达式)为________,基态S原子电子占据最高能级的电子云轮廓图为________形。
【答案】(1) 1s22s22p63s23p63d24s2或[Ar]3d24s2
(2)第四周期第Ⅷ族 1s22s22p63s23p63d64s2或[Ar]3d64s2
(3)4s 4f5 (4)D C (5) 哑铃(纺锤)
【解析】(1)Ti是22号元素,其基态原子核外电子排布式为1s22s22p63s23p63d24s2或[Ar]3d24s2。(2)在元素周期表中Fe、Co、Ni都是第四周期第Ⅷ族的元素;Fe为26号元素,其基态原子的电子排布式是1s22s22p63s23p63d64s2或[Ar]3d64s2。(3)Fe的价层电子排布式为3d64s2,成为阳离子时首先失去的是4s轨道的电子。Sm3+是Sm原子失去3个电子形成的,Sm的价层电子排布式为4f66s2,失去3个电子时,首先失去6s轨道上的2个电子,再失去4f轨道上的1个电子,因此Sm3+的价层电子排布式为4f5。(4)D选项表示基态,为能量最低状态;A、B、C选项均表示激发态,但C选项被激发的电子处于高能级的电子数多,为能量最高状态。(5)基态Fe原子的核外电子排布式为1s22s22p63s23p63d64s2,因此其价层电子的电子排布图为 ;基态S原子的核外电子排布式为1s22s22p63s23p4,最高能级为3p,其电子云轮廓图为哑铃(纺锤)形。
7. A、B、C、D、E、F代表6种元素。请填空:
(1)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,其元素符号为________。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为________,C的元素符号为________。
(3)D元素的正三价离子的3d能级为半充满,D的元素符号为________,其基态原子的电子排布式为_________________。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为________,其基态原子的电子排布式为________________________。
(5)F元素的原子最外层电子排布式为nsnnpn+1,则n=________;原子中能量最高的是________电子。
【答案】(1)C或O (2)Cl K (3)Fe 1s22s22p63s23p63d64s2(或[Ar]3d64s2)
(4)Cu 1s22s22p63s23p63d104s1(或[Ar]3d104s1) (5)2 2p
【解析】(1)A元素基态原子次外层有2个电子,故次外层为K层,A元素有2个电子层,由题意可写出其电子排布图为或,则该元素核外有6或8个电子,为碳元素或氧元素。(2)B-、C+的电子层结构都与Ar相同,即核外都有18个电子,则B为17号元素Cl,C为19号元素K。(3)D元素原子失去2个4s电子和1个3d电子后变成+3价离子,其原子的核外电子排布式为1s22s22p63s23p63d64s2,即为26号元素Fe。(4)根据题意要求,首先写出电子排布式:1s22s22p63s23p63d104s1,该元素为29号元素Cu。(5)s能级只有1个原子轨道,故最多只能容纳2个电子,即n=2,所以元素F的原子的最外层电子排布式为2s22p3,由此可知F是N元素;根据核外电子排布的能量最低原理,可知氮原子的核外电子中的2p能级能量最高。
8. 根据题给信息,回答下列问题。
(1)Cr3+基态核外电子排布式为________________。
(2)钒(23V)在元素周期表中的位置为 ,其价层电子排布图为___________________。
(3)基态Ni原子的电子排布式为________,该元素位于元素周期表中的第________族。
(4)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用________形象化描述。在基态14C原子中,核外存在________对自旋相反的电子。
(5)A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。四种元素中电负性最大的是________(填元素符号),其中C原子的核外电子排布式为________________。
【答案】(1)1s22s22p63s23p63d3或[Ar]3d3
(2)第四周期ⅤB族
(3)1s22s22p63s23p63d84s2或[Ar]3d84s2 Ⅷ
(4)电子云 2
(5)O 1s22s22p63s23p3或[Ne]3s23p3
【解析】(1)基态Cr原子核外电子排布式为1s22s22p63s23p63d54s1,失去4s轨道的1个电子和3d轨道上的2个电子得到Cr3+,故Cr3+基态核外电子排布式为1s22s22p63s23p63d3或[Ar]3d3。
(2)钒(23V)的原子序数为23,位于周期表中第四周期ⅤB族,价层电子排布式为3d34s2,价层电子排布图为。
(3)基态Ni原子的核外有28个电子,电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2,位于元素周期表第Ⅷ族。
(4)基态14C原子核外电子排布式为1s22s22p2,1s、2s轨道各存在1对自旋相反的电子,2p轨道上的2个电子自旋方向相同。
(5)C核外电子总数是最外层电子数的3倍,则C可能是Li或P,由于A、B、C、D的原子序数依次增大,则C应为P元素;D元素最外层有一个未成对电子,则D为Cl元素。A2-和B+的电子层结构相同,则A为O元素,B为Na元素。根据周期表中同周期(或主族)元素电负性变化规律可知,电负性:O>Cl>P>Na,故电负性最大的是O元素。C(P)原子核外有15个电子,核外电子排布式为1s22s22p63s23p3或[Ne]3s23p3。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
第一章 第一节 原子结构
榆次一中 李金虎
【学习目标】
1.认识核外电子的运动特点,知道电子运动的能量状态具有量子化特征,电子处于不同能级,在一定条件下会发生激发与跃迁。
2.知道电子的运动状态(空间分布及能量)可通过原子轨道和电子云模型来描述。
3.知道原子核外电子的能级高低顺序,了解原子核外电子排布构造原理,认识基态原子中核外电子排布遵循能量最低原理、泡利不相容原理和洪特规则。知道1~36号元素基态原子核外电子的排布。
【素养目标】
1.充分认识原子结构理论发展的过程是一个逐步深入完美的过程,培养学生“科学探究与科学精神”的学科素养。
2.通过学习原子结构、电子运动等内容,培养学生“宏观辨识和微观探析”的学科素养。
必备知识与关键能力
知识点一:原子结构
1.构成微粒及作用
2.微粒间的数量关系
①阳离子的核外电子数=质子数-所带电荷数。
②阴离子的核外电子数=质子数+所带电荷数。
3.微粒符号周围数字代表的信息
典例1.自从1803年英国化学家、物理学家道尔顿提出了原子学说,人类对原子结构的认识就不断深入、发展,并通过实验事实不断完善对原子结构的认识。下列关于原子结构模型的说法中,正确的是( )
A.道尔顿的原子结构模型将原子看作实心球,故不能解释任何问题
B.汤姆孙“葡萄干布丁”原子结构模型成功解释了原子中的正负粒子是可以稳定共存的
C.卢瑟福核式原子结构模型指出了原子核和核外电子的质量关系、电性关系及占有体积的关系
D.玻尔电子分层排布原子结构模型引入了量子化的概念,能够成功解释所有的原子光谱
【答案】C
【解析】道尔顿的原子理论成功解释了质量守恒定律等规律,故A选项是错误的。汤姆孙“葡萄干布丁”原子结构模型提出了正负电荷的共存问题,但同时认为在这样微小的距离上有着极大的作用力,存在着电子会被拉进去并会碰撞在带正电的核心上这样的问题,故B选项是错误的。卢瑟福通过α粒子散射实验提出了核式原子结构模型,散射实验的结果能够分析出原子核和核外电子的质量关系、电性关系及占有体积的关系,故C选项是正确的。玻尔电子分层排布原子结构模型只引入了一个量子化的概念,只能够解释氢原子光谱,而不能解释比较复杂的原子光谱,故D选项是错误的。
典例2.1911年,英国科学家卢瑟福用一束α粒子(带2个单位正电荷的氦原子核)轰击金箔时,发现绝大部分的α粒子都能顺利地穿过金箔,而且不改变原来的前进方向,小部分α粒子改变了原来的运动方向,只有万分之一的α粒子被反弹回来。这个实验不能说明( )
A.原子中存在原子核,它在原子中占极小的体积
B.原子核带正电荷
C.金原子核的质量远大于α粒子的质量
D.金原子中电子是分层排布的
【答案】D
【解析】根据实验无法解解释金原子中电子是分层排布的
知识点二:能层与能级
1.能层
(1) 能层的含义:
多电子原子的核外电子的能量是不同的,按电子的能量差异,可以将核外电子分成不同的能层。
(2)能层的表示符号
能层 一 二 三 四 五 六 七 ……
符号 K L M N O P Q ……
(3)各能层的能量与其离原子核距离的关系
原子核外各能层,随着能层数的增大,其离原子核的距离越远,能量越高。
2.能级
(1)能级的含义:
在多电子原子中,同一能层的电子,能量也可能不同,不同能量的电子分成不同的能级。
(2)能级的表示方法
通常用s、p、d、f表示
3.能层与能级的有关规律
能层 一 二 三 四 五……
符号 K L M N O……
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p ……
最多电子数 2 2 6 2 6 10 2 6 10 14 2 6 ……
电子离核远近 近→远
电子能量高低 低→高
(1)每一能层最多可容纳的电子数为2n2 个(n为能层序数)。
例如,K层最多容纳2个电子;L层最多容纳8个电子;M层最多容纳18个电子;N层最多容纳32个电子……
(2)在每一个能层中,能级符号的顺序是ns、np、nd、nf…… (n代表能层)。
(3)任一能层的能级总是从s能级开始,而且能级数等于该能层序数,即第一能层只有1个能级(1s),第二能层有2个能级(2s和2p),第三能层有3个能级(3s、3p和3d),依次类推。
(4)以s、p、d、f……排序的各能级可容纳的最多电子数依次为1、3、5、7……的二倍。
(5)英文字母相同的不同能级中所能容纳的最多电子数相同。
例如,1s、2s、3s、4s……能级最多都只能容纳2个电子。
典例3.下列有关说法正确的是( )
A.各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n-1
D.各能层含有的电子数为2n2
【答案】A
【解析】各能层含有的能级数等于其所处能层的序数,即当n=1时,它只有1个s能级,当n=2时,含有2个能级,分别为s、p能级,B、C项都不正确。电子从低能级开始填充,填满了低能级再填充较高能级,所以每个能层最多能填充2n2个电子,而不是一定含有2n2个电子,D项不正确。
典例4.下列有关电子层和能级的叙述中正确的是( )
A.M电子层有s、p共2个能级,最多能容纳8个电子
B.3d能级最多容纳5个电子,3f能级最多容纳7个电子
C.无论哪一电子层的s能级最多容纳的电子数均为2
D.每个电子层都有s、p能级,但不一定有d能级
【答案】C
【解析】A项M电子层有s、p、d共3个能级,最多容纳18个电子。B项3d能级最多容纳10个电子,从N电子层开始有f能级,最多容纳14个电子,不存在3f能级。C项每个电子层都从s能级开始,且s能级最多容纳2个电子。D项K电子层只有s能级,不含有p能级。
知识点三:电子云和原子轨道
1.电子云:由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称为电子云。
量子力学指出,不可能像描述宏观物体运动那样,确定具有一定空间运动状态(如1s、2s、3s……)的核外电子在某个时刻处于原子核外空间何处,而只能确定它出现在原子核外空间各处的概率。用P 表示电子在某处出现的概率,V表示该处的体积,则P/V称为概率密度,用 ρ表示。由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称作电子云。换句话说,电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述。
如1s电子云轮廓图的绘制:
2.原子轨道:量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。因此,常用电子云轮廓图的形状和取向来表示原子轨道的形状和取向。
原子轨道 轨道形状 轨道个数 能量关系
s 球形 1 ①同一能层各能级能量顺序:E(ns)<E(np)<E(nd)<E(nf) ②形状相同的原子轨道能量的高低:E(1s)<E(2s)<E(3s)<E(4s)…… ③同一能层内形状相同而伸展方向不同的原子轨道的能量相等,如p能级三个互相垂直的轨道npx、npy、npz的能量相同
p 哑铃形 3
d 5
f 7
【点拨】原子轨道与能层序数的关系
(1)不同能层的同种能级的原子轨道形状相同,只是半径不同。能层序数n越大,原子轨道的半径越大。如:
(2)s能级只有1个原子轨道。p能级有3个原子轨道,它们互相垂直,分别以px、py、pz表示。在同一能层中px、py、pz的能量相同。
(3)原子轨道数与能层序数(n)的关系是原子轨道为n2个。
典例5.下列有关电子云的叙述中,正确的是( )
A.电子云形象地表示了电子在核外某处单位体积内出现的概率
B.电子云直观地表示了核外电子的数目
C.1s电子云界面图是一个球面,表示在这个球面以外,电子出现的概率为零
D.电子云是电子绕核运动形成了一团带负电荷的云雾
【答案】A
【解析】为了形象地表示电子在原子核外空间的分布状况,人们常用小黑点的疏密程度来表示电子在原子核外出现概率的大小:点密集的地方,表示电子出现的概率大;点稀疏的地方,表示电子出现的概率小,这就是电子云。1s电子云界面以外,电子出现的概率不为零,只是出现的概率很小。
典例6.如图甲是氢原子的1s电子云图(即概率密度分布图),图乙、丙分别表示s、p能级的电子云轮廓图。下列有关说法正确的是( )
A.电子云图(即概率密度分布图)就是原子轨道图
B.3p2表示3p能级中有两个原子轨道
C.由图乙可知,s能级的电子云轮廓图呈圆形,有无数条对称轴
D.由图丙可知,p能级的原子轨道图呈哑铃形,且有3个伸展方向
【答案】D
【解析】电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述,图甲就是电子云图(即概率密度分布图)。由于电子云图难以绘制,所以通常把电子出现概率约为90%的空间圈出来,称为电子云轮廓图,实际上这种电子云轮廓图就是我们常说的原子轨道图,故A错误;3p2表示3p能级中容纳了两个电子,故B错误;s能级的电子云轮廓图呈球形而不是圆形,故C错误;p能级的原子轨道图呈哑铃形,有px(沿x轴方向)、py(沿y轴方向)、pz(沿z轴方向)三个伸展方向,并且互相垂直,D正确。
知识点三:构造原理和电子排布式(图)
1.基态原子的核外电子排布
(1)排布原则:
原子核外电子排布“两原理一规则” ①能量最低原理 ②泡利原理 ③洪特规则
【注意】当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低,如基态24Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,而不是1s22s22p63s23p63d44s2。
(2)填充顺序——构造原理
设想从氢原子开始,随着原子核电荷数的递增,原子核每增加一个质子,原子核外便增加一个电子,这个电子大多是按图所示的能级顺序填充的,填满一个能级再填一个新能级。这种规律称为构造原理。
构造原理示意图
2.原子核外电子排布规则的三种表示方法
原子核外电子的排布遵循能量最低原理(又叫做构造原理)、泡利原理(又叫做泡利不相容原理)和洪特规则(还有洪特规则特例)。原子核外电子排布可以用一定的图(式)表示出来。常用表示原子核外电子排布的图(式)有下列三种:
1.原子结构示意图法
如26Fe原子的结构示意图为。原子结构示意图能直观地体现原子的核电荷数和核外电子分层排布情况。
2.电子排布式法
如26Fe原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2。电子排布式能直观地体现原子核外电子分层、分能级排布情况。
3.电子排布图法
一个方框表示一个轨道,一个箭头表示一个电子,如碳的电子排布图:。电子排布图能直观地体现原子核外电子分层、分能级、分轨道排布情况以及电子的自旋状态。
综上所述可知,在原子结构示意图、电子排布式和电子排布图中,对原子核外电子排布表达的具体化程度最低的是原子结构示意图,最高的是电子排布图。对这些图(式)的应用,要根据实际需要适当选择。同时要注意将这些图(式)应用于表示与某原子相对应的离子的核外电子排布。
例:以硫原子为例,基态原子核外电子排布的表示方法
表示方法 以硫原子为例
电子排布式 1s22s22p63s23p4
简化电子排布式 [Ne]3s23p4
轨道表示式(或电子排布图)
价层电子排布式 3s23p4
【思维建模】
1.基态原子核外电子排布式书写的思维流程
在书写基态离子电子排布式时先写出基态原子核外电子排布式,再根据电子得失数目,确定基态离子电子排布式(第四周期过渡金属元素原子失电子变成离子时,要先失去4s轨道电子,后失去3d轨道电子)。
2.基态原子(价层电子)电子排布图(轨道表示式)书写的思维流程
典例7.主族元素的原子失去最外层电子形成阳离子,主族元素的原子得到电子填充在最外层形成阴离子。下列各原子或离子的电子排布式错误的是( )
A.Al 1s22s22p63s23p1 B.O2- 1s22s22p6
C.Na+ 1s22s22p6 D.Si 1s22s22p2
【答案】D
【解析】硅原子的电子排布式为1s22s22p63s23p2。
典例8.下列有关化学用语正确的是( )
A.O原子的轨道表示式为
B.氯化钠的分子式:NaCl
C.S2-的结构示意图:
D.Ca原子的电子排布式为 1s22s22p63s23p63d2
【答案】C
【解析】O原子的2s能级的2个电子应自旋相反,A错误;氯化钠是离子化合物,NaCl只是化学式,不是分子式,B错误;Ca的核电荷数为20,电子排布式应是1s22s22p63s23p64s2,D错误。
知识点四:基态与激发态与原子光谱
1.基态与激发态
2.原子光谱
(1) 原子光谱:不同元素原子的电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称原子光谱。
(2)光谱分析
在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。光谱分析的依据是每一种元素都有自己的特征谱线。做光谱分析时,可以利用吸收光谱,也可以利用发射光谱。
谱分析的应用:①通过原子光谱发现元素。例如铯(1860年)和铷(1861年)的发现,就是因为其光谱图中有特征的蓝光和红光;又如,1868年科学家们通过对太阳光谱的分析发现了稀有气体氦。②化学研究中常利用光谱分析来鉴别物质和确定其化学组成。
典例9.对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因是( )
A.电子由激发态向基态跃迁时以光的形式释放能量
B.电子由基态向激发态跃迁时吸收除红光以外的光线
C.氖原子获得电子后转变成发出红光的物质
D.在电流的作用下,氖原子与构成灯管的物质发生反应
【答案】A
【解析】在电流作用下,基态氖原子的电子吸收能量跃迁到较高能级,变为激发态原子,这一过程要吸收能量,不会发出红色光;而电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将释放能量,从而产生红光,故A项正确。
典例10.原子光谱是线状光谱,是由不连续的谱线组成的,这表明( )
A.在原子中只有某些电子能够跃迁产生光谱
B.原子中的电子可以处于某些特定的能量状态,即电子的能量是量子化的
C.原子发射的光是单色光
D.白光可以由多种单色光组成
【答案】B
【解析】光谱分为连续光谱和线状光谱,无论是单色光还是白光,都是连续光谱,原子光谱是线状光谱,也就是由具有特定频率的光形成的谱线。原子光谱之所以产生这种特定的谱线,是由于电子的能量是量子化的,电子跃迁的始态和终态的能量差也是量子化的。
核心价值与学科素养
【知识结构化】
典例11.正电子、负质子等都是反粒子。它们跟通常所说的电子、质子相比较,质量相等但电性相反。科学家设想在宇宙中可能存在完全由反粒子构成的物质——反物质;物质与反物质相遇会产生“湮灭”现象,释放出巨大的能量,在能源研究领域中前景可观。请你推测,反氢原子的结构可能是( )
A.由一个带正电荷的质子和一个带负电荷的电子构成
B.由一个带负电荷的质子和一个带正电荷的电子构成
C.由一个带正电荷的质子和一个带正电荷的电子构成
D.由一个带负电荷的质子和一个带负电荷的电子构成
【答案】B
【解析】题中给出了正电子、负质子与通常所说的电子、质子关系,据此可推知反氢原子的结构,故选B。
典例12.中国研制的第四代隐形战机歼-20在成都首次公开试飞成功。隐形战机的核心材料是金属钛,我国探明储量世界第一。下列有关推断不正确的是( )
A.钛的原子序数为22
B.钛位于元素周期表第四周期
C.钛原子核外电子排布式为1s22s22p63s23p63d4
D.钛属于过渡元素
【答案】C
【解析】依据元素周期表结构,钛是22号元素,位于第四周期第ⅣB族,它属于过渡元素。依据构造原理,4s能级能量低于3d能级,故应首先排满4s后再排3d,正确排布式为1s22s22p63s23p63d24s2。
【跟踪练习】 基础过关
1. 下列各组原子中,彼此化学性质一定相似的是( )
A.原子核外L能层的未成对电子数与M能层的未成对电子数相等的原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2p能级只有1个空轨道的X原子和3p能级只有1个空轨道的Y原子
D.最外层都只有一个电子的X、Y原子
【答案】C
【解析】L层(M层)只有1个未成对电子的可能是Li或F(Na或Cl),L层(M层)有2个未成对电子的可能是C或O(Si或S),A项错;B项中X为Mg,Y可能为Ca、Sc、Ti、V、Mn、Fe、Co、Ni、Zn等;C项为C()和Si()。
2. A、B属于短周期中不同主族的元素,A、B原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若A元素的原子序数为a,则B元素的原子序数不可能为( )
A.a-4 B.a-5
C.a+3 D.a+11
【答案】A
【解析】若成对电子和未成对电子都占据1个轨道,则为,为硼元素或铝元素;若都占据2个轨道,则为,为氧元素或硫元素。若为硼和氧,或铝和硫,(a+3)合理;若为硼和硫,(a+11)合理;若为铝和氧,(a-5)合理。
3. 构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是( )
A.E(5s)>E(4f)>E(4s)>E(3d) B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(4s)
【答案】B
【解析】根据构造原理,各能级能量的大小顺序为1s、2s、2p、3s、3p、4s、3d、4p、5s……能量由低到高,A项和D项正确顺序为E(4f)>E(5s)>E(3d)>E(4s);对于不同能层的相同能级,能层序数越大,能量越高,所以C项错误。
4. 具有下列电子层结构的原子,其对应元素一定属于同一周期的是( )
A.两种原子的电子层上全部都是s电子
B. 3p能级上只有一个空轨道的原子和3p能级上有一个未成对电子的原子
C.最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子
D.原子核外的M层上的s能级和p能级都填满了电子,而d轨道上尚未排有电子的两种原子
【答案】B
【解析】第一周期的氢、氮和第二周期的锂、铍原子的电子层上全是s电子,显然它们分属于不同周期,故A错;3p能级只有一个空轨道的原子是硅,3p能级上有一个未成对电子的原子是铝和氯,同在第三周期,故B正确;最外层电子排布为2s22p6的原子是第二周期的氖,而最外层电子排布为2s22p6的离子可能是第二周期的氧、氟,也可能是第三周期的钠、镁、铝,故C错; 原子核外的M层上s能级和p能级都填满了电子,而d轨道上尚未排有电子的原子可能是第三周期的氩,也可能是第四周期的钾、钙,故D错。
5. 短周期元素R基态原子最外层的p能级上有2个未成对电子。则关于基态R原子的描述中正确的是( )
A.基态R原子核外电子的电子云轮廓图有两种:球形和哑铃形
B.基态R原子的价层电子排布式为ns2np2(n=2或3)
C.基态R原子的原子轨道总数为9
D.基态R原子的轨道表示式为
【答案】A
【解析】由“短周期元素R基态原子最外层的p能级上有2个未成对电子”可知,可能有两种情况:p能级上只有2个电子,R为第ⅣA族元素,C或Si;p能级上有4个电子,R为第ⅥA族元素,O或S,故只有A正确。
折 能力达成
6. 根据题给信息,回答相关问题。
(1)(2020·全国卷Ⅱ·节选)基态Ti原子的核外电子排布式为________________________。
(2)(2020·天津等级考·节选)Fe、Co、Ni在周期表中的位置为________,基态Fe原子的电子排布式为__________________________________________________________________。
(3)(2019·全国卷Ⅱ·节选)Fe成为阳离子时首先失去________轨道电子,Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为________。
(4)(2018·全国卷Ⅰ·节选)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)。
(5)(2018·全国卷Ⅱ·节选)基态Fe原子价层电子的电子排布图(轨道表达式)为________,基态S原子电子占据最高能级的电子云轮廓图为________形。
【答案】(1) 1s22s22p63s23p63d24s2或[Ar]3d24s2
(2)第四周期第Ⅷ族 1s22s22p63s23p63d64s2或[Ar]3d64s2
(3)4s 4f5 (4)D C (5) 哑铃(纺锤)
【解析】(1)Ti是22号元素,其基态原子核外电子排布式为1s22s22p63s23p63d24s2或[Ar]3d24s2。(2)在元素周期表中Fe、Co、Ni都是第四周期第Ⅷ族的元素;Fe为26号元素,其基态原子的电子排布式是1s22s22p63s23p63d64s2或[Ar]3d64s2。(3)Fe的价层电子排布式为3d64s2,成为阳离子时首先失去的是4s轨道的电子。Sm3+是Sm原子失去3个电子形成的,Sm的价层电子排布式为4f66s2,失去3个电子时,首先失去6s轨道上的2个电子,再失去4f轨道上的1个电子,因此Sm3+的价层电子排布式为4f5。(4)D选项表示基态,为能量最低状态;A、B、C选项均表示激发态,但C选项被激发的电子处于高能级的电子数多,为能量最高状态。(5)基态Fe原子的核外电子排布式为1s22s22p63s23p63d64s2,因此其价层电子的电子排布图为 ;基态S原子的核外电子排布式为1s22s22p63s23p4,最高能级为3p,其电子云轮廓图为哑铃(纺锤)形。
7. A、B、C、D、E、F代表6种元素。请填空:
(1)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,其元素符号为________。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为________,C的元素符号为________。
(3)D元素的正三价离子的3d能级为半充满,D的元素符号为________,其基态原子的电子排布式为_________________。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为________,其基态原子的电子排布式为________________________。
(5)F元素的原子最外层电子排布式为nsnnpn+1,则n=________;原子中能量最高的是________电子。
【答案】(1)C或O (2)Cl K (3)Fe 1s22s22p63s23p63d64s2(或[Ar]3d64s2)
(4)Cu 1s22s22p63s23p63d104s1(或[Ar]3d104s1) (5)2 2p
【解析】(1)A元素基态原子次外层有2个电子,故次外层为K层,A元素有2个电子层,由题意可写出其电子排布图为或,则该元素核外有6或8个电子,为碳元素或氧元素。(2)B-、C+的电子层结构都与Ar相同,即核外都有18个电子,则B为17号元素Cl,C为19号元素K。(3)D元素原子失去2个4s电子和1个3d电子后变成+3价离子,其原子的核外电子排布式为1s22s22p63s23p63d64s2,即为26号元素Fe。(4)根据题意要求,首先写出电子排布式:1s22s22p63s23p63d104s1,该元素为29号元素Cu。(5)s能级只有1个原子轨道,故最多只能容纳2个电子,即n=2,所以元素F的原子的最外层电子排布式为2s22p3,由此可知F是N元素;根据核外电子排布的能量最低原理,可知氮原子的核外电子中的2p能级能量最高。
8. 根据题给信息,回答下列问题。
(1)Cr3+基态核外电子排布式为________________。
(2)钒(23V)在元素周期表中的位置为 ,其价层电子排布图为___________________。
(3)基态Ni原子的电子排布式为________,该元素位于元素周期表中的第________族。
(4)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用________形象化描述。在基态14C原子中,核外存在________对自旋相反的电子。
(5)A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。四种元素中电负性最大的是________(填元素符号),其中C原子的核外电子排布式为________________。
【答案】(1)1s22s22p63s23p63d3或[Ar]3d3
(2)第四周期ⅤB族
(3)1s22s22p63s23p63d84s2或[Ar]3d84s2 Ⅷ
(4)电子云 2
(5)O 1s22s22p63s23p3或[Ne]3s23p3
【解析】(1)基态Cr原子核外电子排布式为1s22s22p63s23p63d54s1,失去4s轨道的1个电子和3d轨道上的2个电子得到Cr3+,故Cr3+基态核外电子排布式为1s22s22p63s23p63d3或[Ar]3d3。
(2)钒(23V)的原子序数为23,位于周期表中第四周期ⅤB族,价层电子排布式为3d34s2,价层电子排布图为。
(3)基态Ni原子的核外有28个电子,电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2,位于元素周期表第Ⅷ族。
(4)基态14C原子核外电子排布式为1s22s22p2,1s、2s轨道各存在1对自旋相反的电子,2p轨道上的2个电子自旋方向相同。
(5)C核外电子总数是最外层电子数的3倍,则C可能是Li或P,由于A、B、C、D的原子序数依次增大,则C应为P元素;D元素最外层有一个未成对电子,则D为Cl元素。A2-和B+的电子层结构相同,则A为O元素,B为Na元素。根据周期表中同周期(或主族)元素电负性变化规律可知,电负性:O>Cl>P>Na,故电负性最大的是O元素。C(P)原子核外有15个电子,核外电子排布式为1s22s22p63s23p3或[Ne]3s23p3。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
