1.3.1氧化还原反应 课件(共33张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.1氧化还原反应 课件(共33张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-24 21:45:56 | ||
图片预览










文档简介
(共33张PPT)
第一章 物质的分类及其变化
第三节 氧化还原反应
第1课时 氧化还原反应
银针试毒的原理:
4Ag+O2+2H2S===2Ag2S+2H2O
银白色 黑色
1774年,法国化学家拉瓦锡提出燃烧的氧化学说,使人们从得失氧的角度认识氧化反应、还原反应。随着科技的进步,化合价概念的提出,电子的发现,科学家对氧化还原反应有了更完善、更全面的认识。
目录
电子转移表示法
02
认识氧化还原反应
01
四种基本反应类型与氧化还原反应的关系
03
从化合价变化和电子转移的角度认识判断氧化还原反应,掌握氧化还原反应的概念、本质、特点、判断依据。
掌握表示电子转移的方法。
01
02
掌握氧化还原反应与四种基本反应类型之间的关系。
03
习
学
目
标
NO.1
多角度认识
氧化还原反应
①2Na+Cl2 = 2NaCl ②Zn+CuSO4 = ZnSO4+Cu
③ 2H2O2 = 2H2O+O2↑ ④H2CO3 = CO2+H2O
⑤NaOH+HCl =NaCl+H2O ⑥NaCl+AgNO3 = AgCl↓+ NaNO3
⑦2CuO+ C = 2Cu+CO2↑ ⑧NH3+H2O==NH3·H2O
请对下列化学反应进行分类:
1.按照四大基本反应类型分类
2.按照是否有化合价的变化分类
1. 化合反应①⑧;分解反应:③④;置换反应:②⑦;复分解反应:⑤⑥
2.以化合价是否发生变化为标准划分:
变化:①②③⑦;不变:④⑤⑥⑧
思考与交流
认识氧化还原反应
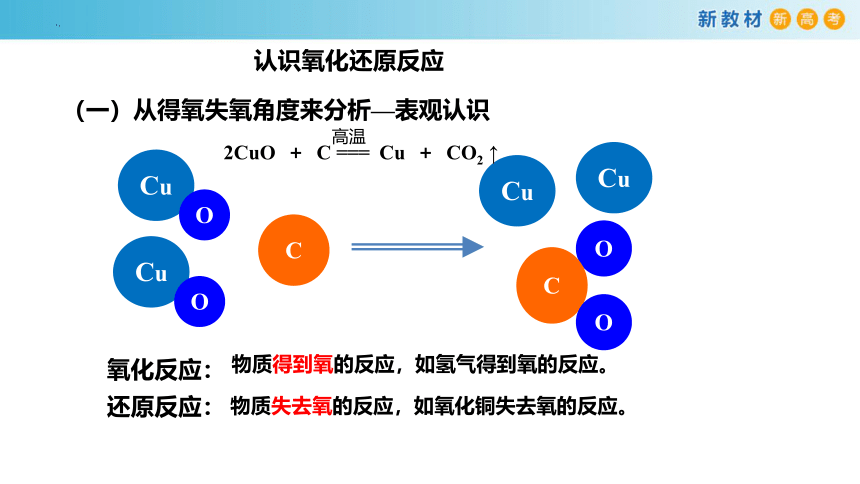
(一)从得氧失氧角度来分析—表观认识
Cu
C
O
C
Cu
O
物质得到氧的反应,如氢气得到氧的反应。
物质失去氧的反应,如氧化铜失去氧的反应。
氧化反应:
还原反应:
Cu
O
Cu
O
2CuO + C === Cu + CO2 ↑
高温
CuO + H2 Cu + H2O
高温
失去氧,被还原,发生还原反应
得到氧,被氧化,发生氧化反应
H2O + C H2 + CO
高温
失去氧,被还原,发生还原反应
得到氧,被氧化,发生氧化反应
思考与交流
认识氧化还原反应
问题探究1:氧化反应和还原反应是分别独立进行的吗?
氧化反应和还原反应是同时发生!
很大一部分化学反应都没有涉及到得失氧,
那么这类反应都不是氧化还原反应吗?
比如:
Fe+CuSO4=FeSO4+Cu
Zn + 2HCl = ZnCl2 + H2
NaOH + HCl = NaCl + H2O
问题探究2:怎样判断一个反应是不是氧化还原反应?
思考与交流
老人
公主
旋转180°?
对于同一事物,如果我们换一个认识视角,就可能有新发现,科学研究常常如此。
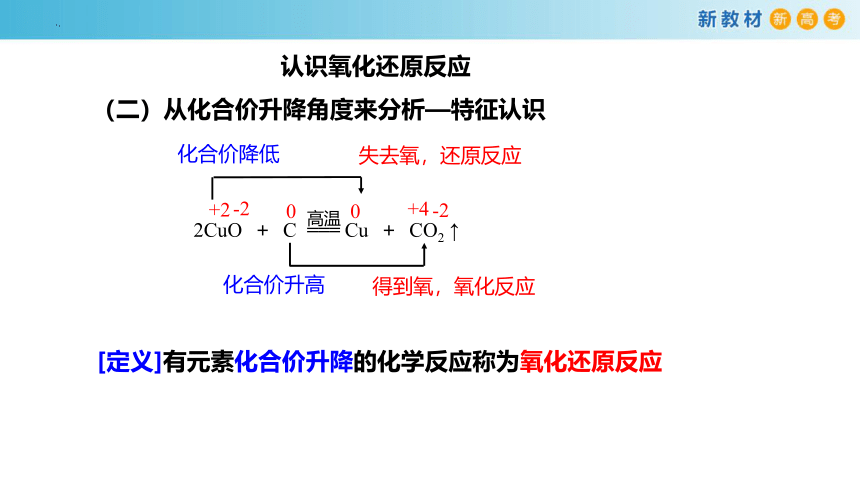
得到氧,氧化反应
失去氧,还原反应
+2
-2
0
0
+4
-2
化合价升高
化合价降低
(二)从化合价升降角度来分析—特征认识
[定义]有元素化合价升降的化学反应称为氧化还原反应
2CuO + C === Cu + CO2 ↑
高温
认识氧化还原反应
判断以下反应是否是氧化还原反应
Fe + CuSO4 === FeSO4 + Cu
Zn + 2HCl === ZnCl2 + H2↑
+2
0
+2
0
+6
-2
+6
-2
0
0
+2
+1
-1
-1
是
是
化合价升高,氧化反应
化合价升高,氧化反应
化合价降低,还原反应
化合价降低,还原反应
2H2O2 === 2H2O + O2↑
-1
-2
0
化合价升高,氧化反应
化合价降低,还原反应
是
NaOH + HCl === NaCl + H2O
-1
-1
+1
+1
+1
+1
+1
-2
-2
不是
课堂检测
从元素化合价的升降观点认识(特征)
化学反应
氧化还原反应
非氧化还原反应
★以元素化合价是否变化对化学反应进行分类:
元素化合价
是否变化
元素化合
价变化
元素化合
价无变化
4Ag+O2+2H2S===2Ag2S+2H2O
0
+1
0
-2
化合价升高,被氧化
化合价降低,被还原
在古代,由于生产技术落后,致使砒霜(三氧化二砷)中伴有少量的硫和硫化物,所以可以用银针验毒。
Cu
Zn
稀硫酸
化合价的变化是不是跟电子的转移有关呢?
导线中有电子通过
Zn+H2SO4=ZnSO4+H2↑
氧化还原反应
本质
电子转移
微观探析,理解本质
化合价升高
2Na + Cl2 === 2NaCl
化合价降低
化合价的升降与电子转移的关系,氧化还原反应的实质是什么?
+1
-1
0
0
元素为什么会发生化合价变化?化合价的升降是什么原因引起的?
H2 + Cl2 === 2HCl
0
0
+1
-1
化合价升高
化合价降低
思考与交流
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
化合物NaCl的形成过程
失2×e-,化合价升高,被氧化
得2×e-,化合价降低,被还原
0 0 +1 -1
2Na + Cl2 = 2NaCl
化合价的升降
实质
电子的得失
H Cl
+17
+1
+1
+17
H Cl
+1 -1
H
Cl
HCl
化合物HCl的形成过程
电子对偏离,化合价升高,被氧化
电子对偏向,化合价降低,被还原
2H2 + Cl2 = 2HCl
0 0 +1 -1
化合价的升降
实质
共用电子对的偏移
(本质) (特征)
某元素得到电子(或电子对偏向)
化合价降低
还原反应
某元素失去电子(或电子对偏离)
化合价升高
氧化反应
升---失---氧化
降---得---还原
氧化还原反应的实质
有电子转移(得失或偏移)的反应都是氧化还原反应。
总结
1.完成下列填空:
(1)C+H2O(g) CO+H2中发生氧化反应的物质是__,被还原的元素是___。
(2)2KClO3 2KCl+3O2↑中被氧化的元素是___,被还原的元素是___。
(3)2H2S+SO2===3S+2H2O中被还原的物质是______,被氧化的物质是_____,被氧化的元素是__,被还原的元素是__。
C
H
O
Cl
SO2
H2S
S
S
课堂检测
2.判断正误
(1)氧化还原反应中所有元素的化合价一定都发生变化( )
(2)一个反应中可以只有元素化合价升高,而无元素化合价降低( )
(3)氧化还原反应中被氧化的物质与被还原的物质可以是同一种物质( )
(4)有单质参加的反应一定是氧化还原反应( )
×
×
×
√
我们能否方便直观的显示出氧化还原反应中的电子转移情况呢?
思考与交流
NO.2
氧化还原反应中
电子转移的表示方法
1.双线桥法
得失电子是守恒的
+3 0 0 +1
得到2×3e-
失去6×e-
(1)书写步骤:
标价态→
连双线→
注得失
(2)注意事项:
(3)应用:体现“谁变谁”,用于分析
“剂” 与“产物” 关系及配平。
①箭头、箭尾对应化合价变化的同种元素。
②必须注明“得到”或“失去”的字样。
③失去电子总数与得到电子总数相等。
得电子总数=失电子总数=电子转移数目=变价原子数*化合价变化数
①MnO2+4HCl === MnCl2+Cl2↑+2H2O
②Cl2+2NaOH === NaCl+NaClO+H2O
失1×e-
得1×e-
表示氧化还原反应中的电子转移情况还有一种更简单的方法!
失2×e-
得1×2e-
△
用双线桥法标出下列反应电子转移的方向和数目:
课堂检测
2.单线桥法
表示反应过程中 原子间的电子转移情况。
不同元素
只标明电子转移总数, ,不标“得、失”
6e-
(1)书写步骤:
标价态→
连单线→
标电子
(2)注意事项:
(3)应用:体现“谁给谁”,便于分析电子转移方向和数目
始于还原剂中价升高的元素,止于氧化剂中价降低的元素
箭头指向价降低的元素
课堂检测
标出变价元素的化合价,用双线桥法标出电子转移情况,其中②④同时用单线桥法标出电子转移情况。
答案
答案
③Cl2+2NaOH===NaCl+NaClO+H2O
答案
④2H2S+SO2===3S+2H2O
答案
两种“线桥”的比较
(1)双线桥法的“线桥”从反应物到产物,单线桥法的“线桥”只连反应物。
(2)表示氧化还原反应中化合价升降、物质被氧化或被还原等时,用双线桥法较方便;表示电子转移的方向和数目时,用单线桥法较方便。
NO.3
氧化还原反应与四种
基本反应类型的关系
请你判断下列10个反应中,分别属于四种基本反应类型中的哪一种,并判断他们是否属于氧化还原反应
①2Na+Cl2 === 2NaCl ②Fe+CuSO4 === FeSO4+Cu
③2HgO === 2Hg+O2↑ ④NH4NO3 === N2O↑+2H2O
⑤CaO+H2O === CaCO3 ⑥3Fe+2O2 === Fe3O4
⑦BaCl2+H2SO4 === BaSO4↓+2HCl ⑧CaCO3 === CaO+CO2↑
⑨Fe+2HCl === FeCl2+H2↑ ⑩2NaOH+CuSO4 === Cu(OH)2↓+Na2SO4
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
请用不同的图示表示氧化还原反应与四种基本反应类型的关系
交叉分类图
“泳池式”集合图
“脸谱式”集合图
小结
定义
表示电子转移的方法
特征
氧化反应和还原反应同时发生的反应
四种基本反映类型与氧化还原反应的关系
本质
元素的化合价在反应前后发生变化
电子的转移(得失或偏移)
单线桥法
双线桥法
第一章 物质的分类及其变化
第三节 氧化还原反应
第1课时 氧化还原反应
银针试毒的原理:
4Ag+O2+2H2S===2Ag2S+2H2O
银白色 黑色
1774年,法国化学家拉瓦锡提出燃烧的氧化学说,使人们从得失氧的角度认识氧化反应、还原反应。随着科技的进步,化合价概念的提出,电子的发现,科学家对氧化还原反应有了更完善、更全面的认识。
目录
电子转移表示法
02
认识氧化还原反应
01
四种基本反应类型与氧化还原反应的关系
03
从化合价变化和电子转移的角度认识判断氧化还原反应,掌握氧化还原反应的概念、本质、特点、判断依据。
掌握表示电子转移的方法。
01
02
掌握氧化还原反应与四种基本反应类型之间的关系。
03
习
学
目
标
NO.1
多角度认识
氧化还原反应
①2Na+Cl2 = 2NaCl ②Zn+CuSO4 = ZnSO4+Cu
③ 2H2O2 = 2H2O+O2↑ ④H2CO3 = CO2+H2O
⑤NaOH+HCl =NaCl+H2O ⑥NaCl+AgNO3 = AgCl↓+ NaNO3
⑦2CuO+ C = 2Cu+CO2↑ ⑧NH3+H2O==NH3·H2O
请对下列化学反应进行分类:
1.按照四大基本反应类型分类
2.按照是否有化合价的变化分类
1. 化合反应①⑧;分解反应:③④;置换反应:②⑦;复分解反应:⑤⑥
2.以化合价是否发生变化为标准划分:
变化:①②③⑦;不变:④⑤⑥⑧
思考与交流
认识氧化还原反应
(一)从得氧失氧角度来分析—表观认识
Cu
C
O
C
Cu
O
物质得到氧的反应,如氢气得到氧的反应。
物质失去氧的反应,如氧化铜失去氧的反应。
氧化反应:
还原反应:
Cu
O
Cu
O
2CuO + C === Cu + CO2 ↑
高温
CuO + H2 Cu + H2O
高温
失去氧,被还原,发生还原反应
得到氧,被氧化,发生氧化反应
H2O + C H2 + CO
高温
失去氧,被还原,发生还原反应
得到氧,被氧化,发生氧化反应
思考与交流
认识氧化还原反应
问题探究1:氧化反应和还原反应是分别独立进行的吗?
氧化反应和还原反应是同时发生!
很大一部分化学反应都没有涉及到得失氧,
那么这类反应都不是氧化还原反应吗?
比如:
Fe+CuSO4=FeSO4+Cu
Zn + 2HCl = ZnCl2 + H2
NaOH + HCl = NaCl + H2O
问题探究2:怎样判断一个反应是不是氧化还原反应?
思考与交流
老人
公主
旋转180°?
对于同一事物,如果我们换一个认识视角,就可能有新发现,科学研究常常如此。
得到氧,氧化反应
失去氧,还原反应
+2
-2
0
0
+4
-2
化合价升高
化合价降低
(二)从化合价升降角度来分析—特征认识
[定义]有元素化合价升降的化学反应称为氧化还原反应
2CuO + C === Cu + CO2 ↑
高温
认识氧化还原反应
判断以下反应是否是氧化还原反应
Fe + CuSO4 === FeSO4 + Cu
Zn + 2HCl === ZnCl2 + H2↑
+2
0
+2
0
+6
-2
+6
-2
0
0
+2
+1
-1
-1
是
是
化合价升高,氧化反应
化合价升高,氧化反应
化合价降低,还原反应
化合价降低,还原反应
2H2O2 === 2H2O + O2↑
-1
-2
0
化合价升高,氧化反应
化合价降低,还原反应
是
NaOH + HCl === NaCl + H2O
-1
-1
+1
+1
+1
+1
+1
-2
-2
不是
课堂检测
从元素化合价的升降观点认识(特征)
化学反应
氧化还原反应
非氧化还原反应
★以元素化合价是否变化对化学反应进行分类:
元素化合价
是否变化
元素化合
价变化
元素化合
价无变化
4Ag+O2+2H2S===2Ag2S+2H2O
0
+1
0
-2
化合价升高,被氧化
化合价降低,被还原
在古代,由于生产技术落后,致使砒霜(三氧化二砷)中伴有少量的硫和硫化物,所以可以用银针验毒。
Cu
Zn
稀硫酸
化合价的变化是不是跟电子的转移有关呢?
导线中有电子通过
Zn+H2SO4=ZnSO4+H2↑
氧化还原反应
本质
电子转移
微观探析,理解本质
化合价升高
2Na + Cl2 === 2NaCl
化合价降低
化合价的升降与电子转移的关系,氧化还原反应的实质是什么?
+1
-1
0
0
元素为什么会发生化合价变化?化合价的升降是什么原因引起的?
H2 + Cl2 === 2HCl
0
0
+1
-1
化合价升高
化合价降低
思考与交流
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
化合物NaCl的形成过程
失2×e-,化合价升高,被氧化
得2×e-,化合价降低,被还原
0 0 +1 -1
2Na + Cl2 = 2NaCl
化合价的升降
实质
电子的得失
H Cl
+17
+1
+1
+17
H Cl
+1 -1
H
Cl
HCl
化合物HCl的形成过程
电子对偏离,化合价升高,被氧化
电子对偏向,化合价降低,被还原
2H2 + Cl2 = 2HCl
0 0 +1 -1
化合价的升降
实质
共用电子对的偏移
(本质) (特征)
某元素得到电子(或电子对偏向)
化合价降低
还原反应
某元素失去电子(或电子对偏离)
化合价升高
氧化反应
升---失---氧化
降---得---还原
氧化还原反应的实质
有电子转移(得失或偏移)的反应都是氧化还原反应。
总结
1.完成下列填空:
(1)C+H2O(g) CO+H2中发生氧化反应的物质是__,被还原的元素是___。
(2)2KClO3 2KCl+3O2↑中被氧化的元素是___,被还原的元素是___。
(3)2H2S+SO2===3S+2H2O中被还原的物质是______,被氧化的物质是_____,被氧化的元素是__,被还原的元素是__。
C
H
O
Cl
SO2
H2S
S
S
课堂检测
2.判断正误
(1)氧化还原反应中所有元素的化合价一定都发生变化( )
(2)一个反应中可以只有元素化合价升高,而无元素化合价降低( )
(3)氧化还原反应中被氧化的物质与被还原的物质可以是同一种物质( )
(4)有单质参加的反应一定是氧化还原反应( )
×
×
×
√
我们能否方便直观的显示出氧化还原反应中的电子转移情况呢?
思考与交流
NO.2
氧化还原反应中
电子转移的表示方法
1.双线桥法
得失电子是守恒的
+3 0 0 +1
得到2×3e-
失去6×e-
(1)书写步骤:
标价态→
连双线→
注得失
(2)注意事项:
(3)应用:体现“谁变谁”,用于分析
“剂” 与“产物” 关系及配平。
①箭头、箭尾对应化合价变化的同种元素。
②必须注明“得到”或“失去”的字样。
③失去电子总数与得到电子总数相等。
得电子总数=失电子总数=电子转移数目=变价原子数*化合价变化数
①MnO2+4HCl === MnCl2+Cl2↑+2H2O
②Cl2+2NaOH === NaCl+NaClO+H2O
失1×e-
得1×e-
表示氧化还原反应中的电子转移情况还有一种更简单的方法!
失2×e-
得1×2e-
△
用双线桥法标出下列反应电子转移的方向和数目:
课堂检测
2.单线桥法
表示反应过程中 原子间的电子转移情况。
不同元素
只标明电子转移总数, ,不标“得、失”
6e-
(1)书写步骤:
标价态→
连单线→
标电子
(2)注意事项:
(3)应用:体现“谁给谁”,便于分析电子转移方向和数目
始于还原剂中价升高的元素,止于氧化剂中价降低的元素
箭头指向价降低的元素
课堂检测
标出变价元素的化合价,用双线桥法标出电子转移情况,其中②④同时用单线桥法标出电子转移情况。
答案
答案
③Cl2+2NaOH===NaCl+NaClO+H2O
答案
④2H2S+SO2===3S+2H2O
答案
两种“线桥”的比较
(1)双线桥法的“线桥”从反应物到产物,单线桥法的“线桥”只连反应物。
(2)表示氧化还原反应中化合价升降、物质被氧化或被还原等时,用双线桥法较方便;表示电子转移的方向和数目时,用单线桥法较方便。
NO.3
氧化还原反应与四种
基本反应类型的关系
请你判断下列10个反应中,分别属于四种基本反应类型中的哪一种,并判断他们是否属于氧化还原反应
①2Na+Cl2 === 2NaCl ②Fe+CuSO4 === FeSO4+Cu
③2HgO === 2Hg+O2↑ ④NH4NO3 === N2O↑+2H2O
⑤CaO+H2O === CaCO3 ⑥3Fe+2O2 === Fe3O4
⑦BaCl2+H2SO4 === BaSO4↓+2HCl ⑧CaCO3 === CaO+CO2↑
⑨Fe+2HCl === FeCl2+H2↑ ⑩2NaOH+CuSO4 === Cu(OH)2↓+Na2SO4
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
请用不同的图示表示氧化还原反应与四种基本反应类型的关系
交叉分类图
“泳池式”集合图
“脸谱式”集合图
小结
定义
表示电子转移的方法
特征
氧化反应和还原反应同时发生的反应
四种基本反映类型与氧化还原反应的关系
本质
元素的化合价在反应前后发生变化
电子的转移(得失或偏移)
单线桥法
双线桥法
