浙教版初三科学《2.5物质的转化》课后练习
文档属性
| 名称 | 浙教版初三科学《2.5物质的转化》课后练习 |  | |
| 格式 | doc | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-07-25 09:15:06 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
浙教版初三科学《2.5物质的转化》课后练习
一、单选题
1.分离、提纯、除杂、鉴别是基本的实验技能。下列实验设计能达到实验目的的组别是( )
组别 实验目的 实验设计
A 除去FeCl3溶液中混有的少量CuCl2 加入过量的铁粉,过滤
B 分离铜粉和镁粉的混合物 加入足量的稀HCl,过滤、洗涤、干燥
C 提纯混有少量Ca(OH)2的NaOH溶液 加入过量的Na2CO3溶液,振荡、静置、过滤
D 鉴别Na2CO3、BaCl2、NaCl溶液 取样后,分别滴加稀H2SO4溶液,观察现象
A.A B.B C.C D.D
2.初中科学实验中,有许多涉及操作上的“先”与“后”的问题,如果把“先”与“后”顺序颠倒,就会影响实验效果或导致事故的发生。下列实验操作中“先”“后”顺序正确的是( )
A.实验室用过氧化氢溶液制取氧气时,应先加入过氧化氢溶液,再加入二氧化锰
B.测未知溶液pH值,应先将pH试纸浸入待测溶液中,再与标准比色卡比较
C.浓硫酸不慎溅到皮肤上,要先用大量清水冲洗,后用干布擦干,最后涂抹小苏打
D.用氢气还原氧化铜时,应先通一段时间的氢气,后点燃酒精灯进行实验
3.下列实验方案不能达到实验目的的是( )
实验目的 实验方案
A 验证溶液中是否有银离子 取样先加入氯化钡溶液再加入稀硝酸
B 鉴别NaOH溶液和Ca(OH)2溶液 分别滴入Na2CO3溶液,
C 防止铁制品生锈 喷漆等方法使它隔绝水和氧气
D 检验溶液中是否含有葡萄糖 用新制的氢氧化铜悬浊液混合受热,观察是否有砖红色沉淀产生
A.A B.B C.C D.D
废铜的回收利用意义重大,我国提出废铜回收率要达到70%的目标。小明设计如下的实验回收含铜垃圾。
4.实验步骤②,也可以用一氧化碳代替氢气,由此推测一氧化碳具有( )
A.导热性 B.氧化性 C.导电性 D.还原性
5.物质的性质决定用途。在上述流程中稀硫酸、铁屑的性质和对应的用途描述都正确的是( )
物质 性质 用途
A 稀硫酸 能与一些金属反应 将铜转化为可溶的硫酸铜
B 稀硫酸 能与某些金属氧化物反应 将氧化铜转化为可溶的硫酸铜
C 铁屑 金属活动性比铜弱 置换硫酸铜中的铜
D 铁屑 密度比铜小 置换硫酸铜中的铜
A.A B.B C.C D.D
6.把三种无色气体组成的混合气体A,依次通过如图所示的连续装置:各装置内的现象是:B:出现白色浑浊,D:生成红色物质,E:白色变蓝,F:出现沉淀。根据上述现象可以判断在以下气体组成中,最可能是混合气体A的是( )
A.CO2、H2、O2 B.N2、CO、H2 C.CO2、CO、O2 D.CO2、H2、CO
7.春秋初期,绍兴一带是南方的一个冶铁中心,其炼铁方法是在1000℃左右的温度下,使木炭和赤铁矿(主要成分为Fe2O3)发生一系列的反应生成含较多杂质的海绵铁。其中主要化学反应为:3CO+Fe2O32Fe+3CO2。下列说法正确的是( )
A.海绵铁是一种纯净物 B.Fe2O3中铁元素的化合价为+3价
C.上述反应中涉及的氧化物只有2种
D.炼铁过程中,木炭只是作为燃料使用
8.如图为CO还原CuO“微型”实验装置(夹持仪器等略),已知:HCOOHH2O+CO,下列说法错误的是( )
A.实验中所需CO可现制现用
B.此装置可节约用品,污染小,现象明显
C.本实验中可以观察到黑色固体变红,澄清石灰水变浑浊
D.该实验中CO是还原剂,发生了还原反应
9.下列实验设计能达到实验目的是( )
选项 实验目的 实验设计
A 鉴别硝酸钾和碳酸钾 加入稀盐酸,观察现象
B 鉴别氮气和二氧化碳 分别伸入燃烧木条,观察现象
C 鉴别硝酸钾和氯化钠 加水,观察是否溶解
D 鉴别稀硫酸、硫酸钠 加无色酚酞溶液,观察现象
A.A B.B C.C D.D
二、填空题
10.为了确定某含杂质的硝酸钠溶液中所含杂质的成分,某同学设计了如下实验:请回答下列问题:
(1)Ⅰ、Ⅱ为 操作。
(2)经分析,原溶液中的杂质可能由一种或两种物质组成。杂质的成分可能是:
①若原溶液中的杂质由一种物质组成,则该杂质是 ;(填物质的名称)
②若原溶液中的杂质由两种物质组成,则该杂质的成分组成可能有 种情况(填数字)。
11.现有4包白色粉未,编号为A、B、C、D,他们是硫酸铜、氯化钠、硝酸钾、氢氧化钠,通过下列实验,一一加以鉴别。
(1)确定B是硫酸铜,该试管中看到的现象是 。
(2)酚酞滴入A溶液中变红色,则A的化学式是 。
(3)将 C、D 鉴别出来,“ ”代表的试剂是 。
12.如图,给出了三种物质可能存在的转化关系,根据所学的物质性质及化学变化规律,回答下列问题:
(1)实现③转化,可以加入 溶液(填化学式)。
(2)写出实现⑥转化的化学方程式 。
(3)不能一步实现转化的是 (填序号)。
13.某碳酸钠样品中可能含有碳酸钾、氯化钠、硫酸钠、氯化钡、碳酸钙中的一种或几种杂质,科 学兴趣小组同学对碳酸钠样品中杂质的成分进行了如下探究:
步骤1:取少量该样品于烧杯中,加入足量水充分溶解后过滤,得到白色沉淀和无色滤液;
步骤2:向步骤1所得白色沉淀中加入足量的稀硝酸,部分沉淀溶解并产生气体;
步骤3:另取10.6g该样品加入200g稀盐酸,恰好完全反应,生成4.4g二氧化碳。
结合以上探究过程,回答下列问题:
(1)通过步骤1和步骤2可得出杂质中一定含有
(2)该样品的组成最多有. 种情况。
14.某白色固体中可能含有氯化钠、碳酸钠、硫酸钠、硫酸铜、碳酸钡、氯化钡中的几种物质,为了鉴定该白色固体的组成,拓展性学习小组的同学们进行可如下探究实验:
Ⅰ.称取14克固体于烧杯中,加入足量水充分溶解,过滤得到白色沉淀8.6克和无色溶液。
Ⅱ.中所得8.6克白色沉淀中加入足量稀盐酸,沉淀部分溶解并有无色气体产生,测得剩余白色沉淀质量为4.66克。
Ⅲ.把I中所得滤液分成两份,第一份溶液中加入足量的稀硫酸,既没有产生气泡,也没有产生沉淀,第二份溶液中加入足量的氯化钡溶液,没有产生沉淀。
根据上述实验,回答下列问题:
(1)根据以上实验现象 , 白色固体中一定含有的物质是 ;
(2)仅根据第Ⅲ步实验现象可以得出结论 ,溶液中一定不存在的离子是 。
三、实验探究题
15.小乐利用“氢气还原氧化铜”实验验证水的组成,实验装置及药品如图所示,实验前后测定的数据如表所示。回答问题:
实验前 实验后
硬质玻璃管及其内药品的质量/克 75.6 69.2
U形管及其内药品的质量/克 110.8 118.2
(1)为了实验安全,在开始加热硬质玻璃管内氧化铜前,应先进行的实验操作是 。
(2)实验中观察到硬质玻璃管中黑色粉末逐渐变红,则发生反应的化学方程式为 。
(3)验证水的组成的原理为:根据硬质玻璃管及其内药品在反应前后的质量差m1,U形管及其内药品在反应前后的质量差m2,可计算出水中氢、氧元素的质量比为 (用m1、m2等表示)。若实验过程中小乐操作无误,依据实验数据,分析产生误差的可能原因 (写出1点)。
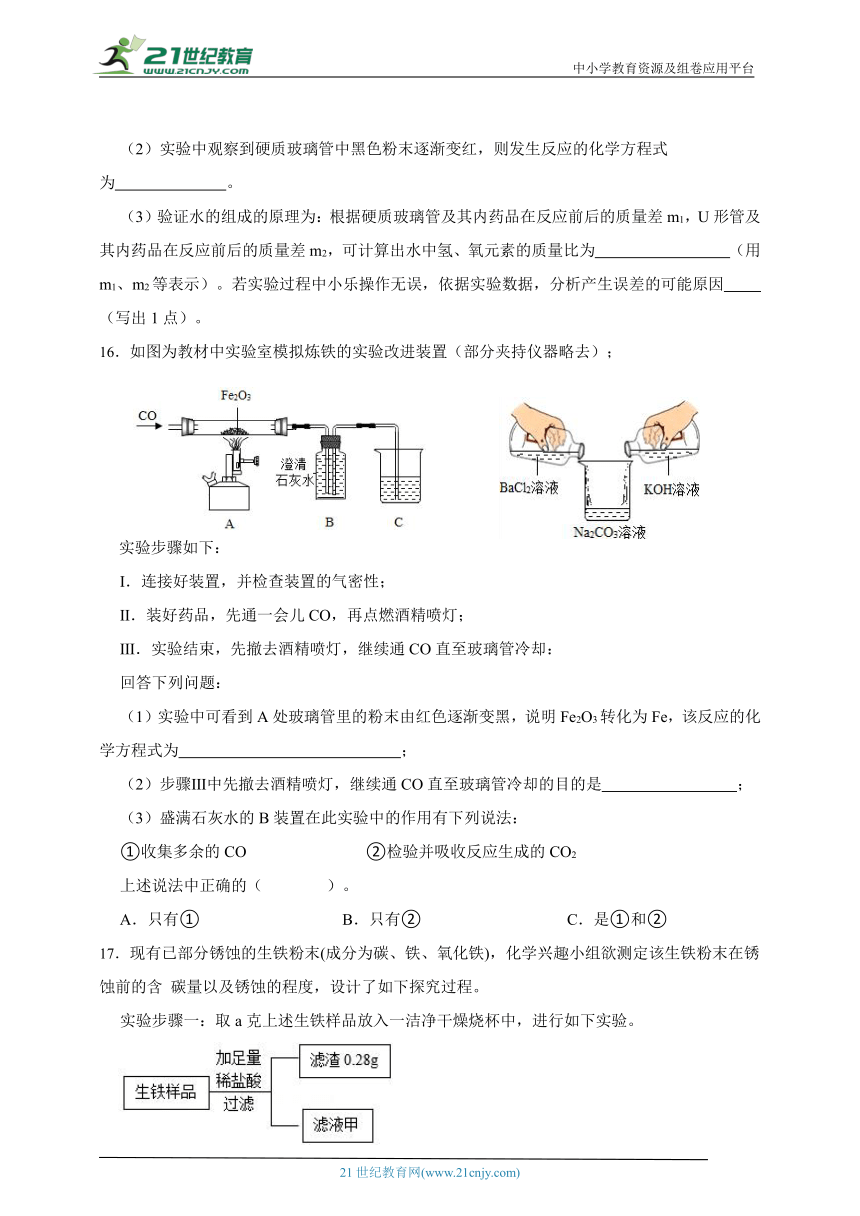
16.如图为教材中实验室模拟炼铁的实验改进装置(部分夹持仪器略去);
实验步骤如下:
Ⅰ.连接好装置,并检查装置的气密性;
Ⅱ.装好药品,先通一会儿CO,再点燃酒精喷灯;
Ⅲ.实验结束,先撤去酒精喷灯,继续通CO直至玻璃管冷却:
回答下列问题:
(1)实验中可看到A处玻璃管里的粉末由红色逐渐变黑,说明Fe2O3转化为Fe,该反应的化学方程式为 ;
(2)步骤Ⅲ中先撤去酒精喷灯,继续通CO直至玻璃管冷却的目的是 ;
(3)盛满石灰水的B装置在此实验中的作用有下列说法:
①收集多余的CO ②检验并吸收反应生成的CO2
上述说法中正确的( )。
A.只有① B.只有② C.是①和②
17.现有已部分锈蚀的生铁粉末(成分为碳、铁、氧化铁),化学兴趣小组欲测定该生铁粉末在锈蚀前的含 碳量以及锈蚀的程度,设计了如下探究过程。
实验步骤一:取a克上述生铁样品放入一洁净干燥烧杯中,进行如下实验。
(实验中所得滤渣是用蒸馏水洗涤、干燥后再进行称量。)
实验步骤二:另取a克该生铁样品,进行如图所示实验,实验装置气密性良好。
A装置瓶中盛放的试剂是浓硫酸。实验结束后,C装置内浓硫酸的质量增加了0.54克。
实验步骤三:小组同学取实验步骤二中B装置硬质玻璃管内反应后所得全部黑色粉末进行了如下实验,所用装置和滤渣已略去。
(1)通过以上实验可得出,生铁中已锈蚀的铁的质量是 g。有同学认为,由上述实验得出的已锈 蚀的铁的质量可能存在误差,理由是 。
(2)实验小组取部分滤液乙于烧杯中,加入一定质量的镁粉,充分反应后过滤。将滤渣洗涤、干燥,所得 滤渣的质量与加入钱粉的质量相等,则所取滤液乙中参加反应的两种溶质的质量比是 (填最简整数比)。
18.工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4。
(查阅资料)草酸晶体(H2C2O4 3H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O4 3H2OCO2↑+CO↑+4H2O
碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。为了测定铁红中铁的质量
分数,小组同学进行如下实验。(装置气密性良好,尾气处理装置未画出。)
(1)该实验为保证进入 E 中的气体是纯净、干燥的 CO,则 B,C,D 中的试剂依次是 (填字母序号)
a.浓硫酸 b.澄清的石灰水
c.氢氧化钠溶液
(2)对 E 装置加热后,要继续通入过量的 CO,除了可以防止空气中的氧气再次将铁氧化, 其它作用是:
(3)称取铁红样品 10.0g,用上述装置进行实验,测定铁红中铁的质量分数。若实验前后称 得 F 装置增重
8.8g,则此铁红中铁的质量分数是
(4)如果缺少G 装置 (不考虑其他因素),则测得样品中铁的质量分数会 (选填“偏小”“不变”“偏大”)
19.如图所示是氢气和氧化铜反应的实验装置图。请分析回答:
(1)实验开始时,合理的操作顺序是 (选填“A”或“B”);
A先加热,再通氢气 B先通氢气,再加热
(2)在实验过程中看到的现象是 ,同时试管口有水珠出现,说明氢气具有 性。
(3)铜在空气中加热很容易氧化变成氧化铜,为了避免这样的情况出现,在实验结束 时要注意的操作是:
四、解答题
20.同学们用石灰石和稀盐酸制取CO2后,用废液缸收集了残留的废液(石灰石所含杂质不与酸反应且不溶于水)。小科想探究废液中溶质的组成,进行了如下实验。
①向少量废液中滴加石蕊试液,试液变红色。
②向10mL废液中滴加Na2CO3溶液,测得沉淀总质量与加入的Na2CO3溶液总质量的关系如下表所示:
第一次测量 第二次测量 第三次测量 第四次测量
加入Na2CO3溶液的总质量/g 10 20 30 40
生成沉淀总质量/g a 0.5 1.5 2
(1)实验室制取CO2后,废液中的溶质是 ( 填化学式)。
(2)表格中a= 。
(3)另取10mL废液置于通风橱充分加热蒸发,计算可得固体质量多少克?
(4)第三次测量后,再加入质量为m(m<10g)的Na2CO3溶液,则生成沉淀的总质量可能为 (要求答出所有的可能性)。
21.某化肥厂以“钾泻盐”(MgSO4·KCl·nH2O)为原料制造高质量钾肥,化肥中KCl含量的高低会直接影响着化肥的品质。某兴趣小组为了测定“钾泻盐”中KCl的质量分数及n的值,设计了如下两种实验方案:
试可答下列问题:
(1)加入足量AgNO3溶液后,方案二中生成固体的成量大于方案一,原为是方案二中所得28.7克固体物质中除生成了 外,还生成了微溶的Ag2SO4;
(2)方案一中,滴加足量的Ba(NO3)2溶液,过滤后所得滤液中除可能含有Ba(NO)3外,一定含有的溶质是 ;
(3)该钾泻盐样品中KCl的质量分数为多少 (精确到1%)
(4)该钾泻盐化学式中n的值是多少 (要写出计算过程)
答案部分
1.【答案】D
2.【答案】D
3.【答案】A
4.【答案】D
5.【答案】B
6.【答案】D
7.【答案】B
8.【答案】D
9.【答案】A
10.【答案】(1)过滤
(2)氯化钙;(氯化钙和氯化钠,氯化钙和硝酸钙,氯化钠和硝酸钙3种组
11.【答案】(1)溶液呈蓝色
(2)NaOH
(3)硝酸银(Ag(NO3))溶液
12.【答案】(1)NaOH
(2)Ca(OH)2+Na2CO3═CaCO3↓+2NaOH(合理即可)
(3)①②
13.【答案】(1)氯化钡和硫酸钠
(2)4(或四)
14.【答案】(1)NaCl、BaCl2、Na2SO4
(2)CO32-、SO42-、Ba2+
15.【答案】(1)通一段时间的氢气
(2)CuO+H2=Cu+H2O
(3)(m2-m1):m1;U形管中的碱石灰吸收了空气中的水和二氧化碳
16.【答案】(1)Fe2O3+3CO 高温 2Fe+3CO2
(2)防止生成的铁被空气中的氧气再次被氧化
(3)C
17.【答案】(1)1.12;碳具有还原性,可能在步骤二中与氧化铁反应
(2)57:49或49:57
18.【答案】(1)cba
(2)驱赶装置滞留的二氧化碳,保证被碱石灰完全吸收
(3)68%
(4)偏小
19.【答案】(1)B
(2)黑色粉末变红色;还原性
(3)熄灭酒精灯后,继续通氢气,直至试管冷却至室温
20.【答案】(1)CaCl2、HCl
(2)0
(3)解:将10mL废液加热蒸发,溶液中的HCl挥发,最后得到的固体为CaCl2。
设:10mL废液中CaCl2质量为x
Na2CO3+ CaCl2=2NaCl+ CaCO3↓
111 100
x 2g
得:x=2.22g
答:将10mL废液蒸发,可得固体质量2.22g
(4)当m<5g时,沉淀质量为1.5g+0.1m;当5g≤m<10g时,沉淀质量为2g。
21.【答案】(1)AgCl
(2)KCl和Mg(NO3)2
(3)
KCl+AgNO3= AgCl+KNO3
74.5 143.5
x 14.35g
x=7.45g
该钾泻盐样品中KCl的质量分数= ×100%≈30%
答:该钾泻盐样品中KCl的质量分数为30%。
(4)解:设样品中硫酸镁的质量为y
MgSO4+Ba(NO3)2= BaSO4+Mg(NO3)2
120 233
y 23.3g
y=12g
结晶水的质量=24.85g 12g 7.45g=5.4g
化学式中硫酸镁与水分子的个数之比 =1 :3 ,即 n=3
答:该钾泻盐化学式中n的值是3。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
浙教版初三科学《2.5物质的转化》课后练习
一、单选题
1.分离、提纯、除杂、鉴别是基本的实验技能。下列实验设计能达到实验目的的组别是( )
组别 实验目的 实验设计
A 除去FeCl3溶液中混有的少量CuCl2 加入过量的铁粉,过滤
B 分离铜粉和镁粉的混合物 加入足量的稀HCl,过滤、洗涤、干燥
C 提纯混有少量Ca(OH)2的NaOH溶液 加入过量的Na2CO3溶液,振荡、静置、过滤
D 鉴别Na2CO3、BaCl2、NaCl溶液 取样后,分别滴加稀H2SO4溶液,观察现象
A.A B.B C.C D.D
2.初中科学实验中,有许多涉及操作上的“先”与“后”的问题,如果把“先”与“后”顺序颠倒,就会影响实验效果或导致事故的发生。下列实验操作中“先”“后”顺序正确的是( )
A.实验室用过氧化氢溶液制取氧气时,应先加入过氧化氢溶液,再加入二氧化锰
B.测未知溶液pH值,应先将pH试纸浸入待测溶液中,再与标准比色卡比较
C.浓硫酸不慎溅到皮肤上,要先用大量清水冲洗,后用干布擦干,最后涂抹小苏打
D.用氢气还原氧化铜时,应先通一段时间的氢气,后点燃酒精灯进行实验
3.下列实验方案不能达到实验目的的是( )
实验目的 实验方案
A 验证溶液中是否有银离子 取样先加入氯化钡溶液再加入稀硝酸
B 鉴别NaOH溶液和Ca(OH)2溶液 分别滴入Na2CO3溶液,
C 防止铁制品生锈 喷漆等方法使它隔绝水和氧气
D 检验溶液中是否含有葡萄糖 用新制的氢氧化铜悬浊液混合受热,观察是否有砖红色沉淀产生
A.A B.B C.C D.D
废铜的回收利用意义重大,我国提出废铜回收率要达到70%的目标。小明设计如下的实验回收含铜垃圾。
4.实验步骤②,也可以用一氧化碳代替氢气,由此推测一氧化碳具有( )
A.导热性 B.氧化性 C.导电性 D.还原性
5.物质的性质决定用途。在上述流程中稀硫酸、铁屑的性质和对应的用途描述都正确的是( )
物质 性质 用途
A 稀硫酸 能与一些金属反应 将铜转化为可溶的硫酸铜
B 稀硫酸 能与某些金属氧化物反应 将氧化铜转化为可溶的硫酸铜
C 铁屑 金属活动性比铜弱 置换硫酸铜中的铜
D 铁屑 密度比铜小 置换硫酸铜中的铜
A.A B.B C.C D.D
6.把三种无色气体组成的混合气体A,依次通过如图所示的连续装置:各装置内的现象是:B:出现白色浑浊,D:生成红色物质,E:白色变蓝,F:出现沉淀。根据上述现象可以判断在以下气体组成中,最可能是混合气体A的是( )
A.CO2、H2、O2 B.N2、CO、H2 C.CO2、CO、O2 D.CO2、H2、CO
7.春秋初期,绍兴一带是南方的一个冶铁中心,其炼铁方法是在1000℃左右的温度下,使木炭和赤铁矿(主要成分为Fe2O3)发生一系列的反应生成含较多杂质的海绵铁。其中主要化学反应为:3CO+Fe2O32Fe+3CO2。下列说法正确的是( )
A.海绵铁是一种纯净物 B.Fe2O3中铁元素的化合价为+3价
C.上述反应中涉及的氧化物只有2种
D.炼铁过程中,木炭只是作为燃料使用
8.如图为CO还原CuO“微型”实验装置(夹持仪器等略),已知:HCOOHH2O+CO,下列说法错误的是( )
A.实验中所需CO可现制现用
B.此装置可节约用品,污染小,现象明显
C.本实验中可以观察到黑色固体变红,澄清石灰水变浑浊
D.该实验中CO是还原剂,发生了还原反应
9.下列实验设计能达到实验目的是( )
选项 实验目的 实验设计
A 鉴别硝酸钾和碳酸钾 加入稀盐酸,观察现象
B 鉴别氮气和二氧化碳 分别伸入燃烧木条,观察现象
C 鉴别硝酸钾和氯化钠 加水,观察是否溶解
D 鉴别稀硫酸、硫酸钠 加无色酚酞溶液,观察现象
A.A B.B C.C D.D
二、填空题
10.为了确定某含杂质的硝酸钠溶液中所含杂质的成分,某同学设计了如下实验:请回答下列问题:
(1)Ⅰ、Ⅱ为 操作。
(2)经分析,原溶液中的杂质可能由一种或两种物质组成。杂质的成分可能是:
①若原溶液中的杂质由一种物质组成,则该杂质是 ;(填物质的名称)
②若原溶液中的杂质由两种物质组成,则该杂质的成分组成可能有 种情况(填数字)。
11.现有4包白色粉未,编号为A、B、C、D,他们是硫酸铜、氯化钠、硝酸钾、氢氧化钠,通过下列实验,一一加以鉴别。
(1)确定B是硫酸铜,该试管中看到的现象是 。
(2)酚酞滴入A溶液中变红色,则A的化学式是 。
(3)将 C、D 鉴别出来,“ ”代表的试剂是 。
12.如图,给出了三种物质可能存在的转化关系,根据所学的物质性质及化学变化规律,回答下列问题:
(1)实现③转化,可以加入 溶液(填化学式)。
(2)写出实现⑥转化的化学方程式 。
(3)不能一步实现转化的是 (填序号)。
13.某碳酸钠样品中可能含有碳酸钾、氯化钠、硫酸钠、氯化钡、碳酸钙中的一种或几种杂质,科 学兴趣小组同学对碳酸钠样品中杂质的成分进行了如下探究:
步骤1:取少量该样品于烧杯中,加入足量水充分溶解后过滤,得到白色沉淀和无色滤液;
步骤2:向步骤1所得白色沉淀中加入足量的稀硝酸,部分沉淀溶解并产生气体;
步骤3:另取10.6g该样品加入200g稀盐酸,恰好完全反应,生成4.4g二氧化碳。
结合以上探究过程,回答下列问题:
(1)通过步骤1和步骤2可得出杂质中一定含有
(2)该样品的组成最多有. 种情况。
14.某白色固体中可能含有氯化钠、碳酸钠、硫酸钠、硫酸铜、碳酸钡、氯化钡中的几种物质,为了鉴定该白色固体的组成,拓展性学习小组的同学们进行可如下探究实验:
Ⅰ.称取14克固体于烧杯中,加入足量水充分溶解,过滤得到白色沉淀8.6克和无色溶液。
Ⅱ.中所得8.6克白色沉淀中加入足量稀盐酸,沉淀部分溶解并有无色气体产生,测得剩余白色沉淀质量为4.66克。
Ⅲ.把I中所得滤液分成两份,第一份溶液中加入足量的稀硫酸,既没有产生气泡,也没有产生沉淀,第二份溶液中加入足量的氯化钡溶液,没有产生沉淀。
根据上述实验,回答下列问题:
(1)根据以上实验现象 , 白色固体中一定含有的物质是 ;
(2)仅根据第Ⅲ步实验现象可以得出结论 ,溶液中一定不存在的离子是 。
三、实验探究题
15.小乐利用“氢气还原氧化铜”实验验证水的组成,实验装置及药品如图所示,实验前后测定的数据如表所示。回答问题:
实验前 实验后
硬质玻璃管及其内药品的质量/克 75.6 69.2
U形管及其内药品的质量/克 110.8 118.2
(1)为了实验安全,在开始加热硬质玻璃管内氧化铜前,应先进行的实验操作是 。
(2)实验中观察到硬质玻璃管中黑色粉末逐渐变红,则发生反应的化学方程式为 。
(3)验证水的组成的原理为:根据硬质玻璃管及其内药品在反应前后的质量差m1,U形管及其内药品在反应前后的质量差m2,可计算出水中氢、氧元素的质量比为 (用m1、m2等表示)。若实验过程中小乐操作无误,依据实验数据,分析产生误差的可能原因 (写出1点)。
16.如图为教材中实验室模拟炼铁的实验改进装置(部分夹持仪器略去);
实验步骤如下:
Ⅰ.连接好装置,并检查装置的气密性;
Ⅱ.装好药品,先通一会儿CO,再点燃酒精喷灯;
Ⅲ.实验结束,先撤去酒精喷灯,继续通CO直至玻璃管冷却:
回答下列问题:
(1)实验中可看到A处玻璃管里的粉末由红色逐渐变黑,说明Fe2O3转化为Fe,该反应的化学方程式为 ;
(2)步骤Ⅲ中先撤去酒精喷灯,继续通CO直至玻璃管冷却的目的是 ;
(3)盛满石灰水的B装置在此实验中的作用有下列说法:
①收集多余的CO ②检验并吸收反应生成的CO2
上述说法中正确的( )。
A.只有① B.只有② C.是①和②
17.现有已部分锈蚀的生铁粉末(成分为碳、铁、氧化铁),化学兴趣小组欲测定该生铁粉末在锈蚀前的含 碳量以及锈蚀的程度,设计了如下探究过程。
实验步骤一:取a克上述生铁样品放入一洁净干燥烧杯中,进行如下实验。
(实验中所得滤渣是用蒸馏水洗涤、干燥后再进行称量。)
实验步骤二:另取a克该生铁样品,进行如图所示实验,实验装置气密性良好。
A装置瓶中盛放的试剂是浓硫酸。实验结束后,C装置内浓硫酸的质量增加了0.54克。
实验步骤三:小组同学取实验步骤二中B装置硬质玻璃管内反应后所得全部黑色粉末进行了如下实验,所用装置和滤渣已略去。
(1)通过以上实验可得出,生铁中已锈蚀的铁的质量是 g。有同学认为,由上述实验得出的已锈 蚀的铁的质量可能存在误差,理由是 。
(2)实验小组取部分滤液乙于烧杯中,加入一定质量的镁粉,充分反应后过滤。将滤渣洗涤、干燥,所得 滤渣的质量与加入钱粉的质量相等,则所取滤液乙中参加反应的两种溶质的质量比是 (填最简整数比)。
18.工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4。
(查阅资料)草酸晶体(H2C2O4 3H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O4 3H2OCO2↑+CO↑+4H2O
碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。为了测定铁红中铁的质量
分数,小组同学进行如下实验。(装置气密性良好,尾气处理装置未画出。)
(1)该实验为保证进入 E 中的气体是纯净、干燥的 CO,则 B,C,D 中的试剂依次是 (填字母序号)
a.浓硫酸 b.澄清的石灰水
c.氢氧化钠溶液
(2)对 E 装置加热后,要继续通入过量的 CO,除了可以防止空气中的氧气再次将铁氧化, 其它作用是:
(3)称取铁红样品 10.0g,用上述装置进行实验,测定铁红中铁的质量分数。若实验前后称 得 F 装置增重
8.8g,则此铁红中铁的质量分数是
(4)如果缺少G 装置 (不考虑其他因素),则测得样品中铁的质量分数会 (选填“偏小”“不变”“偏大”)
19.如图所示是氢气和氧化铜反应的实验装置图。请分析回答:
(1)实验开始时,合理的操作顺序是 (选填“A”或“B”);
A先加热,再通氢气 B先通氢气,再加热
(2)在实验过程中看到的现象是 ,同时试管口有水珠出现,说明氢气具有 性。
(3)铜在空气中加热很容易氧化变成氧化铜,为了避免这样的情况出现,在实验结束 时要注意的操作是:
四、解答题
20.同学们用石灰石和稀盐酸制取CO2后,用废液缸收集了残留的废液(石灰石所含杂质不与酸反应且不溶于水)。小科想探究废液中溶质的组成,进行了如下实验。
①向少量废液中滴加石蕊试液,试液变红色。
②向10mL废液中滴加Na2CO3溶液,测得沉淀总质量与加入的Na2CO3溶液总质量的关系如下表所示:
第一次测量 第二次测量 第三次测量 第四次测量
加入Na2CO3溶液的总质量/g 10 20 30 40
生成沉淀总质量/g a 0.5 1.5 2
(1)实验室制取CO2后,废液中的溶质是 ( 填化学式)。
(2)表格中a= 。
(3)另取10mL废液置于通风橱充分加热蒸发,计算可得固体质量多少克?
(4)第三次测量后,再加入质量为m(m<10g)的Na2CO3溶液,则生成沉淀的总质量可能为 (要求答出所有的可能性)。
21.某化肥厂以“钾泻盐”(MgSO4·KCl·nH2O)为原料制造高质量钾肥,化肥中KCl含量的高低会直接影响着化肥的品质。某兴趣小组为了测定“钾泻盐”中KCl的质量分数及n的值,设计了如下两种实验方案:
试可答下列问题:
(1)加入足量AgNO3溶液后,方案二中生成固体的成量大于方案一,原为是方案二中所得28.7克固体物质中除生成了 外,还生成了微溶的Ag2SO4;
(2)方案一中,滴加足量的Ba(NO3)2溶液,过滤后所得滤液中除可能含有Ba(NO)3外,一定含有的溶质是 ;
(3)该钾泻盐样品中KCl的质量分数为多少 (精确到1%)
(4)该钾泻盐化学式中n的值是多少 (要写出计算过程)
答案部分
1.【答案】D
2.【答案】D
3.【答案】A
4.【答案】D
5.【答案】B
6.【答案】D
7.【答案】B
8.【答案】D
9.【答案】A
10.【答案】(1)过滤
(2)氯化钙;(氯化钙和氯化钠,氯化钙和硝酸钙,氯化钠和硝酸钙3种组
11.【答案】(1)溶液呈蓝色
(2)NaOH
(3)硝酸银(Ag(NO3))溶液
12.【答案】(1)NaOH
(2)Ca(OH)2+Na2CO3═CaCO3↓+2NaOH(合理即可)
(3)①②
13.【答案】(1)氯化钡和硫酸钠
(2)4(或四)
14.【答案】(1)NaCl、BaCl2、Na2SO4
(2)CO32-、SO42-、Ba2+
15.【答案】(1)通一段时间的氢气
(2)CuO+H2=Cu+H2O
(3)(m2-m1):m1;U形管中的碱石灰吸收了空气中的水和二氧化碳
16.【答案】(1)Fe2O3+3CO 高温 2Fe+3CO2
(2)防止生成的铁被空气中的氧气再次被氧化
(3)C
17.【答案】(1)1.12;碳具有还原性,可能在步骤二中与氧化铁反应
(2)57:49或49:57
18.【答案】(1)cba
(2)驱赶装置滞留的二氧化碳,保证被碱石灰完全吸收
(3)68%
(4)偏小
19.【答案】(1)B
(2)黑色粉末变红色;还原性
(3)熄灭酒精灯后,继续通氢气,直至试管冷却至室温
20.【答案】(1)CaCl2、HCl
(2)0
(3)解:将10mL废液加热蒸发,溶液中的HCl挥发,最后得到的固体为CaCl2。
设:10mL废液中CaCl2质量为x
Na2CO3+ CaCl2=2NaCl+ CaCO3↓
111 100
x 2g
得:x=2.22g
答:将10mL废液蒸发,可得固体质量2.22g
(4)当m<5g时,沉淀质量为1.5g+0.1m;当5g≤m<10g时,沉淀质量为2g。
21.【答案】(1)AgCl
(2)KCl和Mg(NO3)2
(3)
KCl+AgNO3= AgCl+KNO3
74.5 143.5
x 14.35g
x=7.45g
该钾泻盐样品中KCl的质量分数= ×100%≈30%
答:该钾泻盐样品中KCl的质量分数为30%。
(4)解:设样品中硫酸镁的质量为y
MgSO4+Ba(NO3)2= BaSO4+Mg(NO3)2
120 233
y 23.3g
y=12g
结晶水的质量=24.85g 12g 7.45g=5.4g
化学式中硫酸镁与水分子的个数之比 =1 :3 ,即 n=3
答:该钾泻盐化学式中n的值是3。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
