11.1生活中常见的盐(第1课时)课件(共18张PPT 内嵌视频) ---九年级化学人教版下册
文档属性
| 名称 | 11.1生活中常见的盐(第1课时)课件(共18张PPT 内嵌视频) ---九年级化学人教版下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 19.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-25 00:00:00 | ||
图片预览






文档简介
(共18张PPT)
课题1生活中常见的盐
(第1课时)
我们现在所说的盐是不是就是我们平时吃的食盐呢
不是,盐是一类物质,它包括的种类很多,食盐只是其中一种。
盐:一类由金属离子或(NH4+)与 酸根离子结合的化合物 。
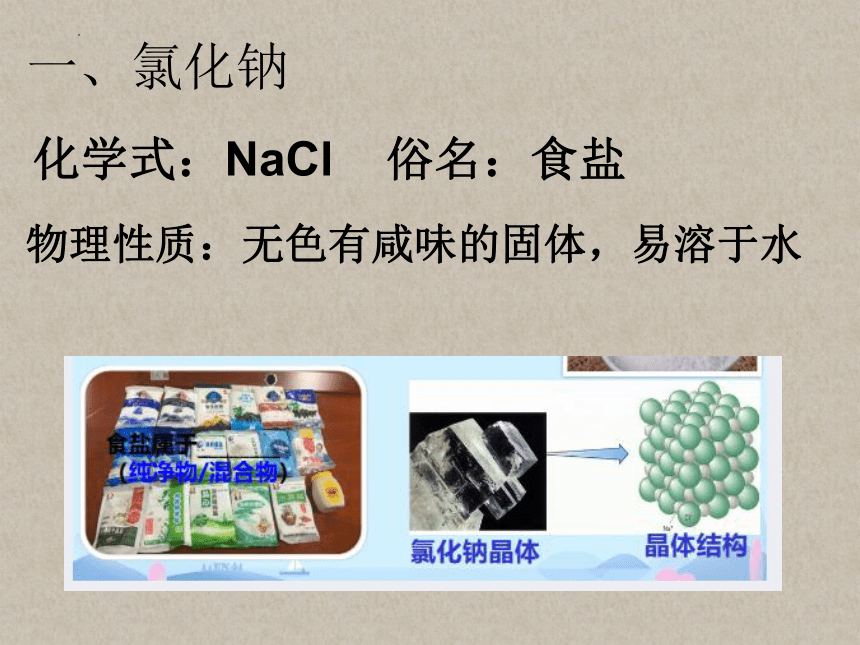
一、氯化钠
化学式:NaCl 俗名:食盐
物理性质:无色有咸味的固体,易溶于水
2.氯化钠的用途
生活上:①调味品、腌制蔬菜、鱼、肉、蛋等;
医疗上:②生理盐水(0.9%的氯化钠溶液);
农业上:③用10%~16%的食盐溶液来选种;
工业上:④制取Na2CO3、NaOH、盐酸、Cl2等;
交通上:⑤公路上的积雪用氯化钠来消除。
亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐,水溶液呈碱性。亚硝酸盐不仅是致癌物质,而且摄入0.2~0.5 g即可引起食物中毒,3 g可致死。而亚硝酸盐是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品。现在世界各国仍允许用它来腌制肉类,但用量严加限制。
氯化钠在自然界中的分布广泛
海水,盐湖、盐井和盐矿中都蕴藏着氯化钠
氯化钠的获取
获取:通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分,得到含有较多杂质的氯化钠晶体——粗盐。
实验活动8 粗盐中难溶性杂质的去除(P87)
烧杯、玻璃棒、蒸发皿、坩埚钳、酒精灯、漏斗、药匙、量筒(10mL)、铁架台(带铁圈)、托盘天平、滤纸、火柴。
[实验用品]
[实验步骤]
①溶解
注意:
在溶解的过程中,粗盐要分次加入,每次加入量要少,完全溶解后再次加入,直到不再溶解。溶解搅拌时,应控制玻璃棒,尽量不要碰烧杯壁。
②过滤
注意:
①一贴:滤纸紧贴漏斗内壁。
二低:滤纸低于漏斗边缘;液面低于滤纸边缘。
三靠:烧杯嘴紧靠玻璃棒;玻璃棒紧靠三层滤纸 一侧;漏斗下端管口紧靠盛清液烧杯内壁。
②如滤液仍浑浊,应再过滤一次。
③蒸发结晶
注意:
①液体的体积不能超过蒸发皿容积的2/3;
②当蒸发皿中出现较多固体时,立即停止加热。利用蒸发皿的余热使滤液蒸干。
④转移固体
注意:
停止加热后,可使用坩埚钳取下蒸发皿,不要立即把蒸发皿直接放在实验台上,以免烫坏实验台。更不能立即用水冲洗。
玻璃棒的作用
溶解时:搅拌,加速溶解
过滤时:引流
蒸发时:搅拌,防止局部温度过高液滴飞溅
转移时:转移固体
二、碳酸钠、碳酸氢钠和碳酸钙
1.碳酸钠 化学式: Na2CO3
①俗名:纯碱、苏打;
②性状:白色粉末状固体,易溶于水,水溶液显碱性。
③用途:用于生产玻璃、纺织、造纸、洗涤剂等。
纯碱不是碱是盐,是碳酸钠这种盐!但溶液显碱性!!
我国制碱工业的先驱——侯德榜发明了侯氏制碱法又称“联合制碱法”
二、碳酸钠、碳酸氢钠和碳酸钙
2.碳酸氢钠 化学式: NaHCO3
①俗名:小苏打
②性状:白色细小晶体状固体, 能溶于水,水溶液显弱碱性。
③用途:是焙制糕点的发酵粉的主要成分之一,还可以治疗胃酸过多。
二、碳酸钠、碳酸氢钠和碳酸钙
3.碳酸钙 化学式: CaCO3
①无俗名,大理石、石灰石主要成分;
②性状:白色固体,难溶于水;
③用途:大理石、石灰石它们都是重要的建筑材料,碳酸钙还可作补钙剂。
课题1生活中常见的盐
(第1课时)
我们现在所说的盐是不是就是我们平时吃的食盐呢
不是,盐是一类物质,它包括的种类很多,食盐只是其中一种。
盐:一类由金属离子或(NH4+)与 酸根离子结合的化合物 。
一、氯化钠
化学式:NaCl 俗名:食盐
物理性质:无色有咸味的固体,易溶于水
2.氯化钠的用途
生活上:①调味品、腌制蔬菜、鱼、肉、蛋等;
医疗上:②生理盐水(0.9%的氯化钠溶液);
农业上:③用10%~16%的食盐溶液来选种;
工业上:④制取Na2CO3、NaOH、盐酸、Cl2等;
交通上:⑤公路上的积雪用氯化钠来消除。
亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐,水溶液呈碱性。亚硝酸盐不仅是致癌物质,而且摄入0.2~0.5 g即可引起食物中毒,3 g可致死。而亚硝酸盐是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品。现在世界各国仍允许用它来腌制肉类,但用量严加限制。
氯化钠在自然界中的分布广泛
海水,盐湖、盐井和盐矿中都蕴藏着氯化钠
氯化钠的获取
获取:通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分,得到含有较多杂质的氯化钠晶体——粗盐。
实验活动8 粗盐中难溶性杂质的去除(P87)
烧杯、玻璃棒、蒸发皿、坩埚钳、酒精灯、漏斗、药匙、量筒(10mL)、铁架台(带铁圈)、托盘天平、滤纸、火柴。
[实验用品]
[实验步骤]
①溶解
注意:
在溶解的过程中,粗盐要分次加入,每次加入量要少,完全溶解后再次加入,直到不再溶解。溶解搅拌时,应控制玻璃棒,尽量不要碰烧杯壁。
②过滤
注意:
①一贴:滤纸紧贴漏斗内壁。
二低:滤纸低于漏斗边缘;液面低于滤纸边缘。
三靠:烧杯嘴紧靠玻璃棒;玻璃棒紧靠三层滤纸 一侧;漏斗下端管口紧靠盛清液烧杯内壁。
②如滤液仍浑浊,应再过滤一次。
③蒸发结晶
注意:
①液体的体积不能超过蒸发皿容积的2/3;
②当蒸发皿中出现较多固体时,立即停止加热。利用蒸发皿的余热使滤液蒸干。
④转移固体
注意:
停止加热后,可使用坩埚钳取下蒸发皿,不要立即把蒸发皿直接放在实验台上,以免烫坏实验台。更不能立即用水冲洗。
玻璃棒的作用
溶解时:搅拌,加速溶解
过滤时:引流
蒸发时:搅拌,防止局部温度过高液滴飞溅
转移时:转移固体
二、碳酸钠、碳酸氢钠和碳酸钙
1.碳酸钠 化学式: Na2CO3
①俗名:纯碱、苏打;
②性状:白色粉末状固体,易溶于水,水溶液显碱性。
③用途:用于生产玻璃、纺织、造纸、洗涤剂等。
纯碱不是碱是盐,是碳酸钠这种盐!但溶液显碱性!!
我国制碱工业的先驱——侯德榜发明了侯氏制碱法又称“联合制碱法”
二、碳酸钠、碳酸氢钠和碳酸钙
2.碳酸氢钠 化学式: NaHCO3
①俗名:小苏打
②性状:白色细小晶体状固体, 能溶于水,水溶液显弱碱性。
③用途:是焙制糕点的发酵粉的主要成分之一,还可以治疗胃酸过多。
二、碳酸钠、碳酸氢钠和碳酸钙
3.碳酸钙 化学式: CaCO3
①无俗名,大理石、石灰石主要成分;
②性状:白色固体,难溶于水;
③用途:大理石、石灰石它们都是重要的建筑材料,碳酸钙还可作补钙剂。
同课章节目录
