5.1.1硫和二氧化硫 课件(共28张ppt)化学人教版(2019)必修第二册
文档属性
| 名称 | 5.1.1硫和二氧化硫 课件(共28张ppt)化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 35.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-25 22:43:51 | ||
图片预览






文档简介
(共28张PPT)
第一节 硫及其化合物
第五章 化工生产中的重要非金属元素
第1课时 硫和二氧化硫
目录
CONTENT
一、硫
二、二氧化硫
第五章 化工生产中的重要非金属元素
1.
2.
3.
4.
学习目标
了解含硫元素的物质在自然界中的存在以及主要来源
了解硫和二氧化硫的主要用途
掌握SO2的检验方法,验证SO2的还原性及漂白性
认识硫和二氧化硫的性质
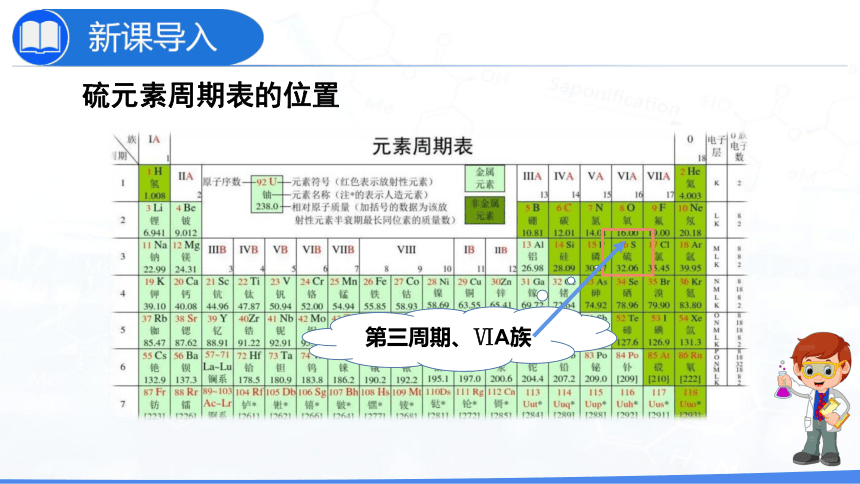
硫元素周期表的位置
第三周期、ⅥA族
一、硫
1.自然界的硫单质
卡瓦伊真火山喷出的气体通过火山口内的喷气孔形成硫磺,很多青壮年去火山口采硫磺矿谋生。这些硫矿被运到当地工厂加工,在硫化橡胶、漂白糖等工业步骤中使用。
火山口附近的硫
黄铁矿
白铁矿
磁黄铁矿
一、硫
2.硫—重要的非金属元素
(1)硫位于元素周期表中的第 周期第 族,硫原子最外层有 个电子,在化学反应中容易 电子,形成 价硫的化合物。
(2)硫元素的原子半径比氯原子半径 ,硫原子得电子能力比氯原子 ,硫化氢的稳定性比氯化氢 。
(3)硫元素的非金属性比氧元素 ,
在富含氧气的地表附近的含硫化合物中,
硫常显 价,氧为 价。
三
ⅥA
6
得到
-2
大
弱
弱
弱
+4或+6
-2
一、硫
3.硫
(1)物理性质
①单质硫俗称 ,是一种 晶体,质脆,易研成粉末。
②难溶于水,微溶于 ,易溶于 。
硫黄
黄色
酒精
二硫化碳
③硫有多种__________________,其中正交硫的熔点为113 ℃,沸点为445 ℃,密度为2.06 g·cm-3。
同素异形体
一、硫
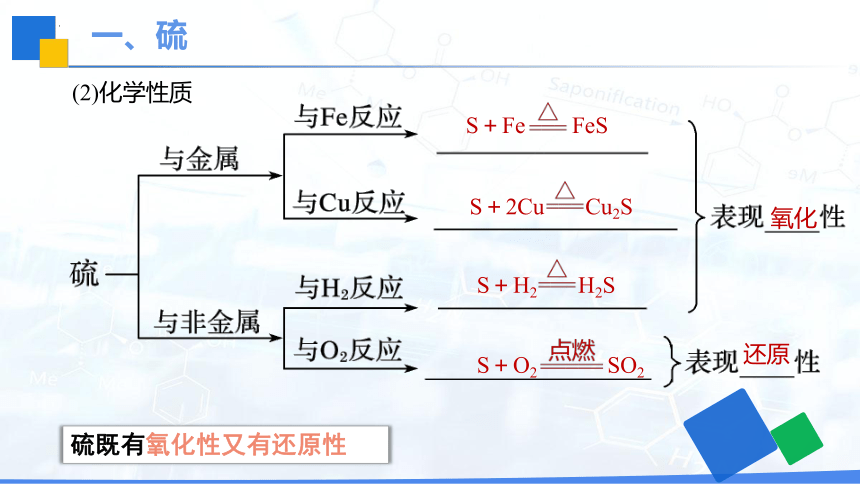
(2)化学性质
S+Fe FeS
S+2Cu Cu2S
S+H2 H2S
S+O2 SO2
氧化
还原
硫既有氧化性又有还原性
硫在空气中安静地燃烧,发出淡蓝色火焰;在氧气中燃烧,发出明亮的蓝紫色火焰,燃烧得到的氧化产物均为SO2,即硫与氧气反应,不论氧气是否足量、浓度如何,其一步反应都只能生成SO2,不能生成SO3.
一、硫
归纳总结
(1)从物质类别和元素化合价角度理解硫的化学性质:
(2)硫在一定条件下与大多数金属反应生成相应的金属硫化物,与变价金属反应生成其低价金属硫化物。
(3)硫与氧气反应,不论氧气是否足量、浓度如何,其一步反应都只能生成SO2,不能生成SO3。
1.根据硫的性质,回答下列问题:
(1)单质间发生化合反应,能否生成Fe2S3或CuS
提示 不能。单质硫与变价金属铁或铜化合只能生成FeS或Cu2S。
(2)铁与硫反应生成FeS,与氯气反应生成FeCl3,能否说明氯气的氧化性比硫强?
提示 能。氯气将铁氧化为+3价,而硫只能将铁氧化为+2价。
2.硫与热碱液反应生成金属硫化物和亚硫酸盐。如3S+6NaOH 2Na2S+Na2SO3+3H2O。
(1)该反应中硫体现的性质是________________。
(2)氧化剂与还原剂的物质的量之比为_____。
氧化性和还原性
2∶1
二、二氧化硫
1.物理性质
色、态 气味 毒性 密度 水溶性
_____色气体 _______气味 比空气__ ______溶于水
(1∶______)
无
刺激性
有毒
大
易
40
实验探究 :实验5-1
将集满SO2的试管倒扣在水中,振荡,观察现象
二、二氧化硫
现象:液面迅速 ,最后充满试管。
结论:SO2有 气味, 溶于水。
上升
刺激性
易
操作 现象 结论
测定溶液的pH pH试纸_____ __________________
滴加紫色石蕊溶液 溶液_____ ,
漂白石蕊溶液
变红
SO2的水溶液显酸性
变红
SO2的水溶液显酸性
不能
二、二氧化硫
2.化学性质
(1)从物质分类的方面分析SO2性质
SO2+Ca(OH)2===CaSO3↓+H2O
SO2+CaO===CaSO3
SO2+H2O H2SO3
正反应:化学上通常把向生成物方向进行的反应叫做正反应。
逆反应:向反应物方向进行的反应叫做逆反应。
可逆反应:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应,叫做可逆反应。
二、二氧化硫
(2)从元素化合价变化角度分析SO2性质
H2SO4+2HCl
2SO3
3S+2H2O
(3)SO2的特性——漂白性
可使某些有色物质(如品红溶液)生成不稳定的无色物质,若加热,可恢复原来的颜色。
二、二氧化硫
【实验5-2】向溶有SO2的溶液中滴加1~2滴品红溶液,振荡
不稳定
无
(4)用途:
工业上常用二氧化硫来漂白_____、____、_____等;
二氧化硫可用于_______,同时可用作__________。如葡萄酒中添加适量的二氧化硫,既起到一定的杀菌消毒作用,又起到_____作用。
纸浆
毛
丝
杀菌消毒
食品添加剂
抗氧化
原理:二氧化硫能与某些有色物质生成_______的____色物质。
实现现象 实验结论
SO2水溶液滴入品红溶液后,溶液变红,振荡后褪色; 加热后,溶液又变为红色 SO2能漂白品红溶液;
无色物质容易分解,加热恢复原来的颜色
二、二氧化硫
二氧化硫与氯水的漂白性比较
二、二氧化硫
②褪色不都是漂白,有机色质(如纸张、布条)被氧化或因为发生化合反应而褪色称为漂白,如SO2将MnO 还原为Mn2+,不是漂白。
③SO2的漂白是“化合型”漂白,即与有色物质化合生成无色不稳定化合物,与SO2是酸性气体、有还原性无关。SO2的漂白具有选择性,不能漂白酸碱指示剂。
①根据SO2分子中S的价态可知,SO2中的S在反应中既可得到电子也可失去电子,既具有氧化性又具有还原性。SO2的性质可总结为“三性一特性”:“三性”指氧化性(主要指SO2+2H2S===3S+2H2O)、还原性(能使溴水、酸性KMnO4溶液褪色)、酸性氧化物的通性;“一特性”指漂白性(能使品红溶液褪色,但加热后溶液又恢复红色)。
SO2与CO2的鉴别方法
①用品红溶液:能使品红溶液褪色的是SO2,不能使品红溶液褪色的是CO2;
②用氢硫酸溶液:出现淡黄色浑浊的是SO2,无明显现象的是CO2;
③用酸性KMnO4溶液:能使KMnO4溶液的紫色褪去的是SO2,无明显现象的是CO2;
④用溴水:能使溴水褪色的是SO2,无明显现象的是CO2;
⑤用FeCl3溶液:能使FeCl3溶液的黄色变为浅绿色的是SO2,无明显现象的是CO2。
二氧化硫和新制氯水的漂白作用比较
比较 SO2 新制氯水
漂白原理 SO2能与某些有色物质结合生成不稳定的无色物质 Cl2与H2O反应生成的HClO具有强氧化性,可以将有色物质氧化成无色物质
漂白效果 不稳定,加热能复原 稳定
漂白范围 某些有色物质 绝大多数有色物质
与有色物质 作用实例 品红褪色;紫色石蕊变红,但不褪色 品红褪色;紫色石蕊先变红,随即褪色
混合作用 SO2+Cl2+2H2O===H2SO4+2HCl,漂白作用大大减弱或消失 硫(俗称硫黄);
状态:黄色晶体,质脆,易研成粉末;
密度:2.06g/cm3,密度比水大;
沸点:445℃
熔点:113 ℃
溶解度:难溶于水,微溶于酒精,易溶于二硫化碳。
名称:二氧化硫
状态:无色有刺激性气味气体
密度:密度比空气大;
毒性:有毒
溶解度:易溶于水
1.下列反应中,SO2作还原剂的是( )
A.SO2+NaOH===NaHSO3 B.SO2+H2O2===H2SO4
C.SO2+2H2S===3S+2H2O D. 2Mg+3SO2===S+2MgSO3
B
2.下列变化可以说明SO2具有漂白性的是( )
A.SO2通入溴水中,溴水褪色
B.SO2通入酸性高锰酸钾溶液中,溶液的紫红色褪去
C.SO2通入品红溶液中,溶液的红色褪去
D.SO2通入滴有酚酞的氢氧化钠溶液中,溶液的红色褪去
C
3.如下图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。下表中对实验现象的描述或所做的解释不正确的是( )
选项 实验现象 解释
A BaCl2溶液变浑浊 SO2与BaCl2溶液反应产生了BaSO3沉淀
B Na2S溶液变浑浊 SO2与Na2S溶液反应产生了S单质
C 酸性KMnO4溶液褪色 SO2具有还原性
D 品红溶液褪色 SO2具有漂白性
A
4.请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器的名称是__________________。
(2)实验过程中,装置B中产生的现象为________,这说明SO2具有_____。
(3)装置C的目的是探究SO2与品红溶液发生反应的可逆性,请写出实验操作及现象:________________________________。
(4)尾气可采用________溶液吸收。
【答案】(1)蒸馏烧瓶
(2)溶液由紫红色变为无色 还原性
(3)品红溶液褪色后,关闭分液漏斗旋塞,点燃酒精灯加热,溶液恢复为红色 (4)NaOH
谢谢
第一节 硫及其化合物
第五章 化工生产中的重要非金属元素
第1课时 硫和二氧化硫
目录
CONTENT
一、硫
二、二氧化硫
第五章 化工生产中的重要非金属元素
1.
2.
3.
4.
学习目标
了解含硫元素的物质在自然界中的存在以及主要来源
了解硫和二氧化硫的主要用途
掌握SO2的检验方法,验证SO2的还原性及漂白性
认识硫和二氧化硫的性质
硫元素周期表的位置
第三周期、ⅥA族
一、硫
1.自然界的硫单质
卡瓦伊真火山喷出的气体通过火山口内的喷气孔形成硫磺,很多青壮年去火山口采硫磺矿谋生。这些硫矿被运到当地工厂加工,在硫化橡胶、漂白糖等工业步骤中使用。
火山口附近的硫
黄铁矿
白铁矿
磁黄铁矿
一、硫
2.硫—重要的非金属元素
(1)硫位于元素周期表中的第 周期第 族,硫原子最外层有 个电子,在化学反应中容易 电子,形成 价硫的化合物。
(2)硫元素的原子半径比氯原子半径 ,硫原子得电子能力比氯原子 ,硫化氢的稳定性比氯化氢 。
(3)硫元素的非金属性比氧元素 ,
在富含氧气的地表附近的含硫化合物中,
硫常显 价,氧为 价。
三
ⅥA
6
得到
-2
大
弱
弱
弱
+4或+6
-2
一、硫
3.硫
(1)物理性质
①单质硫俗称 ,是一种 晶体,质脆,易研成粉末。
②难溶于水,微溶于 ,易溶于 。
硫黄
黄色
酒精
二硫化碳
③硫有多种__________________,其中正交硫的熔点为113 ℃,沸点为445 ℃,密度为2.06 g·cm-3。
同素异形体
一、硫
(2)化学性质
S+Fe FeS
S+2Cu Cu2S
S+H2 H2S
S+O2 SO2
氧化
还原
硫既有氧化性又有还原性
硫在空气中安静地燃烧,发出淡蓝色火焰;在氧气中燃烧,发出明亮的蓝紫色火焰,燃烧得到的氧化产物均为SO2,即硫与氧气反应,不论氧气是否足量、浓度如何,其一步反应都只能生成SO2,不能生成SO3.
一、硫
归纳总结
(1)从物质类别和元素化合价角度理解硫的化学性质:
(2)硫在一定条件下与大多数金属反应生成相应的金属硫化物,与变价金属反应生成其低价金属硫化物。
(3)硫与氧气反应,不论氧气是否足量、浓度如何,其一步反应都只能生成SO2,不能生成SO3。
1.根据硫的性质,回答下列问题:
(1)单质间发生化合反应,能否生成Fe2S3或CuS
提示 不能。单质硫与变价金属铁或铜化合只能生成FeS或Cu2S。
(2)铁与硫反应生成FeS,与氯气反应生成FeCl3,能否说明氯气的氧化性比硫强?
提示 能。氯气将铁氧化为+3价,而硫只能将铁氧化为+2价。
2.硫与热碱液反应生成金属硫化物和亚硫酸盐。如3S+6NaOH 2Na2S+Na2SO3+3H2O。
(1)该反应中硫体现的性质是________________。
(2)氧化剂与还原剂的物质的量之比为_____。
氧化性和还原性
2∶1
二、二氧化硫
1.物理性质
色、态 气味 毒性 密度 水溶性
_____色气体 _______气味 比空气__ ______溶于水
(1∶______)
无
刺激性
有毒
大
易
40
实验探究 :实验5-1
将集满SO2的试管倒扣在水中,振荡,观察现象
二、二氧化硫
现象:液面迅速 ,最后充满试管。
结论:SO2有 气味, 溶于水。
上升
刺激性
易
操作 现象 结论
测定溶液的pH pH试纸_____ __________________
滴加紫色石蕊溶液 溶液_____ ,
漂白石蕊溶液
变红
SO2的水溶液显酸性
变红
SO2的水溶液显酸性
不能
二、二氧化硫
2.化学性质
(1)从物质分类的方面分析SO2性质
SO2+Ca(OH)2===CaSO3↓+H2O
SO2+CaO===CaSO3
SO2+H2O H2SO3
正反应:化学上通常把向生成物方向进行的反应叫做正反应。
逆反应:向反应物方向进行的反应叫做逆反应。
可逆反应:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应,叫做可逆反应。
二、二氧化硫
(2)从元素化合价变化角度分析SO2性质
H2SO4+2HCl
2SO3
3S+2H2O
(3)SO2的特性——漂白性
可使某些有色物质(如品红溶液)生成不稳定的无色物质,若加热,可恢复原来的颜色。
二、二氧化硫
【实验5-2】向溶有SO2的溶液中滴加1~2滴品红溶液,振荡
不稳定
无
(4)用途:
工业上常用二氧化硫来漂白_____、____、_____等;
二氧化硫可用于_______,同时可用作__________。如葡萄酒中添加适量的二氧化硫,既起到一定的杀菌消毒作用,又起到_____作用。
纸浆
毛
丝
杀菌消毒
食品添加剂
抗氧化
原理:二氧化硫能与某些有色物质生成_______的____色物质。
实现现象 实验结论
SO2水溶液滴入品红溶液后,溶液变红,振荡后褪色; 加热后,溶液又变为红色 SO2能漂白品红溶液;
无色物质容易分解,加热恢复原来的颜色
二、二氧化硫
二氧化硫与氯水的漂白性比较
二、二氧化硫
②褪色不都是漂白,有机色质(如纸张、布条)被氧化或因为发生化合反应而褪色称为漂白,如SO2将MnO 还原为Mn2+,不是漂白。
③SO2的漂白是“化合型”漂白,即与有色物质化合生成无色不稳定化合物,与SO2是酸性气体、有还原性无关。SO2的漂白具有选择性,不能漂白酸碱指示剂。
①根据SO2分子中S的价态可知,SO2中的S在反应中既可得到电子也可失去电子,既具有氧化性又具有还原性。SO2的性质可总结为“三性一特性”:“三性”指氧化性(主要指SO2+2H2S===3S+2H2O)、还原性(能使溴水、酸性KMnO4溶液褪色)、酸性氧化物的通性;“一特性”指漂白性(能使品红溶液褪色,但加热后溶液又恢复红色)。
SO2与CO2的鉴别方法
①用品红溶液:能使品红溶液褪色的是SO2,不能使品红溶液褪色的是CO2;
②用氢硫酸溶液:出现淡黄色浑浊的是SO2,无明显现象的是CO2;
③用酸性KMnO4溶液:能使KMnO4溶液的紫色褪去的是SO2,无明显现象的是CO2;
④用溴水:能使溴水褪色的是SO2,无明显现象的是CO2;
⑤用FeCl3溶液:能使FeCl3溶液的黄色变为浅绿色的是SO2,无明显现象的是CO2。
二氧化硫和新制氯水的漂白作用比较
比较 SO2 新制氯水
漂白原理 SO2能与某些有色物质结合生成不稳定的无色物质 Cl2与H2O反应生成的HClO具有强氧化性,可以将有色物质氧化成无色物质
漂白效果 不稳定,加热能复原 稳定
漂白范围 某些有色物质 绝大多数有色物质
与有色物质 作用实例 品红褪色;紫色石蕊变红,但不褪色 品红褪色;紫色石蕊先变红,随即褪色
混合作用 SO2+Cl2+2H2O===H2SO4+2HCl,漂白作用大大减弱或消失 硫(俗称硫黄);
状态:黄色晶体,质脆,易研成粉末;
密度:2.06g/cm3,密度比水大;
沸点:445℃
熔点:113 ℃
溶解度:难溶于水,微溶于酒精,易溶于二硫化碳。
名称:二氧化硫
状态:无色有刺激性气味气体
密度:密度比空气大;
毒性:有毒
溶解度:易溶于水
1.下列反应中,SO2作还原剂的是( )
A.SO2+NaOH===NaHSO3 B.SO2+H2O2===H2SO4
C.SO2+2H2S===3S+2H2O D. 2Mg+3SO2===S+2MgSO3
B
2.下列变化可以说明SO2具有漂白性的是( )
A.SO2通入溴水中,溴水褪色
B.SO2通入酸性高锰酸钾溶液中,溶液的紫红色褪去
C.SO2通入品红溶液中,溶液的红色褪去
D.SO2通入滴有酚酞的氢氧化钠溶液中,溶液的红色褪去
C
3.如下图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。下表中对实验现象的描述或所做的解释不正确的是( )
选项 实验现象 解释
A BaCl2溶液变浑浊 SO2与BaCl2溶液反应产生了BaSO3沉淀
B Na2S溶液变浑浊 SO2与Na2S溶液反应产生了S单质
C 酸性KMnO4溶液褪色 SO2具有还原性
D 品红溶液褪色 SO2具有漂白性
A
4.请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器的名称是__________________。
(2)实验过程中,装置B中产生的现象为________,这说明SO2具有_____。
(3)装置C的目的是探究SO2与品红溶液发生反应的可逆性,请写出实验操作及现象:________________________________。
(4)尾气可采用________溶液吸收。
【答案】(1)蒸馏烧瓶
(2)溶液由紫红色变为无色 还原性
(3)品红溶液褪色后,关闭分液漏斗旋塞,点燃酒精灯加热,溶液恢复为红色 (4)NaOH
谢谢
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
