3.1 铁及其化合物 说课课件 (共38张PPT) 2022-2023学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 3.1 铁及其化合物 说课课件 (共38张PPT) 2022-2023学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 6.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-25 22:47:10 | ||
图片预览









文档简介
(共38张PPT)
第三章
第一节 铁及其化合物
普通高中课程标准实验教科书 化学 1(人教版)
2
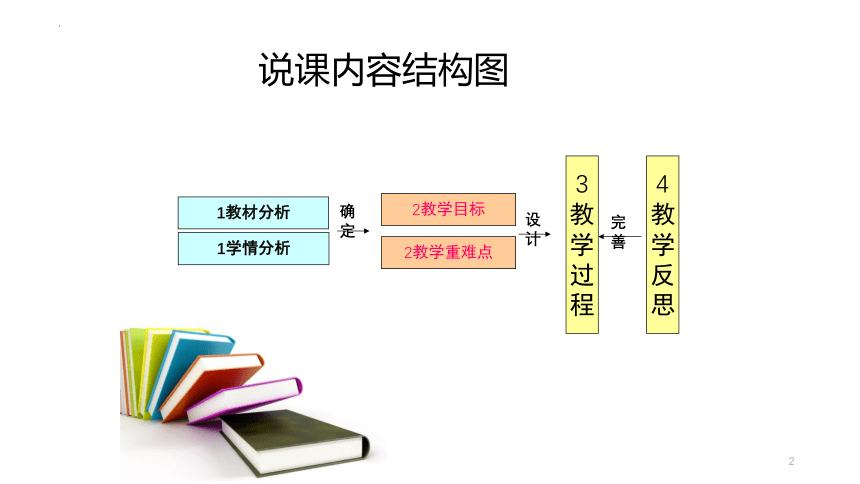
1教材分析
1学情分析
2教学目标
2教学重难点
确定
设计
3
教
学
过
程
4
教
学
反
思
说课内容结构图
完善
既为第一章和第二章的实验和理论知识补充感性认识的材料,又为化学2介绍的物质结构、元素周期律、化学反应与能量等理论知识打下重要的基础 。
章地位作用:
节地位作用:
1.铁是变价金属元素——氧还观建立
2.实验丰富 ——宏观到微观研究
3.体现化学思维方法——分类法、氧还观、转化观
1
教材分析
教材资源:2个实验栏目,1个科学探究栏目 ,学与问、
实验配图、资料卡片、实践活动
课后习题的使用63页10题:印刷电路板使用高分子材料和铜箔符合而成,可知印刷电路时......
知识上:前两章学习了物质的分类、 氧化还原反应、
离子反应和酸碱盐和电解质等概念原理。
能力上:初步具备了观察能力.实验能力、思维能力、
情感上,乐于探究物质变化的奥妙 。
发展点:运用分类思想。
完善对研究物质氧化还原方法的认识。
建立元素化合物的一般研究方法。
1
学情分析
必修模块要求
《课程标准》内容要求 模块学习要求
根据生产、生活中的应用实例或通过实验探究,了解铁及其重要化合物的主要性质。 1.能说出铁的重要化合物的物理性质;
2.认识氧化铁和氧化亚铁的主要化学性质(与酸反应)
3.认识氢氧化铁和氢氧化亚铁的制备原理及主要化学性质(与酸反应、氢氧化亚铁加热分解)
4.认识Fe3+和Fe2+的相互转化。
通过对钠、铝、铁及其化合物之间的转化关系的比较和归纳,逐步体会学习元素化合物知识的一般方法。
2
教学目标
知识与技能
1.认识铁的重要化合物的化学性质。
2.认识 Fe2+和Fe3+的检验及相互转化。
教学资源应用
2
教学目标
过程与方法
1.通过对铁化合物的分类,初步学会从物质分类和氧化还原的角度研究物质性质的方法。
2.通过对氢氧化亚铁的制备实验中的“异常”现象,初步学会用氧化还原反应理论研究物质的变化。
3.通过对铁的化合物氧化还原性的实验探究活动,初步学会通过实验研究物质氧化还原性的思路和方法。
4.总结本节课学习过程,分析元素化合物研究的一般方法。
8
情感态度与价值观
通过实验观察和探究,培养小组合作意识,体验实验研究的奇妙和乐趣。
通过对情境素材的研究,培养学生用化学视角关注生活,体会化学对人类生活的重要影响。
2
教学目标
教学重点:
教学难点:
实验研究物质氧化还原性的思路和方法
Fe(OH)2的制备和性质、Fe2+和Fe3+的检验及相互转化。
2
教学重、难点
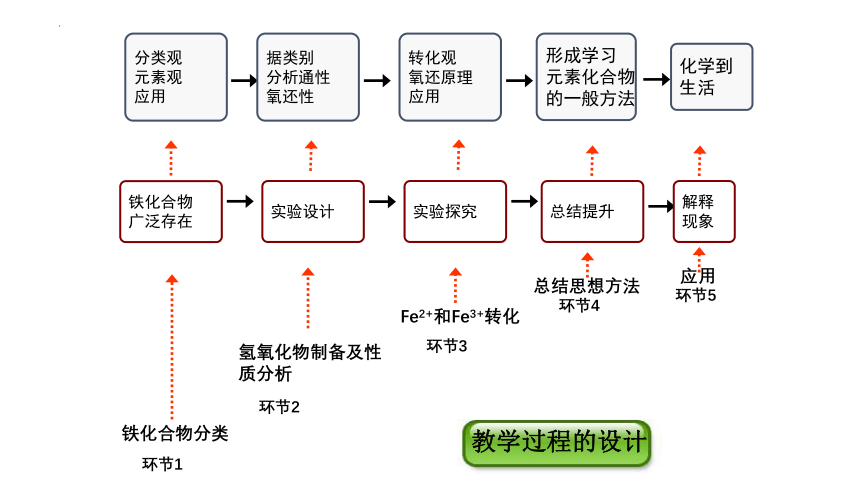
环节1
环节2
环节3
环节4
铁化合物分类
氢氧化物制备及性质分析
Fe2+和Fe3+转化
总结思想方法
铁化合物
广泛存在
实验设计
实验探究
总结提升
分类观
元素观
应用
形成学习
元素化合物
的一般方法
据类别
分析通性
氧还性
转化观
氧还原理
应用
教学过程的设计
环节5
应用
解释
现象
化学到
生活
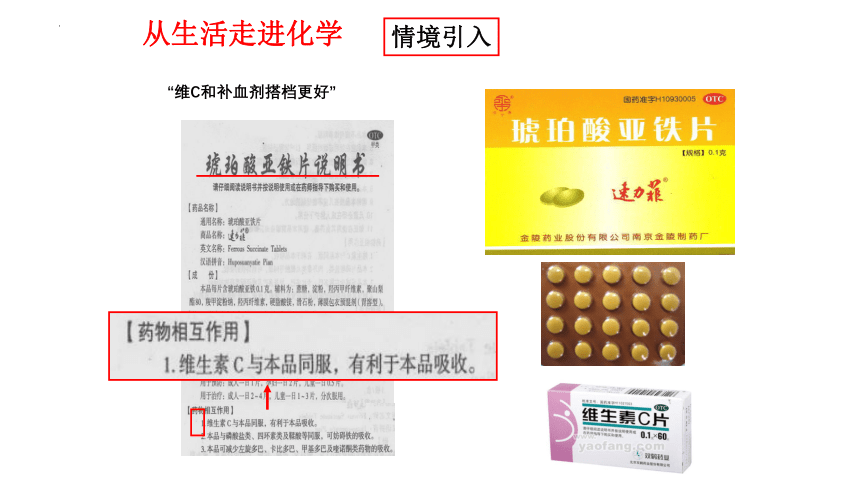
从生活走进化学
“维C和补血剂搭档更好”
情境引入
问题导入:
1.你知道哪些铁化合物?写出它们的化学式。
2.分析化学式有哪些异同?
3.根据物质分类和化合价不同建立一个二维坐标图(加入Fe)。
单质
氧化物
碱
盐
0
+2
+3
Fe
FeO
Fe2O3
Fe(OH)2
Fe(OH)3
FeSO4
FeCl3
设计意图:学生已知与所学概念理论建立联系
环节1:铁化合物分类
氧还性
物质通性
FeCl2
Fe2(SO4)3
学生学案
你知道哪些常见的铁的化合物?写出它们的化学式。
依据你的分类,建立一个二维坐标图(加入Fe)
设计意图:
Fe(OH)3
Fe(OH)2
Fe2O3
FeCl3
Fe3O4
FeO
FeO
FeSO4
铁及其化合物
查阅资料:
Fe(OH)2 :白色不溶于水
Fe(OH)3 :红褐色不溶于水
Fe3+ :遇硫氰化钾KSCN呈血红色
Fe2+ :遇硫氰化钾KSCN不呈血红色
Fe3+ :黄色
Fe2+ :浅绿色
K3[Fe(CN)6]:铁氰化钾,俗称黄血盐,遇到Fe2+生成深蓝色沉淀。
氧化剂:氯水有效成分Cl2 ,溶液颜色为黄绿色。高锰酸钾KMnO4溶液颜色为紫色,Mn2+颜色为无色
铁的化合物种类多,物质颜色丰富,提供资料,降低学生学习的难度
分类观:物质类别——通性
碱性氧化物性质
FeO+2H+=Fe2++H2O
Fe2O3+6H+=2Fe3++3H2O
2.不溶性碱 (1)性质
2Fe(OH)3 = Fe2O3 + 3H2O
碱性
不稳定性
△
Fe(OH)2 + 2H+ = Fe2+ + 2H2O
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
2Fe(OH)2 = ?
物质转化:氧化物——盐
物质转化:碱——盐
物质转化:碱——氧化物
△
学生填写学案
环节2:铁的氢氧化物制备
2. 氢氧化物制备 物质转化:盐——碱
1.实验设计——物质制备
①提出问题:如何制备Fe(OH)2、Fe(OH)3?
②方案设计:
③填观察表
④小组汇报
19
实验报告 氢氧化铁 氢氧化亚铁
制备原理 (离子方程式)
现象
④每个小组汇报自己的结果,归纳结论。
③填观察表
学生学案
20
Fe3++3OH-= Fe(OH)3↓(红褐色沉淀)
Fe2++2OH-= Fe(OH)2↓ (白色沉淀)
发现异常——引发思考
现象: 白 → 灰绿 → 红褐
21
⑤引导思考
⑴为什么没有得到预想中的白色沉淀Fe(OH)2?
⑵如何制得较为纯净的Fe(OH)2呢?问题的关键是什么?如何避免呢?(课后思考题)
FeSO4
NaOH溶液
植物油
加入固体NaOH
22
分析“异常”原因
FeCl2
Fe (OH) 2
Fe (OH) 3
NaOH 溶液
O2 H2O
Fe 3+
O2
NaOH 溶液
物质转化:化合价变化——氧化还原反应
?
铁为变价金属元素
Fe 3+ 的检验方法:KSCN溶液
23
3、铁盐和亚铁盐
方法二:(特效试剂)滴加KSCN溶液,溶液
变为红色
(1)Fe3+的检验
硫氰化钾(KSCN=K+ +SCN- )
Fe3+ +3SCN- = Fe(SCN)3
血红色溶液
方法一:加入NaOH溶液,出现红褐色沉淀
此反应十分灵敏,KSCN溶液是检验Fe3+的存在的特效试剂
小结:Fe3+的检验方法
24
2、实验探究 ---- Fe2+、Fe3+间的相互转化
②方案设计:实验中学生可能采用的实验方案
①提出问题:Fe2+、Fe3+氧化还原性如何?
根据氧化还原知识
利用已学知识说明 Fe2+有氧化性
设计并实验验证 Fe2+有还原性
设计并实验验证 Fe3+有还原性
环节3:Fe2+、Fe3+相互间的转化
Fe2+
Fe2+有还原性
KSCN溶液
观察
Cl2
观察
Fe2+有氧化性
Fe3+
KSCN溶液
观察
足量Fe
观察
Fe3+
KSCN溶液
观察
足量Fe
观察
25
Fe2+有氧化性
Fe3+
KSCN溶液
观察
足量Fe
观察
Fe3+
KSCN溶液
观察
足量Fe
观察
26
④每个小组汇报自己的结果,归纳结论。
③填观察表
转化目标 所选试剂 实验方案 预期现象 实验现象 结论
FeCl2→FeCl3
FeCl3→FeCl2
学生学案
27
(2)Fe2+的检验
方法一:加入NaOH溶液,生成白色絮状沉淀,该沉淀迅速变成灰绿色,最后变成红褐色。
方法二:滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变为血红色。
小结:Fe2+的检验方法
28
资料:
方法三:特效试剂K3[Fe(CN)6](称为铁氰化钾,俗称赤血盐,它可溶于水,水溶液带有黄绿色荧光。
)
在酸性环境中,遇亚Fe2+生成深蓝色沉淀。
赤血盐溶液遇到Fe2+离子,立即生成名为普鲁士蓝(Prussian blue)的深蓝色沉淀,其化学式为KFe[Fe(CN)6]六氰合亚铁酸铁钾:
铁氰化钾
铁氰化钾溶液
29
⑤引导思考
⑴你设计Fe2+和Fe3+相互转化选择试剂的依据是什么?
⑵你如何判断Fe2+和Fe3+之间发生了转化?
③填观察表
④每个小组汇报
Fe2+
(还原性)
产物
(检测产物)
氧化剂
Fe3+
(氧化性)
产物
(检测产物)
还原剂
环节4:总结思想、方法
30
总结研究物质氧还性的一般方法
分析元素化合价
预测氧化还原性
选择合适试剂
设计实验方案
实验、观察现象
(验证产物存在)
分析讨论现象
得出结论
修改、完善
31
(3)小结:Fe 、Fe2+ 、Fe3+的相互转化
Fe
Fe2+
Fe3+
H+
Cl2 、KMnO4
Fe
Zn
Fe
Fe2+
Fe3+
氧化剂
氧化剂
还原剂
还原剂
32
出口?
单质
氧化物
碱
盐
0
+2
+3
Fe
FeO
Fe2O3
Fe(OH)2
Fe(OH)3
FeCl3
氧还性
物质通性
FeCl2
回顾学习过程:
Fe元素→铁化合物
元素化合价→氧化还原性
元素组成→物质分类→通性
化学性质
(物质转化)
Fe3O4
2Fe(OH)2 = ?
△
点
线
面
各种转化反应
分类观
转化观
研究元素化合物的一般方法
34
从化学走向社会-----用化学解释生产、生活的中现象
了解FeCl3制作印刷电路板制作过程:
先在塑料板上镀上一层铜,然后在设计好的铜线路上涂上一层石蜡,把板浸到氯化铁溶液中,没有在线路上的铜即没有被石蜡覆盖住的铜就被反应掉。
请说出其中发生的反应原理,写出化学方程式。
书后习题资料的使用63页10题:印刷电路板……
“维C和补血剂(琥珀酸亚铁)搭档更好”
35
从化学走向社会-----用化学解释生产、生活的中现象
为何茶水变墨水?推测这种自来水中含什么离子?如何用你所学的知识进行验证?
茶水变墨水?
墨水变茶水?
请解释实验室配制FeSO4溶液时加铁粉的作用。
课后作业1
从化学走向社会-----用化学解释生产、生活的中现象
37
4
教学反思
1.以回忆、复习方式引入新课,使学生已有知识系统化,有利于新知识的学习。
2.元素化合物的教学变物质中心模式为以元素为核心的教学,更具有普遍性。
3.形成研究物质氧化还原性的一般方法,指导学生其他元素化合物的学习。
4.氢氧化亚铁制备实验和探究实验要详略得当,有所侧重。
感谢聆听
第三章
第一节 铁及其化合物
普通高中课程标准实验教科书 化学 1(人教版)
2
1教材分析
1学情分析
2教学目标
2教学重难点
确定
设计
3
教
学
过
程
4
教
学
反
思
说课内容结构图
完善
既为第一章和第二章的实验和理论知识补充感性认识的材料,又为化学2介绍的物质结构、元素周期律、化学反应与能量等理论知识打下重要的基础 。
章地位作用:
节地位作用:
1.铁是变价金属元素——氧还观建立
2.实验丰富 ——宏观到微观研究
3.体现化学思维方法——分类法、氧还观、转化观
1
教材分析
教材资源:2个实验栏目,1个科学探究栏目 ,学与问、
实验配图、资料卡片、实践活动
课后习题的使用63页10题:印刷电路板使用高分子材料和铜箔符合而成,可知印刷电路时......
知识上:前两章学习了物质的分类、 氧化还原反应、
离子反应和酸碱盐和电解质等概念原理。
能力上:初步具备了观察能力.实验能力、思维能力、
情感上,乐于探究物质变化的奥妙 。
发展点:运用分类思想。
完善对研究物质氧化还原方法的认识。
建立元素化合物的一般研究方法。
1
学情分析
必修模块要求
《课程标准》内容要求 模块学习要求
根据生产、生活中的应用实例或通过实验探究,了解铁及其重要化合物的主要性质。 1.能说出铁的重要化合物的物理性质;
2.认识氧化铁和氧化亚铁的主要化学性质(与酸反应)
3.认识氢氧化铁和氢氧化亚铁的制备原理及主要化学性质(与酸反应、氢氧化亚铁加热分解)
4.认识Fe3+和Fe2+的相互转化。
通过对钠、铝、铁及其化合物之间的转化关系的比较和归纳,逐步体会学习元素化合物知识的一般方法。
2
教学目标
知识与技能
1.认识铁的重要化合物的化学性质。
2.认识 Fe2+和Fe3+的检验及相互转化。
教学资源应用
2
教学目标
过程与方法
1.通过对铁化合物的分类,初步学会从物质分类和氧化还原的角度研究物质性质的方法。
2.通过对氢氧化亚铁的制备实验中的“异常”现象,初步学会用氧化还原反应理论研究物质的变化。
3.通过对铁的化合物氧化还原性的实验探究活动,初步学会通过实验研究物质氧化还原性的思路和方法。
4.总结本节课学习过程,分析元素化合物研究的一般方法。
8
情感态度与价值观
通过实验观察和探究,培养小组合作意识,体验实验研究的奇妙和乐趣。
通过对情境素材的研究,培养学生用化学视角关注生活,体会化学对人类生活的重要影响。
2
教学目标
教学重点:
教学难点:
实验研究物质氧化还原性的思路和方法
Fe(OH)2的制备和性质、Fe2+和Fe3+的检验及相互转化。
2
教学重、难点
环节1
环节2
环节3
环节4
铁化合物分类
氢氧化物制备及性质分析
Fe2+和Fe3+转化
总结思想方法
铁化合物
广泛存在
实验设计
实验探究
总结提升
分类观
元素观
应用
形成学习
元素化合物
的一般方法
据类别
分析通性
氧还性
转化观
氧还原理
应用
教学过程的设计
环节5
应用
解释
现象
化学到
生活
从生活走进化学
“维C和补血剂搭档更好”
情境引入
问题导入:
1.你知道哪些铁化合物?写出它们的化学式。
2.分析化学式有哪些异同?
3.根据物质分类和化合价不同建立一个二维坐标图(加入Fe)。
单质
氧化物
碱
盐
0
+2
+3
Fe
FeO
Fe2O3
Fe(OH)2
Fe(OH)3
FeSO4
FeCl3
设计意图:学生已知与所学概念理论建立联系
环节1:铁化合物分类
氧还性
物质通性
FeCl2
Fe2(SO4)3
学生学案
你知道哪些常见的铁的化合物?写出它们的化学式。
依据你的分类,建立一个二维坐标图(加入Fe)
设计意图:
Fe(OH)3
Fe(OH)2
Fe2O3
FeCl3
Fe3O4
FeO
FeO
FeSO4
铁及其化合物
查阅资料:
Fe(OH)2 :白色不溶于水
Fe(OH)3 :红褐色不溶于水
Fe3+ :遇硫氰化钾KSCN呈血红色
Fe2+ :遇硫氰化钾KSCN不呈血红色
Fe3+ :黄色
Fe2+ :浅绿色
K3[Fe(CN)6]:铁氰化钾,俗称黄血盐,遇到Fe2+生成深蓝色沉淀。
氧化剂:氯水有效成分Cl2 ,溶液颜色为黄绿色。高锰酸钾KMnO4溶液颜色为紫色,Mn2+颜色为无色
铁的化合物种类多,物质颜色丰富,提供资料,降低学生学习的难度
分类观:物质类别——通性
碱性氧化物性质
FeO+2H+=Fe2++H2O
Fe2O3+6H+=2Fe3++3H2O
2.不溶性碱 (1)性质
2Fe(OH)3 = Fe2O3 + 3H2O
碱性
不稳定性
△
Fe(OH)2 + 2H+ = Fe2+ + 2H2O
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
2Fe(OH)2 = ?
物质转化:氧化物——盐
物质转化:碱——盐
物质转化:碱——氧化物
△
学生填写学案
环节2:铁的氢氧化物制备
2. 氢氧化物制备 物质转化:盐——碱
1.实验设计——物质制备
①提出问题:如何制备Fe(OH)2、Fe(OH)3?
②方案设计:
③填观察表
④小组汇报
19
实验报告 氢氧化铁 氢氧化亚铁
制备原理 (离子方程式)
现象
④每个小组汇报自己的结果,归纳结论。
③填观察表
学生学案
20
Fe3++3OH-= Fe(OH)3↓(红褐色沉淀)
Fe2++2OH-= Fe(OH)2↓ (白色沉淀)
发现异常——引发思考
现象: 白 → 灰绿 → 红褐
21
⑤引导思考
⑴为什么没有得到预想中的白色沉淀Fe(OH)2?
⑵如何制得较为纯净的Fe(OH)2呢?问题的关键是什么?如何避免呢?(课后思考题)
FeSO4
NaOH溶液
植物油
加入固体NaOH
22
分析“异常”原因
FeCl2
Fe (OH) 2
Fe (OH) 3
NaOH 溶液
O2 H2O
Fe 3+
O2
NaOH 溶液
物质转化:化合价变化——氧化还原反应
?
铁为变价金属元素
Fe 3+ 的检验方法:KSCN溶液
23
3、铁盐和亚铁盐
方法二:(特效试剂)滴加KSCN溶液,溶液
变为红色
(1)Fe3+的检验
硫氰化钾(KSCN=K+ +SCN- )
Fe3+ +3SCN- = Fe(SCN)3
血红色溶液
方法一:加入NaOH溶液,出现红褐色沉淀
此反应十分灵敏,KSCN溶液是检验Fe3+的存在的特效试剂
小结:Fe3+的检验方法
24
2、实验探究 ---- Fe2+、Fe3+间的相互转化
②方案设计:实验中学生可能采用的实验方案
①提出问题:Fe2+、Fe3+氧化还原性如何?
根据氧化还原知识
利用已学知识说明 Fe2+有氧化性
设计并实验验证 Fe2+有还原性
设计并实验验证 Fe3+有还原性
环节3:Fe2+、Fe3+相互间的转化
Fe2+
Fe2+有还原性
KSCN溶液
观察
Cl2
观察
Fe2+有氧化性
Fe3+
KSCN溶液
观察
足量Fe
观察
Fe3+
KSCN溶液
观察
足量Fe
观察
25
Fe2+有氧化性
Fe3+
KSCN溶液
观察
足量Fe
观察
Fe3+
KSCN溶液
观察
足量Fe
观察
26
④每个小组汇报自己的结果,归纳结论。
③填观察表
转化目标 所选试剂 实验方案 预期现象 实验现象 结论
FeCl2→FeCl3
FeCl3→FeCl2
学生学案
27
(2)Fe2+的检验
方法一:加入NaOH溶液,生成白色絮状沉淀,该沉淀迅速变成灰绿色,最后变成红褐色。
方法二:滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变为血红色。
小结:Fe2+的检验方法
28
资料:
方法三:特效试剂K3[Fe(CN)6](称为铁氰化钾,俗称赤血盐,它可溶于水,水溶液带有黄绿色荧光。
)
在酸性环境中,遇亚Fe2+生成深蓝色沉淀。
赤血盐溶液遇到Fe2+离子,立即生成名为普鲁士蓝(Prussian blue)的深蓝色沉淀,其化学式为KFe[Fe(CN)6]六氰合亚铁酸铁钾:
铁氰化钾
铁氰化钾溶液
29
⑤引导思考
⑴你设计Fe2+和Fe3+相互转化选择试剂的依据是什么?
⑵你如何判断Fe2+和Fe3+之间发生了转化?
③填观察表
④每个小组汇报
Fe2+
(还原性)
产物
(检测产物)
氧化剂
Fe3+
(氧化性)
产物
(检测产物)
还原剂
环节4:总结思想、方法
30
总结研究物质氧还性的一般方法
分析元素化合价
预测氧化还原性
选择合适试剂
设计实验方案
实验、观察现象
(验证产物存在)
分析讨论现象
得出结论
修改、完善
31
(3)小结:Fe 、Fe2+ 、Fe3+的相互转化
Fe
Fe2+
Fe3+
H+
Cl2 、KMnO4
Fe
Zn
Fe
Fe2+
Fe3+
氧化剂
氧化剂
还原剂
还原剂
32
出口?
单质
氧化物
碱
盐
0
+2
+3
Fe
FeO
Fe2O3
Fe(OH)2
Fe(OH)3
FeCl3
氧还性
物质通性
FeCl2
回顾学习过程:
Fe元素→铁化合物
元素化合价→氧化还原性
元素组成→物质分类→通性
化学性质
(物质转化)
Fe3O4
2Fe(OH)2 = ?
△
点
线
面
各种转化反应
分类观
转化观
研究元素化合物的一般方法
34
从化学走向社会-----用化学解释生产、生活的中现象
了解FeCl3制作印刷电路板制作过程:
先在塑料板上镀上一层铜,然后在设计好的铜线路上涂上一层石蜡,把板浸到氯化铁溶液中,没有在线路上的铜即没有被石蜡覆盖住的铜就被反应掉。
请说出其中发生的反应原理,写出化学方程式。
书后习题资料的使用63页10题:印刷电路板……
“维C和补血剂(琥珀酸亚铁)搭档更好”
35
从化学走向社会-----用化学解释生产、生活的中现象
为何茶水变墨水?推测这种自来水中含什么离子?如何用你所学的知识进行验证?
茶水变墨水?
墨水变茶水?
请解释实验室配制FeSO4溶液时加铁粉的作用。
课后作业1
从化学走向社会-----用化学解释生产、生活的中现象
37
4
教学反思
1.以回忆、复习方式引入新课,使学生已有知识系统化,有利于新知识的学习。
2.元素化合物的教学变物质中心模式为以元素为核心的教学,更具有普遍性。
3.形成研究物质氧化还原性的一般方法,指导学生其他元素化合物的学习。
4.氢氧化亚铁制备实验和探究实验要详略得当,有所侧重。
感谢聆听
