1.2.1电解质的电离 课件(共17张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2.1电解质的电离 课件(共17张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 308.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-25 22:48:11 | ||
图片预览





文档简介
(共17张PPT)
第一章 物质及其变化
第二节 离子反应
第1课时 电解质的电离
新课导入
给电器设备充电的时候,湿手操作容易发生触电事故,这是为什么呢?
新课讲授
1、电解质:在水溶液中或熔融状态下能够导电的化合物
一、电解质与非电解质
电解质
酸:HCl、H2SO4、HNO3等
碱:NaOH、Ca(OH)2等
盐:NaCl、BaCO3等
金属氧化物:Na2O、CuO等
水:H2O
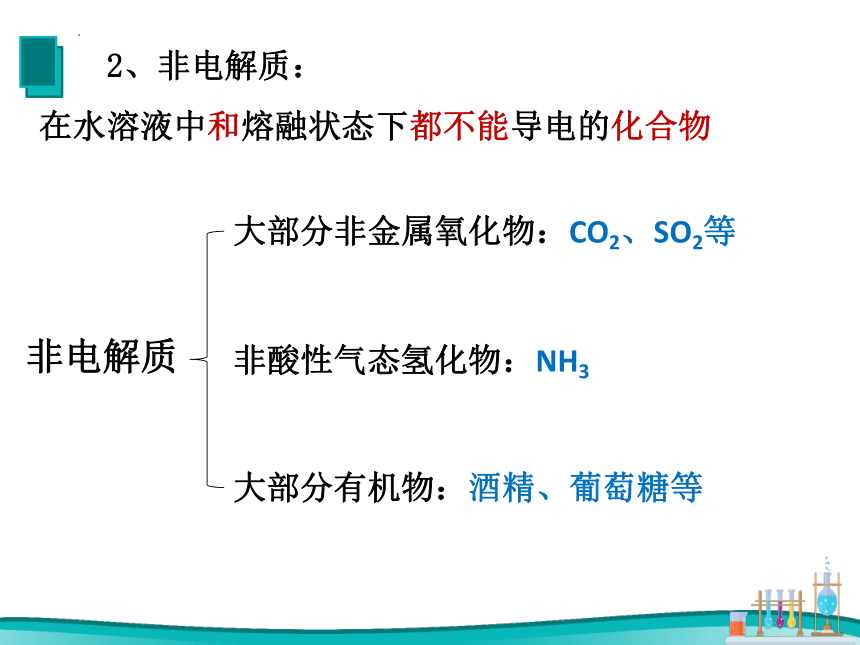
2、非电解质:
在水溶液中和熔融状态下都不能导电的化合物
非电解质
非酸性气态氢化物:NH3
大部分有机物:酒精、葡萄糖等
大部分非金属氧化物:CO2、SO2等
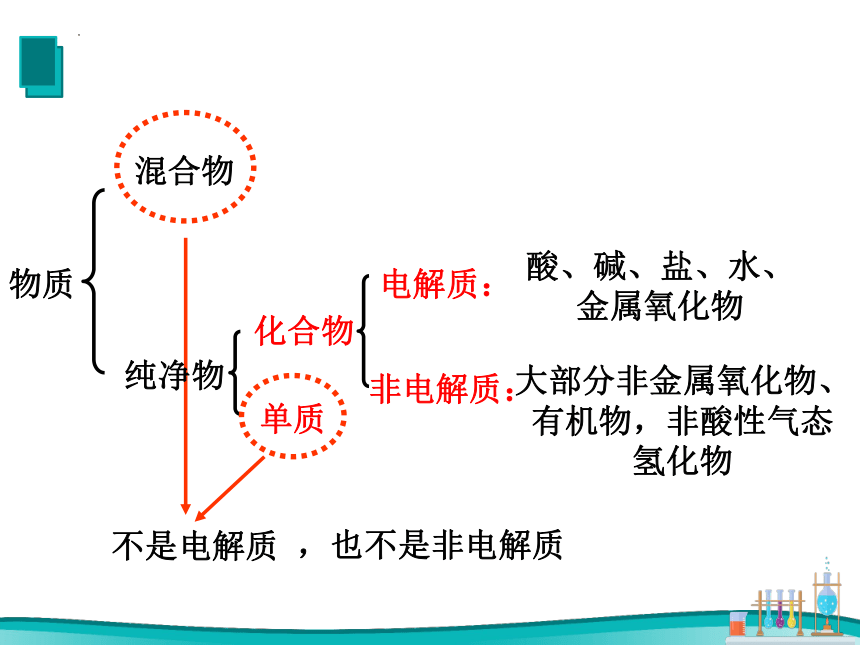
物质
混合物
纯净物
化合物
单质
电解质:
非电解质:
不是电解质
,也不是非电解质
酸、碱、盐、水、金属氧化物
大部分非金属氧化物、有机物,非酸性气态氢化物
给电器设备充电的时候,湿手操作容易发生触电事故,这是为什么呢?
人的手上常会沾有NaCl(汗液的成分之一),或者沾有其他电解质,当遇到水时,形成电解质溶液。电解质溶液能够导电。
为什么NaCl、KNO3等电解质,在干燥时不导电,而溶于水或熔化后却能导电呢?
电解质在水溶液里或受热熔化时发生了电离,电离出能够自由移动的阴阳离子,阴阳离子在电场的作用下发生定向移动。
二、电解质的电离
1.电离:电解质溶于水或受热熔化时,形成自由移动的离子的过程。
2.电离方程式:
NaCl = Na+ + Cl-
用化学式和离子符号表示电解质电离过程的式子
Al2 (SO4)3
(1)阴阳离子部分拆开写,但原子团不能拆。
如NO3-、SO42-、OH-、NH4+、CO32-等不能拆。
(2)构成物质的原子或原子团的个数在书写成离子时为系数。离子所带的电荷数应等于元素或原子团的化合价数。
2Al3+ +3SO42-
2.书写注意事项
(2)电荷守恒,即阳离子所带正电荷总数等于阴离子所带负电荷总数
弱酸的酸式酸根不拆开
如:NaHCO3 Na+ + HCO3-
强酸的酸式酸根拆成离子形式
如: NaHSO4 Na+ + H+ + SO42-
(在熔融状态下不能拆开)
(3)部分酸式盐在水溶液中的电离:
三、从电离的角度认识酸、碱、盐
1.写出下列酸的电离方程式:
HCl 、HNO3、H2SO4
H2SO4 ==== 2 H+ + SO42-
HCl ==== H+ + Cl-
HNO3 ==== H+ + NO3-
▲酸:电离时生成的阳离子全部是H+的化合物。
2.写出下列碱的电离方程式:
NaOH , KOH , Ba(OH)2
NaOH ==== Na+ + OH-
▲碱:电离时生成的阴离子全部是OH-的化合物。
Ba(OH)2 ==== Ba2+ + 2 OH-
KOH ==== K+ + OH-
3.写出下列盐的电离方程式:
NaCl , KNO3 , Fe2(SO4)3 , NaHSO4
NaCl ==== Na+ + Cl-
▲盐:电离时能生成金属离子和酸根离子的化合物。
KNO3 ==== K+ + NO3-
Fe2(SO4)3==== 2Fe3+ +3SO42-
NaHSO4==== Na+ + H+ + SO42-
包括铵根离子
化合物
酸:电离时生成的阳离子全部是H+的化合物
碱:电离时生成的阴离子全部是OH-的化合物
盐:电离时,能生成金属阳离子(铵根离子)和酸根离子的化合物的化合物
1.下列物质中,属于电解质的是_____________。
①盐酸 ② O2 ③Na2CO3 ④蔗糖
⑤ AgCl ⑥Ca(OH)2 ⑦HNO3
电解质:首先是化合物,再考虑在溶液和熔融状态下能否有自由移动的离子
③ ⑤ ⑥ ⑦
巩固提高
2.下列物质中,能导电的是___________。
①盐酸 ②干冰 ③石墨 ④熔融KCl ⑤ Cu ⑥Na2CO3粉末 ⑦蔗糖 ⑧ CuSO4·5H2O
导电性关键看有无自由移动的离子或自由电子
①③④⑤
2.写出下列物质在水溶液中的电离方程式:
(1)氢氧化钡
(2)碳酸氢铵
第一章 物质及其变化
第二节 离子反应
第1课时 电解质的电离
新课导入
给电器设备充电的时候,湿手操作容易发生触电事故,这是为什么呢?
新课讲授
1、电解质:在水溶液中或熔融状态下能够导电的化合物
一、电解质与非电解质
电解质
酸:HCl、H2SO4、HNO3等
碱:NaOH、Ca(OH)2等
盐:NaCl、BaCO3等
金属氧化物:Na2O、CuO等
水:H2O
2、非电解质:
在水溶液中和熔融状态下都不能导电的化合物
非电解质
非酸性气态氢化物:NH3
大部分有机物:酒精、葡萄糖等
大部分非金属氧化物:CO2、SO2等
物质
混合物
纯净物
化合物
单质
电解质:
非电解质:
不是电解质
,也不是非电解质
酸、碱、盐、水、金属氧化物
大部分非金属氧化物、有机物,非酸性气态氢化物
给电器设备充电的时候,湿手操作容易发生触电事故,这是为什么呢?
人的手上常会沾有NaCl(汗液的成分之一),或者沾有其他电解质,当遇到水时,形成电解质溶液。电解质溶液能够导电。
为什么NaCl、KNO3等电解质,在干燥时不导电,而溶于水或熔化后却能导电呢?
电解质在水溶液里或受热熔化时发生了电离,电离出能够自由移动的阴阳离子,阴阳离子在电场的作用下发生定向移动。
二、电解质的电离
1.电离:电解质溶于水或受热熔化时,形成自由移动的离子的过程。
2.电离方程式:
NaCl = Na+ + Cl-
用化学式和离子符号表示电解质电离过程的式子
Al2 (SO4)3
(1)阴阳离子部分拆开写,但原子团不能拆。
如NO3-、SO42-、OH-、NH4+、CO32-等不能拆。
(2)构成物质的原子或原子团的个数在书写成离子时为系数。离子所带的电荷数应等于元素或原子团的化合价数。
2Al3+ +3SO42-
2.书写注意事项
(2)电荷守恒,即阳离子所带正电荷总数等于阴离子所带负电荷总数
弱酸的酸式酸根不拆开
如:NaHCO3 Na+ + HCO3-
强酸的酸式酸根拆成离子形式
如: NaHSO4 Na+ + H+ + SO42-
(在熔融状态下不能拆开)
(3)部分酸式盐在水溶液中的电离:
三、从电离的角度认识酸、碱、盐
1.写出下列酸的电离方程式:
HCl 、HNO3、H2SO4
H2SO4 ==== 2 H+ + SO42-
HCl ==== H+ + Cl-
HNO3 ==== H+ + NO3-
▲酸:电离时生成的阳离子全部是H+的化合物。
2.写出下列碱的电离方程式:
NaOH , KOH , Ba(OH)2
NaOH ==== Na+ + OH-
▲碱:电离时生成的阴离子全部是OH-的化合物。
Ba(OH)2 ==== Ba2+ + 2 OH-
KOH ==== K+ + OH-
3.写出下列盐的电离方程式:
NaCl , KNO3 , Fe2(SO4)3 , NaHSO4
NaCl ==== Na+ + Cl-
▲盐:电离时能生成金属离子和酸根离子的化合物。
KNO3 ==== K+ + NO3-
Fe2(SO4)3==== 2Fe3+ +3SO42-
NaHSO4==== Na+ + H+ + SO42-
包括铵根离子
化合物
酸:电离时生成的阳离子全部是H+的化合物
碱:电离时生成的阴离子全部是OH-的化合物
盐:电离时,能生成金属阳离子(铵根离子)和酸根离子的化合物的化合物
1.下列物质中,属于电解质的是_____________。
①盐酸 ② O2 ③Na2CO3 ④蔗糖
⑤ AgCl ⑥Ca(OH)2 ⑦HNO3
电解质:首先是化合物,再考虑在溶液和熔融状态下能否有自由移动的离子
③ ⑤ ⑥ ⑦
巩固提高
2.下列物质中,能导电的是___________。
①盐酸 ②干冰 ③石墨 ④熔融KCl ⑤ Cu ⑥Na2CO3粉末 ⑦蔗糖 ⑧ CuSO4·5H2O
导电性关键看有无自由移动的离子或自由电子
①③④⑤
2.写出下列物质在水溶液中的电离方程式:
(1)氢氧化钡
(2)碳酸氢铵
