3.1氯气的发现与制备 课件(共33张PPT)高中化学苏教版必修第一册 专题三
文档属性
| 名称 | 3.1氯气的发现与制备 课件(共33张PPT)高中化学苏教版必修第一册 专题三 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-26 23:21:03 | ||
图片预览











文档简介
(共33张PPT)
第一单元 氯气及氯的化合物
第1课时 氯气的发现与制备
课标定位素养阐释
1.能够掌握氯气的实验室制法,建立常见气体制备认知模型。
2.能够说出氯气的工业制法。
3. 通过对实验现象进行宏观辨识和微观探析,提升实验探究能力。
一、氯气的实验室制法
1.海水中蕴含丰富的氯元素,主要以氯化钠、氯化镁、氯化钙、氯化钾等形式存在。
2.氯气的化学性质非常活泼,在自然界中不存在游离态的氯,都以化合态的形式存在。
3.氯气的发现:
1774年由瑞典化学家舍勒意外发现,1810年由英国化学家
戴维仔细研究并命名。
4.氯气的实验室制法。
(1)反应原理:
实验室用MnO2与浓盐酸加热反应制取Cl2,反应的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
(2)实验装置:
二、氯气的工业制法
以电解饱和食盐水为基础制取氯气、烧碱等产品的工业称为氯碱工业。
1.氯气的制备原理:反应的化学方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
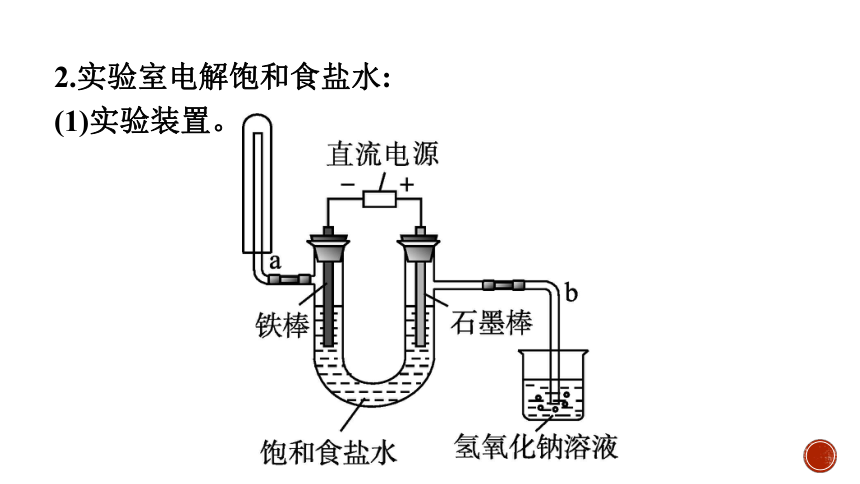
2.实验室电解饱和食盐水:
(1)实验装置。
(2)实验现象。
①接通电源,片刻后,U形管两端电极上都有气泡产生,并且不断增多。
②通电一段时间,然后用小试管套在a管上,收集U形管左端产生的气体。2 min后,提起小试管,并迅速用拇指堵住试管口,移近点燃的酒精灯,松开拇指,发出轻微的爆鸣声,说明产生的气体是氢气。
③取一支小试管,用向上排空气法收集从b管导出的气体,气体呈黄绿色。
④关闭电源,打开U形管两端的橡皮塞,分别向溶液中滴加1~2滴酚酞溶液,U形管右端无明显变化,左端溶液变红。
(3)反应产物。
①与电源正极相连的石墨棒(阳极)上产生氯气。
②与电源负极相连的铁棒(阴极)上产生氢气,电解后的溶液中含有氢氧化钠。
【效果自测】
1.实验室用下列两种方法制氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量的浓盐酸反应。所得的氯气( )。
A.①比②多 B.②比①多
C.一样多 D.无法比较
答案:B
解析:146 g HCl的物质的量为4 mol,87 g MnO2的物质的量为1 mol,根据化学方程式:MnO2+4HCl(浓) MnCl2+Cl2↑ +2H2O可知,1 mol MnO2可以与4 mol HCl反应,但是随反应进行浓盐酸变为稀盐酸,而稀盐酸与MnO2不反应,也就是说1 mol MnO2与足量浓盐酸反应生成的Cl2多。
2.下列有关说法错误的是( )。
A.“氯碱工业”是用直流电对精制饱和氯化钠溶液进行电解
B.根据氯碱工业的原理,电解氯化钾溶液的反应为2KCl+2H2O 2KOH+Cl2↑+H2↑
C.氯碱工业产生两种气体,一种无色,一种为黄绿色
D.电解饱和食盐水时,氯气和氢氧化钠溶液都在与电源正极相连的石墨棒上生成
答案:D
解析:电解饱和食盐水时,与电源正极相连的石墨棒(阳极)上产生氯气,D项不正确。
问题引领
气体制备实验时反应装置的选择,依据的是原料的状态和反应的条件。
探究任务 氯气的实验室制法
1.上述三种装置分别适用制备什么类型的气体 哪种装置更适合利用MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O制备氯气
提示:装置A适用于“固体+固体 气体”;装置C适用于“固体(或液体)+液体→气体”;装置B适用于“固体(或液体)+液体
气体”。装置B更适合实验室制氯气。
2.利用你选择的装置制取的氯气是纯净的氯气吗 若不是,为什么 用什么试剂来除杂 并画出除杂装置。
提示:不是。由于浓盐酸易挥发,氯气
中的杂质气体有HCl、水蒸气,因此无
法收集到纯净干燥的氯气。因为HCl极
易溶于水,而氯气在饱和食盐水中溶解
度很小,所以先用饱和食盐水除去HCl,
再用浓硫酸进行干燥,就可获得纯净干
燥的氯气。除杂装置如图所示:
归纳提升
氯气的实验室制法:
1.试剂的选择。
通常选用浓盐酸与MnO2来制取Cl2,也可用浓盐酸与KMnO4、KClO3等来制取。如
2.发生装置。
选取发生装置的依据是制取气体所用试剂的状态和反应条件(加热与否)。
如用MnO2与浓盐酸制氯气,采用固液加热装置制气体;若用KMnO4与浓盐酸制氯气采用固液不加热装置制气体。主要仪器为分液漏斗和圆底烧瓶。
3.净化装置。
实验室制取的氯气常混有HCl气体和水蒸气。为得到干燥纯净的氯气,需要除杂。因为氯气在饱和食盐水中溶解度很小,而HCl气体易溶于水,所以通过装有饱和食盐水的洗气瓶(导气管长进短出),除去其中的HCl。通过装有浓硫酸的洗气瓶(导气管长进短出),除去其中的水蒸气,得到干燥氯气。
选择气体干燥剂的主要依据是被干燥的气体不能与干燥剂反应。
因为碱石灰的主要成分是氢氧化钠和生石灰,氯气能与碱反应,所以不能用碱石灰干燥。常用浓硫酸、五氧化二磷等进行干燥。
4.收集方法。
选用收集方法的主要依据是气体的密度和在水中的溶解性。
因为氯气能溶于水,密度比空气的大,所以收集氯气时,不能用排水法,应该用向上排空气法。Cl2在饱和食盐水中的溶解度较小,也可用排饱和食盐水法收集Cl2。
5.尾气处理装置。
氯气有毒,实验室制取氯气时应在通风橱中进行,通常在收集装置的后面连接盛有NaOH溶液的吸收装置,反应的化学方程式是Cl2+2NaOH══NaCl+NaClO+H2O。
6.验满。
常用湿润的淀粉碘化钾试纸或湿润的蓝色石蕊试纸检验Cl2。
方法是将湿润的淀粉碘化钾试纸靠近集气瓶瓶口,试纸变蓝,或将湿润的蓝色石蕊试纸靠近集气瓶瓶口,试纸先变红后褪色,则可证明Cl2已收集满。
易错提醒:(1)使用浓盐酸与足量的MnO2共热制Cl2,实际产生的Cl2总比理论值低,其原因是随着反应的进行,盐酸的浓度变小,MnO2与稀盐酸不反应,故生成的Cl2
小于理论值。
(2)不能用盐酸来酸化高锰酸钾,一般用稀硫酸来酸化。
(3)实验室处理尾气时一般不用澄清石灰水,因为澄清石灰水中Ca(OH)2浓度太小,Cl2吸收不完全。
典型例题
【例题】 某学生设计了如图所示的实验装置用于制备纯净的Cl2。
(1)装置中有五处错误,请指出:
① ;
② ;
③ ;
④ ;
⑤ 。
(2)在更正后的装置图中,洗气瓶(净化气体)中的饱和食盐水、浓硫酸、氢氧化钠溶液的作用分别是:
①饱和食盐水的作用: ;
②浓硫酸的作用: ;
③氢氧化钠溶液的作用: 。
答案:(1)①用长颈漏斗错误,应用分液漏斗 ②不能用稀盐酸,应用浓盐酸 ③没有用酒精灯,应用酒精灯加热 ④盛浓硫酸的洗气瓶和盛饱和食盐水的洗气瓶位置颠倒,应更换位置 ⑤盛饱和食盐水的洗气瓶中的进气导管未插入液面以下,出气导管不应插入液面以下 (2)①除去混在氯气中的HCl ②除去混在氯气中的H2O ③吸收氯气,防止其污染空气
解析:从实验原理上来说,氯气是用浓盐酸与二氧化锰在加热的条件下制取得到的,不能用稀盐酸,稀盐酸与二氧化锰不反应;制得的氯气中混有HCl和水蒸气,应依次通过盛有饱和食盐水和浓硫酸的洗气瓶将其除去;因氯气有毒,应用尾气吸收装置,以避免对环境的污染;因氯气的密度比空气大,应用向上排空气法收集。
【变式训练】 某课外活动小组利用如图所示装置制取氯气,提供的试剂:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体、水。反应的化学方程式为2KMnO4+16HCl(浓)══2KCl+2MnCl2+5Cl2↑+8H2O。
(1)装置M中盛放的试剂是 ;H中盛放的试剂是 。
(2)收集Cl2时,关闭弹簧夹 和弹簧夹 ,打开弹簧夹 。
(3)尾气处理时,关闭弹簧夹a和弹簧夹 ,打开弹簧夹 。处理尾气选用的试剂为 。
(4)用含0.032 mol HCl的浓盐酸与足量高锰酸钾固体反应,产生Cl2的物质的量应 (填“大于”“等于”或“小于”)0.01 mol。
答案:(1)浓盐酸 饱和食盐水
(2)a c b
(3)b c 氢氧化钠溶液
(4)小于
解析:(1)装置M中应为浓盐酸,G中应为高锰酸钾固体,H中应为饱和食盐水,装置P是尾气处理装置,烧杯中的试剂是氢氧化钠溶液。(2)收集Cl2时,先关闭弹簧夹a和c,打开弹簧夹b,生成的Cl2会将饱和食盐水压入烧杯D中,从而使Cl2收集在H中。(3)尾气处理时关闭弹簧夹a和弹簧夹b,打开弹簧夹c,多余的Cl2就会被P中的氢氧化钠溶液吸收。(4)根据化学方程式可知,若含0.032 mol HCl的浓盐酸完全反应会生成0.01 mol Cl2,但随着反应的进行,浓盐酸变稀,稀盐酸不参与反应,从而使参与反应的HCl小于0.032 mol,故生成的氯气的物质的量应小于0.01 mol。
第一单元 氯气及氯的化合物
第1课时 氯气的发现与制备
课标定位素养阐释
1.能够掌握氯气的实验室制法,建立常见气体制备认知模型。
2.能够说出氯气的工业制法。
3. 通过对实验现象进行宏观辨识和微观探析,提升实验探究能力。
一、氯气的实验室制法
1.海水中蕴含丰富的氯元素,主要以氯化钠、氯化镁、氯化钙、氯化钾等形式存在。
2.氯气的化学性质非常活泼,在自然界中不存在游离态的氯,都以化合态的形式存在。
3.氯气的发现:
1774年由瑞典化学家舍勒意外发现,1810年由英国化学家
戴维仔细研究并命名。
4.氯气的实验室制法。
(1)反应原理:
实验室用MnO2与浓盐酸加热反应制取Cl2,反应的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
(2)实验装置:
二、氯气的工业制法
以电解饱和食盐水为基础制取氯气、烧碱等产品的工业称为氯碱工业。
1.氯气的制备原理:反应的化学方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
2.实验室电解饱和食盐水:
(1)实验装置。
(2)实验现象。
①接通电源,片刻后,U形管两端电极上都有气泡产生,并且不断增多。
②通电一段时间,然后用小试管套在a管上,收集U形管左端产生的气体。2 min后,提起小试管,并迅速用拇指堵住试管口,移近点燃的酒精灯,松开拇指,发出轻微的爆鸣声,说明产生的气体是氢气。
③取一支小试管,用向上排空气法收集从b管导出的气体,气体呈黄绿色。
④关闭电源,打开U形管两端的橡皮塞,分别向溶液中滴加1~2滴酚酞溶液,U形管右端无明显变化,左端溶液变红。
(3)反应产物。
①与电源正极相连的石墨棒(阳极)上产生氯气。
②与电源负极相连的铁棒(阴极)上产生氢气,电解后的溶液中含有氢氧化钠。
【效果自测】
1.实验室用下列两种方法制氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量的浓盐酸反应。所得的氯气( )。
A.①比②多 B.②比①多
C.一样多 D.无法比较
答案:B
解析:146 g HCl的物质的量为4 mol,87 g MnO2的物质的量为1 mol,根据化学方程式:MnO2+4HCl(浓) MnCl2+Cl2↑ +2H2O可知,1 mol MnO2可以与4 mol HCl反应,但是随反应进行浓盐酸变为稀盐酸,而稀盐酸与MnO2不反应,也就是说1 mol MnO2与足量浓盐酸反应生成的Cl2多。
2.下列有关说法错误的是( )。
A.“氯碱工业”是用直流电对精制饱和氯化钠溶液进行电解
B.根据氯碱工业的原理,电解氯化钾溶液的反应为2KCl+2H2O 2KOH+Cl2↑+H2↑
C.氯碱工业产生两种气体,一种无色,一种为黄绿色
D.电解饱和食盐水时,氯气和氢氧化钠溶液都在与电源正极相连的石墨棒上生成
答案:D
解析:电解饱和食盐水时,与电源正极相连的石墨棒(阳极)上产生氯气,D项不正确。
问题引领
气体制备实验时反应装置的选择,依据的是原料的状态和反应的条件。
探究任务 氯气的实验室制法
1.上述三种装置分别适用制备什么类型的气体 哪种装置更适合利用MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O制备氯气
提示:装置A适用于“固体+固体 气体”;装置C适用于“固体(或液体)+液体→气体”;装置B适用于“固体(或液体)+液体
气体”。装置B更适合实验室制氯气。
2.利用你选择的装置制取的氯气是纯净的氯气吗 若不是,为什么 用什么试剂来除杂 并画出除杂装置。
提示:不是。由于浓盐酸易挥发,氯气
中的杂质气体有HCl、水蒸气,因此无
法收集到纯净干燥的氯气。因为HCl极
易溶于水,而氯气在饱和食盐水中溶解
度很小,所以先用饱和食盐水除去HCl,
再用浓硫酸进行干燥,就可获得纯净干
燥的氯气。除杂装置如图所示:
归纳提升
氯气的实验室制法:
1.试剂的选择。
通常选用浓盐酸与MnO2来制取Cl2,也可用浓盐酸与KMnO4、KClO3等来制取。如
2.发生装置。
选取发生装置的依据是制取气体所用试剂的状态和反应条件(加热与否)。
如用MnO2与浓盐酸制氯气,采用固液加热装置制气体;若用KMnO4与浓盐酸制氯气采用固液不加热装置制气体。主要仪器为分液漏斗和圆底烧瓶。
3.净化装置。
实验室制取的氯气常混有HCl气体和水蒸气。为得到干燥纯净的氯气,需要除杂。因为氯气在饱和食盐水中溶解度很小,而HCl气体易溶于水,所以通过装有饱和食盐水的洗气瓶(导气管长进短出),除去其中的HCl。通过装有浓硫酸的洗气瓶(导气管长进短出),除去其中的水蒸气,得到干燥氯气。
选择气体干燥剂的主要依据是被干燥的气体不能与干燥剂反应。
因为碱石灰的主要成分是氢氧化钠和生石灰,氯气能与碱反应,所以不能用碱石灰干燥。常用浓硫酸、五氧化二磷等进行干燥。
4.收集方法。
选用收集方法的主要依据是气体的密度和在水中的溶解性。
因为氯气能溶于水,密度比空气的大,所以收集氯气时,不能用排水法,应该用向上排空气法。Cl2在饱和食盐水中的溶解度较小,也可用排饱和食盐水法收集Cl2。
5.尾气处理装置。
氯气有毒,实验室制取氯气时应在通风橱中进行,通常在收集装置的后面连接盛有NaOH溶液的吸收装置,反应的化学方程式是Cl2+2NaOH══NaCl+NaClO+H2O。
6.验满。
常用湿润的淀粉碘化钾试纸或湿润的蓝色石蕊试纸检验Cl2。
方法是将湿润的淀粉碘化钾试纸靠近集气瓶瓶口,试纸变蓝,或将湿润的蓝色石蕊试纸靠近集气瓶瓶口,试纸先变红后褪色,则可证明Cl2已收集满。
易错提醒:(1)使用浓盐酸与足量的MnO2共热制Cl2,实际产生的Cl2总比理论值低,其原因是随着反应的进行,盐酸的浓度变小,MnO2与稀盐酸不反应,故生成的Cl2
小于理论值。
(2)不能用盐酸来酸化高锰酸钾,一般用稀硫酸来酸化。
(3)实验室处理尾气时一般不用澄清石灰水,因为澄清石灰水中Ca(OH)2浓度太小,Cl2吸收不完全。
典型例题
【例题】 某学生设计了如图所示的实验装置用于制备纯净的Cl2。
(1)装置中有五处错误,请指出:
① ;
② ;
③ ;
④ ;
⑤ 。
(2)在更正后的装置图中,洗气瓶(净化气体)中的饱和食盐水、浓硫酸、氢氧化钠溶液的作用分别是:
①饱和食盐水的作用: ;
②浓硫酸的作用: ;
③氢氧化钠溶液的作用: 。
答案:(1)①用长颈漏斗错误,应用分液漏斗 ②不能用稀盐酸,应用浓盐酸 ③没有用酒精灯,应用酒精灯加热 ④盛浓硫酸的洗气瓶和盛饱和食盐水的洗气瓶位置颠倒,应更换位置 ⑤盛饱和食盐水的洗气瓶中的进气导管未插入液面以下,出气导管不应插入液面以下 (2)①除去混在氯气中的HCl ②除去混在氯气中的H2O ③吸收氯气,防止其污染空气
解析:从实验原理上来说,氯气是用浓盐酸与二氧化锰在加热的条件下制取得到的,不能用稀盐酸,稀盐酸与二氧化锰不反应;制得的氯气中混有HCl和水蒸气,应依次通过盛有饱和食盐水和浓硫酸的洗气瓶将其除去;因氯气有毒,应用尾气吸收装置,以避免对环境的污染;因氯气的密度比空气大,应用向上排空气法收集。
【变式训练】 某课外活动小组利用如图所示装置制取氯气,提供的试剂:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体、水。反应的化学方程式为2KMnO4+16HCl(浓)══2KCl+2MnCl2+5Cl2↑+8H2O。
(1)装置M中盛放的试剂是 ;H中盛放的试剂是 。
(2)收集Cl2时,关闭弹簧夹 和弹簧夹 ,打开弹簧夹 。
(3)尾气处理时,关闭弹簧夹a和弹簧夹 ,打开弹簧夹 。处理尾气选用的试剂为 。
(4)用含0.032 mol HCl的浓盐酸与足量高锰酸钾固体反应,产生Cl2的物质的量应 (填“大于”“等于”或“小于”)0.01 mol。
答案:(1)浓盐酸 饱和食盐水
(2)a c b
(3)b c 氢氧化钠溶液
(4)小于
解析:(1)装置M中应为浓盐酸,G中应为高锰酸钾固体,H中应为饱和食盐水,装置P是尾气处理装置,烧杯中的试剂是氢氧化钠溶液。(2)收集Cl2时,先关闭弹簧夹a和c,打开弹簧夹b,生成的Cl2会将饱和食盐水压入烧杯D中,从而使Cl2收集在H中。(3)尾气处理时关闭弹簧夹a和弹簧夹b,打开弹簧夹c,多余的Cl2就会被P中的氢氧化钠溶液吸收。(4)根据化学方程式可知,若含0.032 mol HCl的浓盐酸完全反应会生成0.01 mol Cl2,但随着反应的进行,浓盐酸变稀,稀盐酸不参与反应,从而使参与反应的HCl小于0.032 mol,故生成的氯气的物质的量应小于0.01 mol。
