1.3.3元素周期表的应用 课件(共28张PPT)2022-2023学年高一下学期化学鲁科版(2019)必修第二册
文档属性
| 名称 | 1.3.3元素周期表的应用 课件(共28张PPT)2022-2023学年高一下学期化学鲁科版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 37.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-26 23:28:01 | ||
图片预览



文档简介
(共28张PPT)
第1章第3节 元素周期表的应用
鲁科版普通高中化学必修2
第3课时 预测元素及其化合物的性质
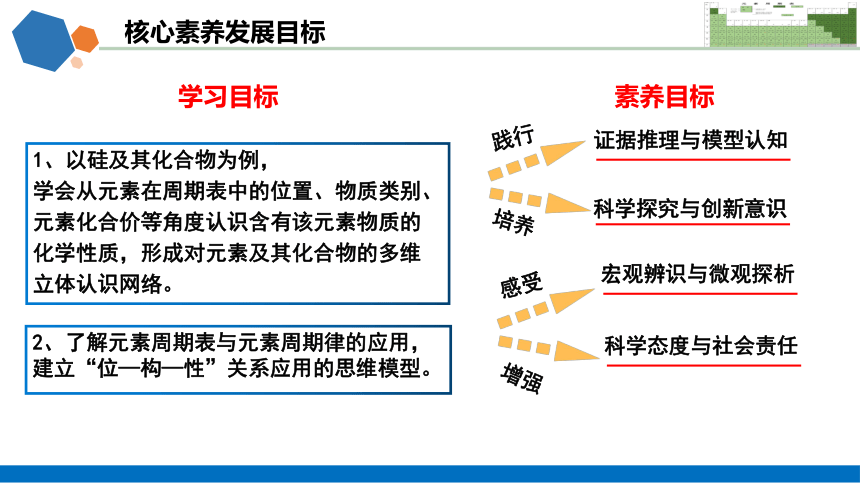
核心素养发展目标
1、以硅及其化合物为例,
学会从元素在周期表中的位置、物质类别、
元素化合价等角度认识含有该元素物质的
化学性质,形成对元素及其化合物的多维
立体认识网络。
2、了解元素周期表与元素周期律的应用,
建立“位—构—性”关系应用的思维模型。
践行
证据推理与模型认知
培养
科学探究与创新意识
感受
宏观辨识与微观探析
增强
科学态度与社会责任
学习目标
素养目标
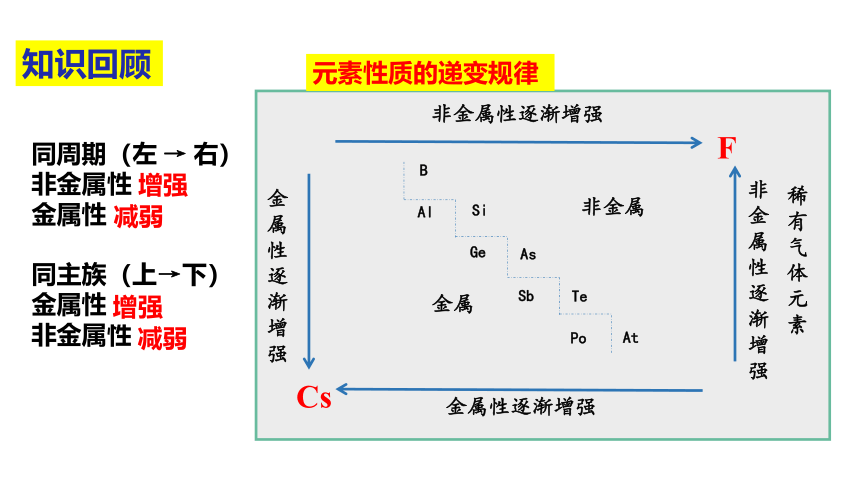
非金属性逐渐增强
金属性逐渐
增强
非金属性逐渐
增强
稀有气体元素
B
Al
Si
Ge
As
Sb
Te
Po
At
非金属
金属
金属性逐渐增强
F
Cs
同周期(左 → 右)
非金属性?
金属性?
同主族(上→下)
金属性?
非金属性?
元素性质的递变规律
知识回顾
增强
减弱
增强
减弱
方法导引
对于陌生元素,我们可以借助于已知元素的认识,
利用元素周期律以及对已知元素及其化合物性质的研究思路和方法,研究陌生元素及其化合物的性质。
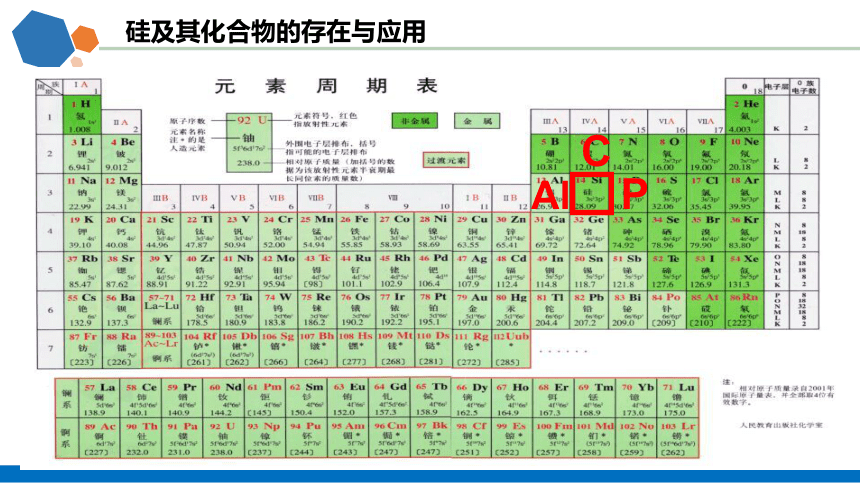
硅及其化合物的存在与应用
硅及其化合物的存在与应用
C
Al P
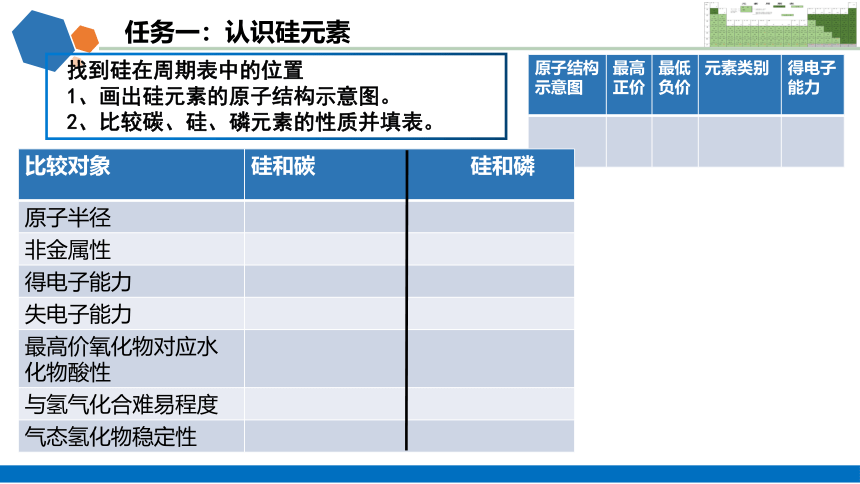
任务一:认识硅元素
找到硅在周期表中的位置
1、画出硅元素的原子结构示意图。
2、比较碳、硅、磷元素的性质并填表。
原子结构 示意图 最高正价 最低负价 元素类别 得电子
能力
比较对象 硅和碳 硅和磷
原子半径
非金属性
得电子能力
失电子能力
最高价氧化物对应水化物酸性
与氢气化合难易程度
气态氢化物稳定性
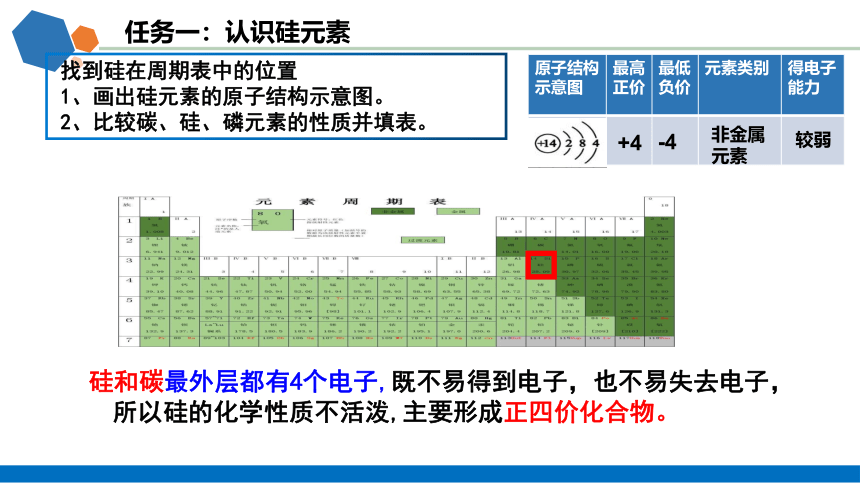
任务一:认识硅元素
找到硅在周期表中的位置
1、画出硅元素的原子结构示意图。
2、比较碳、硅、磷元素的性质并填表。
原子结构 示意图 最高正价 最低负价 元素类别 得电子
能力
+4
-4
非金属
元素
较弱
硅和碳最外层都有4个电子,既不易得到电子,也不易失去电子,所以硅的化学性质不活泼,主要形成正四价化合物。
任务一:认识硅元素
利用元素周期表
1、画出硅元素的原子结构示意图。
2、比较碳、硅、磷元素的性质并填表。
原子半径 硅和碳 硅和磷
原子半径
非金属性
得电子能力
失电子能力
最高价氧化物对应水化物酸性
与氢气化合难易程度
气态氢化物稳定性
硅>碳
硅<碳
硅<碳
硅>碳
H2SiO3<H2CO3
硅难于碳
SiH4<CH4
硅>磷
H2SiO3<H3PO4
硅难于磷
SiH4<PH3
硅<磷
硅<磷
硅>磷
任务二:认识含硅元素物质
3、硅及其化合物有哪些 尝试写出它们的化学式。
4、请预测硅及其化合物的化学性质,并说明预测依据。
任务二:认识含硅元素物质
硅及其化合物的化学性质预测及依据
硅及其化合物的化学式 化学性质预测 预测依据
Si(1组) ①…… ②…… ……
SiO2(2组)
H2SiO3(3组)
Na2SiO3(3组)
任务二:认识含硅元素物质
认识硅单质(单质--氧化物--酸--盐)
常温下:
与氢氟酸反应:Si+4HF === SiF4↑+2H2↑
与碱反应:Si+2NaOH+H2O === Na2SiO3+2H2↑
硅及其化合物的化学式 化学性质预测 预测依据
Si
①化学性质不活泼②有氧化性和还原性
③由于性质的特殊性,可能还具有独特的性质。
与碳同主族,与碳单质具有相似的化学性质。
任务二:认识含硅元素物质
认识硅单质(单质--氧化物--酸--盐)
硅及其化合物的化学式 化学性质预测 预测依据
SiO2
①具有酸性氧化物的通性,能与碱、碱性氧化物等发生反应②氧化性③可能具有一定的特性。
与碳同主族,与二氧化碳具有相似的化学性质。
(1)酸性氧化物(类似CO2)
(工业制粗硅)
SiO2+2C ==== Si+2CO↑
(2)氧化性(弱)
任务二:认识含硅元素物质
认识二氧化硅(单质--氧化物--酸--盐)
(3)特性(与氢氟酸反应)
SiO2 + 4HF === SiF4↑+ 2H2O (刻蚀玻璃)
HF
任务二:认识含硅元素物质
认识硅酸(单质--氧化物--酸--盐)
硅及其化合物的化学式 化学性质预测 预测依据
H2SiO3
①具有酸的性质,能与碱反应,但酸性较弱,酸性弱于碳酸、磷酸等
与碳同主族,与磷同周期,
非金属性弱于碳和磷
硅胶干燥剂
硅胶干燥剂是一种高微孔结构的高活性
吸附剂,通常用硅酸凝胶(H2SiO3)经老化
脱水等一系列处理过程而制得。
化学性质稳定,除强碱、氢氟酸外不和
任何物质发生反应。具强烈的吸湿性能。
广泛用于仪器仪表、设备机械、皮革箱包
食品药品等的贮存和运输中的防潮、防霉
和锈蚀。
任务二:认识含硅元素物质
认识硅酸(单质--氧化物--酸--盐)
硅及其化合物的化学式 化学性质预测 预测依据
H2SiO3
①具有酸的性质,能与碱反应,但酸性较弱,酸性弱于碳酸、磷酸等
与碳同主族,与磷同周期,
非金属性弱于碳和磷
硅胶干燥剂是一种高微孔结构的高活性
吸附剂,通常用硅酸凝胶(H2SiO3)经老化
脱水等一系列处理过程而制得。
化学性质稳定,除强碱、氢氟酸外不和
任何物质发生反应。具强烈的吸湿性能。
广泛用于仪器仪表、设备机械、皮革箱包
食品药品等的贮存和运输中的防潮、防霉
和锈蚀。
如何由二氧化硅制备硅酸凝胶?设计实验方案。
(约两滴管)
任务二:认识含硅元素物质
认识硅酸(单质--氧化物--酸--盐)
硅及其化合物的化学式 化学性质预测 预测依据
H2SiO3
①具有酸的性质,能与碱反应,但酸性较弱,酸性弱于碳酸、磷酸等
与碳同主族,与磷同周期,
非金属性弱于碳和磷
如何由二氧化硅制备硅酸凝胶?设计实验方案。
结论:可溶性硅酸盐和
较强酸反应制硅酸
(约两滴管)
任务二:认识含硅元素物质
认识硅酸(单质--氧化物--酸--盐)
硅及其化合物的化学式 化学性质预测 预测依据
H2SiO3
①具有酸的性质,能与碱反应,但酸性较弱,酸性弱于碳酸、磷酸等
与碳同主族,与磷同周期,
非金属性弱于碳和磷
如何证明硅酸酸性弱于碳酸?
通入二氧化碳
任务二:认识含硅元素物质
认识硅酸(单质--氧化物--酸--盐)
硅及其化合物的化学式 化学性质预测 预测依据
H2SiO3
①具有酸的性质,能与碱反应,但酸性较弱,酸性弱于碳酸、磷酸等
与碳同主族,与磷同周期,
非金属性弱于碳和磷
如何证明硅酸酸性弱于碳酸?设计实验方案。
任务二:认识含硅元素物质
认识硅酸(单质--氧化物--酸--盐)
硅及其化合物的化学式 化学性质预测 预测依据
Na2SiO3
白色固体,易溶于水,与比硅酸酸性强的一些酸反应,生成难溶于水的硅酸
属于弱酸的正盐,可与强酸反应生成硅酸
思维建模:预测陌生物质的性质
陌生
物质
核心
元素
元素位置
元素性质
物质性质
化合价
类别
元素周期表、周期律
预测Br2的化学性质。
Br
第四周期ⅦA族
Br2
拓展阅读
1930年美国化学家托马斯·米奇利成功地获得了一种新型的致冷剂——CCl2F2(即氟利昂)。这完全得益于元素周期表的指导。在1930年前,一些气体如氨,二氧化硫,氯乙烷和氯甲烷等,被相继用作致冷剂。但是,这些致冷剂不是有毒就是易燃,很不安全。为了寻找无毒不易燃烧的致冷剂,米奇利根据元素周期表研究,分析单质及化合物易燃性和毒性的递变规律。
在第三周期中,单质的易燃性是Na>Mg>Al,在第二周期中易燃性是CH4>NH3>H2O,再比较氢化物的毒性:AsH3>PH3>NH3 , H2S>H2O,根据这样的变化趋势,元素周期表中右上角的氟元素的化合物可能是理想的元素,不易燃的致冷剂。
他经过了长时间的研究和对比,最终,一种全新的致冷剂CCl2F2终于应运而生。80年代,科学家们发现氟利昂会破坏大气的臭氧层,危害人类的健康。人们将在元素周期表的指导下去寻找新一代的致冷剂。
任务三:元素周期表的应用
元素周期表已成为化学家的得力工具,为研究物质结构、发现新元素、合成新物质、寻找新材料提供了许多有价值的指导。
寻找优良催化剂,寻找耐高温耐酸碱腐蚀的特种合金,用来制造火箭、导弹等
在金属和非金属分界线处,寻找半导体材料。
我的收获
下列事实不能用元素周期律解释的是( )
A.NaOH的碱性强于Al(OH)3
B.H2SiO3的溶解性弱于H2CO3
C. NH3的稳定性强于CH4
D.HClO4的酸性强于H2SO4
巩固练习
B
巩固练习
对于元素周期表,下列叙述中不正确的是( )
A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀材料的元素
C.在金属元素区域可以寻找制备新型农药材料的元素
D.元素周期表中位置靠近的元素性质相近
C
第1章第3节 元素周期表的应用
鲁科版普通高中化学必修2
第3课时 预测元素及其化合物的性质
核心素养发展目标
1、以硅及其化合物为例,
学会从元素在周期表中的位置、物质类别、
元素化合价等角度认识含有该元素物质的
化学性质,形成对元素及其化合物的多维
立体认识网络。
2、了解元素周期表与元素周期律的应用,
建立“位—构—性”关系应用的思维模型。
践行
证据推理与模型认知
培养
科学探究与创新意识
感受
宏观辨识与微观探析
增强
科学态度与社会责任
学习目标
素养目标
非金属性逐渐增强
金属性逐渐
增强
非金属性逐渐
增强
稀有气体元素
B
Al
Si
Ge
As
Sb
Te
Po
At
非金属
金属
金属性逐渐增强
F
Cs
同周期(左 → 右)
非金属性?
金属性?
同主族(上→下)
金属性?
非金属性?
元素性质的递变规律
知识回顾
增强
减弱
增强
减弱
方法导引
对于陌生元素,我们可以借助于已知元素的认识,
利用元素周期律以及对已知元素及其化合物性质的研究思路和方法,研究陌生元素及其化合物的性质。
硅及其化合物的存在与应用
硅及其化合物的存在与应用
C
Al P
任务一:认识硅元素
找到硅在周期表中的位置
1、画出硅元素的原子结构示意图。
2、比较碳、硅、磷元素的性质并填表。
原子结构 示意图 最高正价 最低负价 元素类别 得电子
能力
比较对象 硅和碳 硅和磷
原子半径
非金属性
得电子能力
失电子能力
最高价氧化物对应水化物酸性
与氢气化合难易程度
气态氢化物稳定性
任务一:认识硅元素
找到硅在周期表中的位置
1、画出硅元素的原子结构示意图。
2、比较碳、硅、磷元素的性质并填表。
原子结构 示意图 最高正价 最低负价 元素类别 得电子
能力
+4
-4
非金属
元素
较弱
硅和碳最外层都有4个电子,既不易得到电子,也不易失去电子,所以硅的化学性质不活泼,主要形成正四价化合物。
任务一:认识硅元素
利用元素周期表
1、画出硅元素的原子结构示意图。
2、比较碳、硅、磷元素的性质并填表。
原子半径 硅和碳 硅和磷
原子半径
非金属性
得电子能力
失电子能力
最高价氧化物对应水化物酸性
与氢气化合难易程度
气态氢化物稳定性
硅>碳
硅<碳
硅<碳
硅>碳
H2SiO3<H2CO3
硅难于碳
SiH4<CH4
硅>磷
H2SiO3<H3PO4
硅难于磷
SiH4<PH3
硅<磷
硅<磷
硅>磷
任务二:认识含硅元素物质
3、硅及其化合物有哪些 尝试写出它们的化学式。
4、请预测硅及其化合物的化学性质,并说明预测依据。
任务二:认识含硅元素物质
硅及其化合物的化学性质预测及依据
硅及其化合物的化学式 化学性质预测 预测依据
Si(1组) ①…… ②…… ……
SiO2(2组)
H2SiO3(3组)
Na2SiO3(3组)
任务二:认识含硅元素物质
认识硅单质(单质--氧化物--酸--盐)
常温下:
与氢氟酸反应:Si+4HF === SiF4↑+2H2↑
与碱反应:Si+2NaOH+H2O === Na2SiO3+2H2↑
硅及其化合物的化学式 化学性质预测 预测依据
Si
①化学性质不活泼②有氧化性和还原性
③由于性质的特殊性,可能还具有独特的性质。
与碳同主族,与碳单质具有相似的化学性质。
任务二:认识含硅元素物质
认识硅单质(单质--氧化物--酸--盐)
硅及其化合物的化学式 化学性质预测 预测依据
SiO2
①具有酸性氧化物的通性,能与碱、碱性氧化物等发生反应②氧化性③可能具有一定的特性。
与碳同主族,与二氧化碳具有相似的化学性质。
(1)酸性氧化物(类似CO2)
(工业制粗硅)
SiO2+2C ==== Si+2CO↑
(2)氧化性(弱)
任务二:认识含硅元素物质
认识二氧化硅(单质--氧化物--酸--盐)
(3)特性(与氢氟酸反应)
SiO2 + 4HF === SiF4↑+ 2H2O (刻蚀玻璃)
HF
任务二:认识含硅元素物质
认识硅酸(单质--氧化物--酸--盐)
硅及其化合物的化学式 化学性质预测 预测依据
H2SiO3
①具有酸的性质,能与碱反应,但酸性较弱,酸性弱于碳酸、磷酸等
与碳同主族,与磷同周期,
非金属性弱于碳和磷
硅胶干燥剂
硅胶干燥剂是一种高微孔结构的高活性
吸附剂,通常用硅酸凝胶(H2SiO3)经老化
脱水等一系列处理过程而制得。
化学性质稳定,除强碱、氢氟酸外不和
任何物质发生反应。具强烈的吸湿性能。
广泛用于仪器仪表、设备机械、皮革箱包
食品药品等的贮存和运输中的防潮、防霉
和锈蚀。
任务二:认识含硅元素物质
认识硅酸(单质--氧化物--酸--盐)
硅及其化合物的化学式 化学性质预测 预测依据
H2SiO3
①具有酸的性质,能与碱反应,但酸性较弱,酸性弱于碳酸、磷酸等
与碳同主族,与磷同周期,
非金属性弱于碳和磷
硅胶干燥剂是一种高微孔结构的高活性
吸附剂,通常用硅酸凝胶(H2SiO3)经老化
脱水等一系列处理过程而制得。
化学性质稳定,除强碱、氢氟酸外不和
任何物质发生反应。具强烈的吸湿性能。
广泛用于仪器仪表、设备机械、皮革箱包
食品药品等的贮存和运输中的防潮、防霉
和锈蚀。
如何由二氧化硅制备硅酸凝胶?设计实验方案。
(约两滴管)
任务二:认识含硅元素物质
认识硅酸(单质--氧化物--酸--盐)
硅及其化合物的化学式 化学性质预测 预测依据
H2SiO3
①具有酸的性质,能与碱反应,但酸性较弱,酸性弱于碳酸、磷酸等
与碳同主族,与磷同周期,
非金属性弱于碳和磷
如何由二氧化硅制备硅酸凝胶?设计实验方案。
结论:可溶性硅酸盐和
较强酸反应制硅酸
(约两滴管)
任务二:认识含硅元素物质
认识硅酸(单质--氧化物--酸--盐)
硅及其化合物的化学式 化学性质预测 预测依据
H2SiO3
①具有酸的性质,能与碱反应,但酸性较弱,酸性弱于碳酸、磷酸等
与碳同主族,与磷同周期,
非金属性弱于碳和磷
如何证明硅酸酸性弱于碳酸?
通入二氧化碳
任务二:认识含硅元素物质
认识硅酸(单质--氧化物--酸--盐)
硅及其化合物的化学式 化学性质预测 预测依据
H2SiO3
①具有酸的性质,能与碱反应,但酸性较弱,酸性弱于碳酸、磷酸等
与碳同主族,与磷同周期,
非金属性弱于碳和磷
如何证明硅酸酸性弱于碳酸?设计实验方案。
任务二:认识含硅元素物质
认识硅酸(单质--氧化物--酸--盐)
硅及其化合物的化学式 化学性质预测 预测依据
Na2SiO3
白色固体,易溶于水,与比硅酸酸性强的一些酸反应,生成难溶于水的硅酸
属于弱酸的正盐,可与强酸反应生成硅酸
思维建模:预测陌生物质的性质
陌生
物质
核心
元素
元素位置
元素性质
物质性质
化合价
类别
元素周期表、周期律
预测Br2的化学性质。
Br
第四周期ⅦA族
Br2
拓展阅读
1930年美国化学家托马斯·米奇利成功地获得了一种新型的致冷剂——CCl2F2(即氟利昂)。这完全得益于元素周期表的指导。在1930年前,一些气体如氨,二氧化硫,氯乙烷和氯甲烷等,被相继用作致冷剂。但是,这些致冷剂不是有毒就是易燃,很不安全。为了寻找无毒不易燃烧的致冷剂,米奇利根据元素周期表研究,分析单质及化合物易燃性和毒性的递变规律。
在第三周期中,单质的易燃性是Na>Mg>Al,在第二周期中易燃性是CH4>NH3>H2O,再比较氢化物的毒性:AsH3>PH3>NH3 , H2S>H2O,根据这样的变化趋势,元素周期表中右上角的氟元素的化合物可能是理想的元素,不易燃的致冷剂。
他经过了长时间的研究和对比,最终,一种全新的致冷剂CCl2F2终于应运而生。80年代,科学家们发现氟利昂会破坏大气的臭氧层,危害人类的健康。人们将在元素周期表的指导下去寻找新一代的致冷剂。
任务三:元素周期表的应用
元素周期表已成为化学家的得力工具,为研究物质结构、发现新元素、合成新物质、寻找新材料提供了许多有价值的指导。
寻找优良催化剂,寻找耐高温耐酸碱腐蚀的特种合金,用来制造火箭、导弹等
在金属和非金属分界线处,寻找半导体材料。
我的收获
下列事实不能用元素周期律解释的是( )
A.NaOH的碱性强于Al(OH)3
B.H2SiO3的溶解性弱于H2CO3
C. NH3的稳定性强于CH4
D.HClO4的酸性强于H2SO4
巩固练习
B
巩固练习
对于元素周期表,下列叙述中不正确的是( )
A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀材料的元素
C.在金属元素区域可以寻找制备新型农药材料的元素
D.元素周期表中位置靠近的元素性质相近
C
