1.1物质的分类及转化 课件(共17张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 1.1物质的分类及转化 课件(共17张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-26 23:33:41 | ||
图片预览






文档简介
(共17张PPT)
第一节物质的分类
一、简单分类法及其应用
1、分类的目的:
2、分类的标准:
3、分类的意义:
方便查找应用
根据组成或性质
方便学习和研究
1、NaCl KCl NaClO BaCl2
2、HClO3 KClO3 Cl2 NaClO3
3、H3PO4 HNO3 HCl H2SO4
4、空气 N2 HCl气体 CuSO4 5H2O
●
√
√
√
√
下列每组中都有一种物质与其他物质在分类上不同,试分析每组中的物质的组成规律,将这种不同于其他物质的物质找出来。
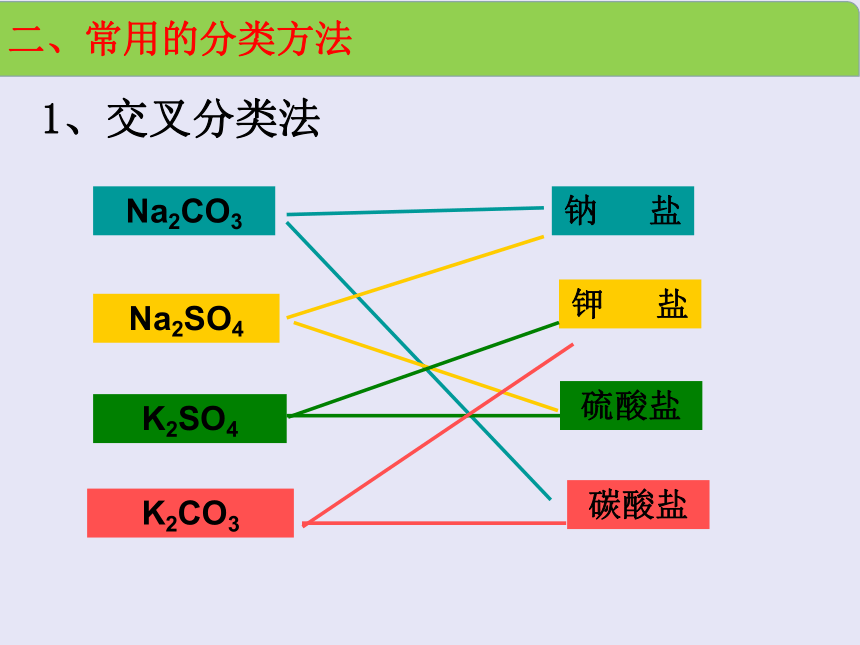
1、交叉分类法
Na2CO3
Na2SO4
K2SO4
K2CO3
钠 盐
钾 盐
硫酸盐
碳酸盐
二、常用的分类方法
思考与交流
1、请尝试对你所学过的化学物质和化学反应进行分类,并与同学交流。
2、请从其他方面收集一些应用分类的例子,讨论对它们进行分类的目的和意义。
H2SO4
HCl
HNO3
H2CO3
含氧酸
无氧酸
一元酸
二元酸
Na2SO4
KHSO4
NaCl
NaHCO3
含氧酸盐
无氧酸盐
钠盐
酸式盐
交叉分类法:对同一事物进行多种分类的方法,即对事物以不同的标准进行分类。
特点:
单一、
有缺陷
2、树状分类法
:对同种事物按照某种属性进行再分类,即对同种事物进行再分类
(一)、纯净物
纯净物是由同种物质组成的,它具有一定的组成,可以用一种化学式来表示
(二)、混合物
混合物由不同种物质混合而成,没有一定的组成,不能用一种化学式表示
由同种元素组成的纯净物
金属单质:
非金属单质:
1、单质
2、化合物
①酸:电离时产生的阳离子全部是H+的化合物
纯
净
物
由金属元素组成的单质。
如Fe、Cu、Hg
由非金属元素组成的单质。
如S、C 、H2 、N2、C60
强酸:硫酸(H2SO4)、硝酸(HNO3)、高氯酸(HClO4)、盐酸(HCl)、氢溴酸(HBr)、氢碘酸(HI)
弱酸:碳酸(H2CO3 )、醋酸( CH3COOH )、亚硫酸(H2SO3)、 氢氟酸(HF) 、次氯酸(HClO) 、氢硫酸(H2S )、氢氰酸(HCN)、磷酸(H3PO4 ) 、 硅酸(H2SiO3)
②碱:电离时产生的阴离子全部是OH-的化合物。
强碱:氢氧化钠(NaOH),氢氧化钾(KOH),氢氧化钙(Ca(OH)2),氢氧化钡(Ba(OH)2)
弱碱:NH3·H2O、Al(OH)3、Cu(OH)2、Fe(OH)2、Fe(OH)3、Zn(OH)2、Cu(OH)2等难溶性的碱
③盐:指一类金属离子或铵根离子(NH4+)与酸根离子或非金属离子结合的化合物。
如氯化钠,硝酸钙,硫酸亚铁和乙酸酸钙,氯化铜,醋酸钠等,酸式盐:硫酸氢钠(NaHSO4),碳酸氢钠(NaHCO3),硫氢化钠(NaHS),亚硫酸氢钠(NaHSO3)
④氧化物:只含有两种元素,其中一种元素是氧元素的化合物(除Na2O2、H2O2)
a.金属氧化物:由金属元素与氧元素两种元素组成的氧化物。Na2O、K2O、Ag2O、MgO、CaO、BaO、CuO、Fe2O3(除Na2O2、H2O2)
b.碱性氧化物:能跟酸起反应,生成一种盐和水生成物(只能有盐和水)的氧化物或与水反应生成碱。碱性氧化物一定是金属氧化物。
c.非金属氧化物:非金属元素与氧元素组成的化合物。如一氧化碳,二氧化碳、一氧化氮、二氧化氮、二氧化硫、三氧化硫、五氧化二磷
d.酸性氧化物:凡能跟碱起反应,生成盐和水的氧化物(除SiO2)
1、树状分类法:是对同类物质按照属性进一步细分类的方法,能把事物认识得更加深刻,促进科学发展。
2、交叉分类法:是分别按照多种标准对某一事物进行类的方法,对事物认识较全面,可弥补单一分类方法的不足。
课堂小结
1.下列物质中,属于纯净物的是( )
A.蒸馏水 B.豆浆 C.酱油 D.加碘食盐
2.下列物质中,属于有机化合物的是( )
A.干冰 B.食盐 C.铅 D.酒精
3.下列物质中,属于氧化物的是( )
A.矿泉水 B.石灰石 C.生石灰 D.高锰酸钾
4. 下列物质中,属于化合物的是( )
A.空气 B.氧气 C.二氧化碳 D.氢气
5.下列各组物质,按化合物、混合物顺序排列的是( )
A.食盐、干冰 B.胆矾、石灰石
C.红磷、烧碱 D.水银、生理盐水
6.下列物质中属于化合物的是( )
A.大理石 B.铁锈 C.氯化亚铁 D.稀盐酸
7.下列物质中属于氧化物的是( )
A.H2S B.H2SO4 C.NaHSO4 D.H2O
试一试吧,Let,s go
谢谢指导
第一节物质的分类
一、简单分类法及其应用
1、分类的目的:
2、分类的标准:
3、分类的意义:
方便查找应用
根据组成或性质
方便学习和研究
1、NaCl KCl NaClO BaCl2
2、HClO3 KClO3 Cl2 NaClO3
3、H3PO4 HNO3 HCl H2SO4
4、空气 N2 HCl气体 CuSO4 5H2O
●
√
√
√
√
下列每组中都有一种物质与其他物质在分类上不同,试分析每组中的物质的组成规律,将这种不同于其他物质的物质找出来。
1、交叉分类法
Na2CO3
Na2SO4
K2SO4
K2CO3
钠 盐
钾 盐
硫酸盐
碳酸盐
二、常用的分类方法
思考与交流
1、请尝试对你所学过的化学物质和化学反应进行分类,并与同学交流。
2、请从其他方面收集一些应用分类的例子,讨论对它们进行分类的目的和意义。
H2SO4
HCl
HNO3
H2CO3
含氧酸
无氧酸
一元酸
二元酸
Na2SO4
KHSO4
NaCl
NaHCO3
含氧酸盐
无氧酸盐
钠盐
酸式盐
交叉分类法:对同一事物进行多种分类的方法,即对事物以不同的标准进行分类。
特点:
单一、
有缺陷
2、树状分类法
:对同种事物按照某种属性进行再分类,即对同种事物进行再分类
(一)、纯净物
纯净物是由同种物质组成的,它具有一定的组成,可以用一种化学式来表示
(二)、混合物
混合物由不同种物质混合而成,没有一定的组成,不能用一种化学式表示
由同种元素组成的纯净物
金属单质:
非金属单质:
1、单质
2、化合物
①酸:电离时产生的阳离子全部是H+的化合物
纯
净
物
由金属元素组成的单质。
如Fe、Cu、Hg
由非金属元素组成的单质。
如S、C 、H2 、N2、C60
强酸:硫酸(H2SO4)、硝酸(HNO3)、高氯酸(HClO4)、盐酸(HCl)、氢溴酸(HBr)、氢碘酸(HI)
弱酸:碳酸(H2CO3 )、醋酸( CH3COOH )、亚硫酸(H2SO3)、 氢氟酸(HF) 、次氯酸(HClO) 、氢硫酸(H2S )、氢氰酸(HCN)、磷酸(H3PO4 ) 、 硅酸(H2SiO3)
②碱:电离时产生的阴离子全部是OH-的化合物。
强碱:氢氧化钠(NaOH),氢氧化钾(KOH),氢氧化钙(Ca(OH)2),氢氧化钡(Ba(OH)2)
弱碱:NH3·H2O、Al(OH)3、Cu(OH)2、Fe(OH)2、Fe(OH)3、Zn(OH)2、Cu(OH)2等难溶性的碱
③盐:指一类金属离子或铵根离子(NH4+)与酸根离子或非金属离子结合的化合物。
如氯化钠,硝酸钙,硫酸亚铁和乙酸酸钙,氯化铜,醋酸钠等,酸式盐:硫酸氢钠(NaHSO4),碳酸氢钠(NaHCO3),硫氢化钠(NaHS),亚硫酸氢钠(NaHSO3)
④氧化物:只含有两种元素,其中一种元素是氧元素的化合物(除Na2O2、H2O2)
a.金属氧化物:由金属元素与氧元素两种元素组成的氧化物。Na2O、K2O、Ag2O、MgO、CaO、BaO、CuO、Fe2O3(除Na2O2、H2O2)
b.碱性氧化物:能跟酸起反应,生成一种盐和水生成物(只能有盐和水)的氧化物或与水反应生成碱。碱性氧化物一定是金属氧化物。
c.非金属氧化物:非金属元素与氧元素组成的化合物。如一氧化碳,二氧化碳、一氧化氮、二氧化氮、二氧化硫、三氧化硫、五氧化二磷
d.酸性氧化物:凡能跟碱起反应,生成盐和水的氧化物(除SiO2)
1、树状分类法:是对同类物质按照属性进一步细分类的方法,能把事物认识得更加深刻,促进科学发展。
2、交叉分类法:是分别按照多种标准对某一事物进行类的方法,对事物认识较全面,可弥补单一分类方法的不足。
课堂小结
1.下列物质中,属于纯净物的是( )
A.蒸馏水 B.豆浆 C.酱油 D.加碘食盐
2.下列物质中,属于有机化合物的是( )
A.干冰 B.食盐 C.铅 D.酒精
3.下列物质中,属于氧化物的是( )
A.矿泉水 B.石灰石 C.生石灰 D.高锰酸钾
4. 下列物质中,属于化合物的是( )
A.空气 B.氧气 C.二氧化碳 D.氢气
5.下列各组物质,按化合物、混合物顺序排列的是( )
A.食盐、干冰 B.胆矾、石灰石
C.红磷、烧碱 D.水银、生理盐水
6.下列物质中属于化合物的是( )
A.大理石 B.铁锈 C.氯化亚铁 D.稀盐酸
7.下列物质中属于氧化物的是( )
A.H2S B.H2SO4 C.NaHSO4 D.H2O
试一试吧,Let,s go
谢谢指导
