2.1.2活化能 课件(共22张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.1.2活化能 课件(共22张ppt)化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-26 23:34:13 | ||
图片预览





文档简介
(共22张PPT)
第二章 化学反应速率与化学平衡
第2课时 活化能
第一节 化学反应速率
CHEMICAL REACTION RATE AND CHEMICAL EQUILIBRIUM
第二章
温故知新
那如何解释浓度、压强、温度及催化剂等因素对化学反应速率的影响呢?
上节课我们一起学习了化学反应速率及其影响因素,请同学们回忆下影响化学反应速率的因素有哪些呢?
一、基元反应与反应历程
从微观上看,反应物分子一般总是经过若干个简单的反应步骤才最终转化为产物分子的。每一个简单的反应都称为一个基元反应。
反应历程是化学中用来描述某一化学变化所经由的全部基元反应,反应历程又称反应机理。
基元反应
例如:反应 2HI === H2+I2
第一步:2HI H2+2 I·
第二步:2I· I2
反应历程
自由基:带有单电子的原子或原子团。
典例精讲
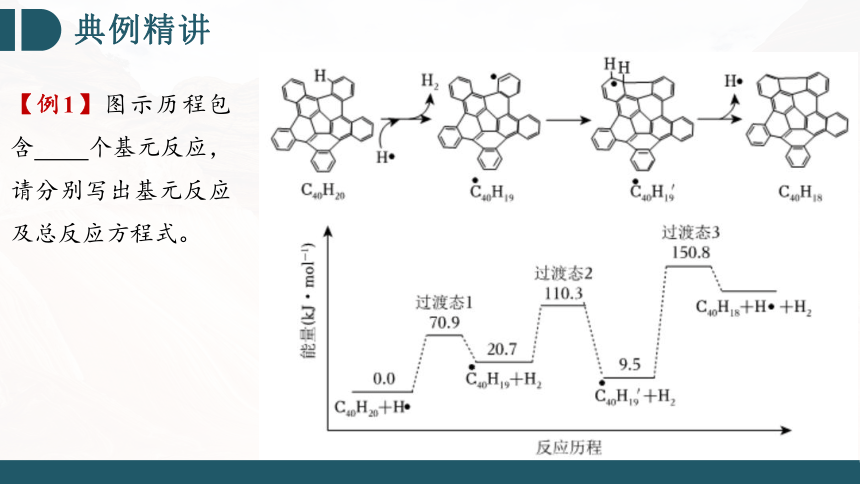
【例1】图示历程包含 个基元反应,请分别写出基元反应及总反应方程式。
二、碰撞理论与活化能
有效碰撞理论
1.有效碰撞理论
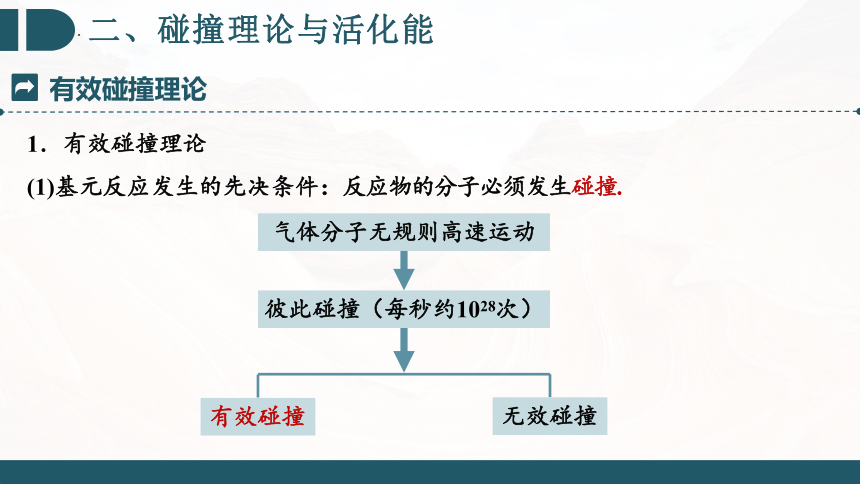
(1)基元反应发生的先决条件:反应物的分子必须发生碰撞.
气体分子无规则高速运动
彼此碰撞(每秒约1028次)
有效碰撞
无效碰撞
二、碰撞理论与活化能
有效碰撞理论
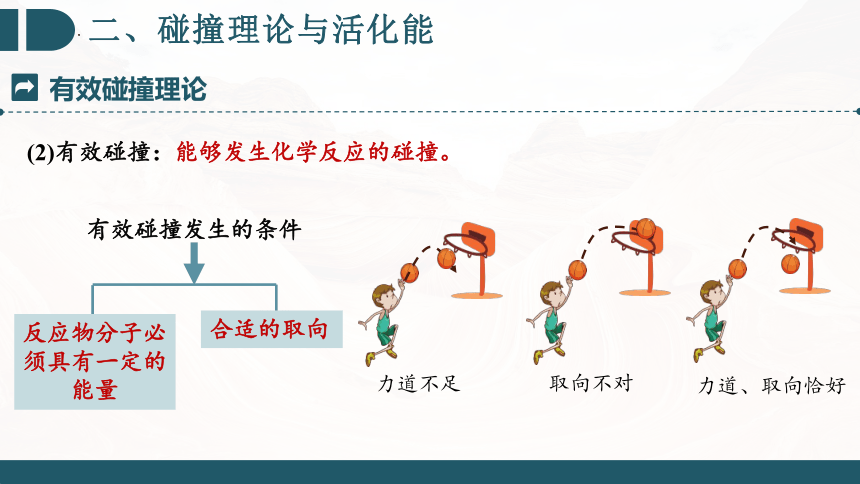
(2)有效碰撞:能够发生化学反应的碰撞。
有效碰撞发生的条件
力道不足
取向不对
力道、取向恰好
反应物分子必须具有一定的能量
合适的取向
二、碰撞理论与活化能
有效碰撞理论
(3)活化能与活化分子
②活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差。
①活化分子:具有足够的能量,能够发生有效碰撞的分子。
对于某一化学反应来说,在一定条件下,
反应物分子中活化分子百分数是一定的。
二、碰撞理论与活化能
有效碰撞理论
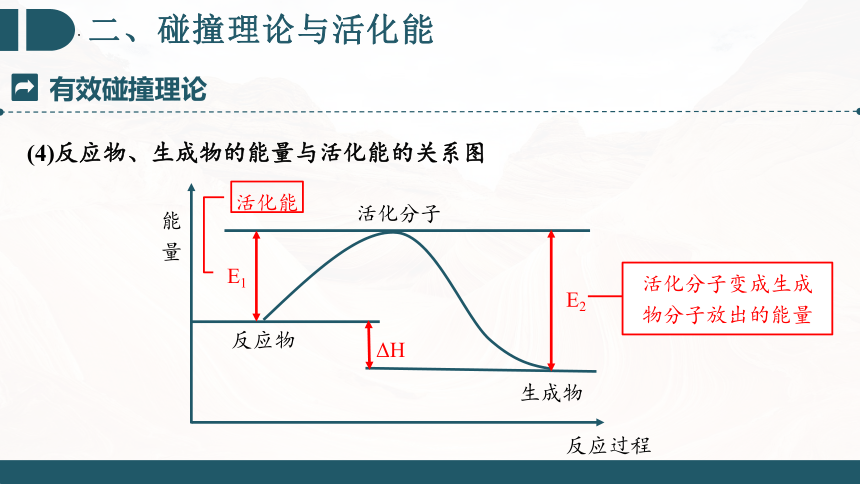
(4)反应物、生成物的能量与活化能的关系图
能量
反应物
生成物
反应过程
E1
活化能
E2
活化分子变成生成物分子放出的能量
活化分子
ΔH
二、碰撞理论与活化能
有效碰撞理论
2.有效碰撞与反应速率的关系
单位时间内、单位体积内有效碰撞次数增多
化学反应速率增大
问题思考:活化分子、活化能与化学反应速率有什么关系?
活化能低
活化分子数目增加
活化分子百分数增大
典例精讲
【例2】氧化亚氮在碘蒸气存在时的热分解反应:2N2O===2N2+O2,其反应机理包含以下步骤:
第一步:I2(g)2I(g)(快反应);
第二步:I(g)+N2O(g)―→N2(g)+IO(g)(慢反应);
第三步:IO(g)+N2O(g)―→N2(g)+O2(g)+I(g)(快反应)。
下列说法错误的是
A.第二步对分解反应速率起决定作用
B.I2的浓度与N2O的分解速率无关
C.慢反应的活化能大于快反应的活化能
D.第二步反应中I(g)作还原剂
化学反应速率的快慢取决于慢反应
I2是反应物,碘蒸气的浓度与N2O的分解速率有关
活化能越大反应速率越慢
第二步反应中I(g)→IO(g),I元素化合价升高,作还原剂
√
三、碰撞理论解释影响化学反应速率的因素
解释浓度对化学反应速率的影响
其它条件不变时
增大反应物浓度
活化分子
分子总数:20
活化分子数:6
活化分子百分数:30%
分子总数:10
活化分子数:3
活化分子百分数:30%
其它条件相同时,增大反应物浓度
单位体积内活化分子数增加
(活化分子百分数不变)
单位时间有效碰撞次数增加
化学反应速率增大
三、碰撞理论解释影响化学反应速率的因素
解释温度对化学反应速率的影响
其它条件不变时
升高温度
活化分子
其它条件相同时,增大反应物浓度
分子总数目不变,活化分子数增加,活化分子百分数增加
单位时间有效碰撞次数增加
化学反应速率增大
三、碰撞理论解释影响化学反应速率的因素
解释压强对化学反应速率的影响
其它条件相同时,增大压强
单位体积内活化分子数增加
(活化分子百分数不变)
单位时间有效碰撞次数增加
化学反应速率增大
其它条件不变时
增大压强
活化分子
三、碰撞理论解释影响化学反应速率的因素
解释压强对化学反应速率的影响
活化分子
容器的容积不变
充入惰性气体
恒温恒容通入少量惰性气体
单位体积内活化分子数不变
单位时间有效碰撞次数不变
化学反应速率不变
体积不变,浓度不变
三、碰撞理论解释影响化学反应速率的因素
解释压强对化学反应速率的影响
活化分子
容器内压强不变
充入惰性气体
恒温恒压通入少量惰性气体
单位体积内活化分子数减小
单位时间有效碰撞次数减小
化学反应速率减小
体积增大,浓度减小
三、碰撞理论解释影响化学反应速率的因素
解释催化剂对化学反应速率的影响
研究表明,催化剂可以改变反应历程,改变反应的活化能。
使用催化剂
活化分子数目增加,活化分子百分数增加
单位时间有效碰撞次数增加
化学反应速率增大
反应活化能降低
条件变化 分子 总数 活化分子数目 活化 分子百分数 单位体积内活化分子数目 单位时间/体积内有效碰撞次数 化学反应速率
增大 浓度
增大 压强
升高 温度
使用 催化剂
小结
增加
增加
不变
增加
增加
增大
增大
增大
增大
不变
不变
不变
增加
增加
不变
增加
增加
不变
增加
增加
增加
增加
增加
增加
三、碰撞理论解释影响化学反应速率的因素
典例精讲
【例3】下列对化学反应速率增大原因的分析错误的是( )
A.对于有气体参加的化学反应,增大压强使容器体积减小,单位体积内活化分子数增多
B.向反应体系中加入相同浓度的反应物,使活化分子百分数增大
C.升高温度,使反应物分子中活化分子百分数增大
D.加入适宜的催化剂,使反应物分子中活化分子百分数增大
B
拓展延伸
飞秒化学
飞秒化学是物理化学的一支,研究在极小的时间内化学反应的过程和机理。这一领域涉及的时间间隔短至约千万亿分之一秒,即1飞秒(fs, 1 fs=10-15 s) 。在这个极小的时间段里,产生的飞秒激光可以用于检测分子、原子、离子的结构、组成、运动等形成飞秒检测范畴。
哈迈德·泽维尔
(1947-2016)
1.关于有效碰撞理论,下列说法正确的是( )
A.活化分子一定能发生有效碰撞
B.反应物分子之间的碰撞一定会引起化学键的断裂
C.有效碰撞是活化分子在一定的方向上的碰撞
D.发生有效碰撞的分子具有最高的能量
演练—题组冲关
C
2.活泼自由基与氧气的反应一直是关注的热点。HNO自由基与O2反应过程的能量变化如图所示。下列说法正确的是( )
A.该反应为吸热反应
B.产物的稳定性:P1>P2
C.该历程中最大正反应的活化能
E正=186.19 kJ·mol-1
D.相同条件下,由中间产物Z转化为
产物的速率:v(P1)演练—题组冲关
C
课堂小结
CLASS SUMMARY
活化能
碰撞理论解释影响化学反应速率的因素
碰撞理论
基元反应和反应历程
有效碰撞
活化能与活化分子
第二章 化学反应速率与化学平衡
第2课时 活化能
第一节 化学反应速率
CHEMICAL REACTION RATE AND CHEMICAL EQUILIBRIUM
第二章
温故知新
那如何解释浓度、压强、温度及催化剂等因素对化学反应速率的影响呢?
上节课我们一起学习了化学反应速率及其影响因素,请同学们回忆下影响化学反应速率的因素有哪些呢?
一、基元反应与反应历程
从微观上看,反应物分子一般总是经过若干个简单的反应步骤才最终转化为产物分子的。每一个简单的反应都称为一个基元反应。
反应历程是化学中用来描述某一化学变化所经由的全部基元反应,反应历程又称反应机理。
基元反应
例如:反应 2HI === H2+I2
第一步:2HI H2+2 I·
第二步:2I· I2
反应历程
自由基:带有单电子的原子或原子团。
典例精讲
【例1】图示历程包含 个基元反应,请分别写出基元反应及总反应方程式。
二、碰撞理论与活化能
有效碰撞理论
1.有效碰撞理论
(1)基元反应发生的先决条件:反应物的分子必须发生碰撞.
气体分子无规则高速运动
彼此碰撞(每秒约1028次)
有效碰撞
无效碰撞
二、碰撞理论与活化能
有效碰撞理论
(2)有效碰撞:能够发生化学反应的碰撞。
有效碰撞发生的条件
力道不足
取向不对
力道、取向恰好
反应物分子必须具有一定的能量
合适的取向
二、碰撞理论与活化能
有效碰撞理论
(3)活化能与活化分子
②活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差。
①活化分子:具有足够的能量,能够发生有效碰撞的分子。
对于某一化学反应来说,在一定条件下,
反应物分子中活化分子百分数是一定的。
二、碰撞理论与活化能
有效碰撞理论
(4)反应物、生成物的能量与活化能的关系图
能量
反应物
生成物
反应过程
E1
活化能
E2
活化分子变成生成物分子放出的能量
活化分子
ΔH
二、碰撞理论与活化能
有效碰撞理论
2.有效碰撞与反应速率的关系
单位时间内、单位体积内有效碰撞次数增多
化学反应速率增大
问题思考:活化分子、活化能与化学反应速率有什么关系?
活化能低
活化分子数目增加
活化分子百分数增大
典例精讲
【例2】氧化亚氮在碘蒸气存在时的热分解反应:2N2O===2N2+O2,其反应机理包含以下步骤:
第一步:I2(g)2I(g)(快反应);
第二步:I(g)+N2O(g)―→N2(g)+IO(g)(慢反应);
第三步:IO(g)+N2O(g)―→N2(g)+O2(g)+I(g)(快反应)。
下列说法错误的是
A.第二步对分解反应速率起决定作用
B.I2的浓度与N2O的分解速率无关
C.慢反应的活化能大于快反应的活化能
D.第二步反应中I(g)作还原剂
化学反应速率的快慢取决于慢反应
I2是反应物,碘蒸气的浓度与N2O的分解速率有关
活化能越大反应速率越慢
第二步反应中I(g)→IO(g),I元素化合价升高,作还原剂
√
三、碰撞理论解释影响化学反应速率的因素
解释浓度对化学反应速率的影响
其它条件不变时
增大反应物浓度
活化分子
分子总数:20
活化分子数:6
活化分子百分数:30%
分子总数:10
活化分子数:3
活化分子百分数:30%
其它条件相同时,增大反应物浓度
单位体积内活化分子数增加
(活化分子百分数不变)
单位时间有效碰撞次数增加
化学反应速率增大
三、碰撞理论解释影响化学反应速率的因素
解释温度对化学反应速率的影响
其它条件不变时
升高温度
活化分子
其它条件相同时,增大反应物浓度
分子总数目不变,活化分子数增加,活化分子百分数增加
单位时间有效碰撞次数增加
化学反应速率增大
三、碰撞理论解释影响化学反应速率的因素
解释压强对化学反应速率的影响
其它条件相同时,增大压强
单位体积内活化分子数增加
(活化分子百分数不变)
单位时间有效碰撞次数增加
化学反应速率增大
其它条件不变时
增大压强
活化分子
三、碰撞理论解释影响化学反应速率的因素
解释压强对化学反应速率的影响
活化分子
容器的容积不变
充入惰性气体
恒温恒容通入少量惰性气体
单位体积内活化分子数不变
单位时间有效碰撞次数不变
化学反应速率不变
体积不变,浓度不变
三、碰撞理论解释影响化学反应速率的因素
解释压强对化学反应速率的影响
活化分子
容器内压强不变
充入惰性气体
恒温恒压通入少量惰性气体
单位体积内活化分子数减小
单位时间有效碰撞次数减小
化学反应速率减小
体积增大,浓度减小
三、碰撞理论解释影响化学反应速率的因素
解释催化剂对化学反应速率的影响
研究表明,催化剂可以改变反应历程,改变反应的活化能。
使用催化剂
活化分子数目增加,活化分子百分数增加
单位时间有效碰撞次数增加
化学反应速率增大
反应活化能降低
条件变化 分子 总数 活化分子数目 活化 分子百分数 单位体积内活化分子数目 单位时间/体积内有效碰撞次数 化学反应速率
增大 浓度
增大 压强
升高 温度
使用 催化剂
小结
增加
增加
不变
增加
增加
增大
增大
增大
增大
不变
不变
不变
增加
增加
不变
增加
增加
不变
增加
增加
增加
增加
增加
增加
三、碰撞理论解释影响化学反应速率的因素
典例精讲
【例3】下列对化学反应速率增大原因的分析错误的是( )
A.对于有气体参加的化学反应,增大压强使容器体积减小,单位体积内活化分子数增多
B.向反应体系中加入相同浓度的反应物,使活化分子百分数增大
C.升高温度,使反应物分子中活化分子百分数增大
D.加入适宜的催化剂,使反应物分子中活化分子百分数增大
B
拓展延伸
飞秒化学
飞秒化学是物理化学的一支,研究在极小的时间内化学反应的过程和机理。这一领域涉及的时间间隔短至约千万亿分之一秒,即1飞秒(fs, 1 fs=10-15 s) 。在这个极小的时间段里,产生的飞秒激光可以用于检测分子、原子、离子的结构、组成、运动等形成飞秒检测范畴。
哈迈德·泽维尔
(1947-2016)
1.关于有效碰撞理论,下列说法正确的是( )
A.活化分子一定能发生有效碰撞
B.反应物分子之间的碰撞一定会引起化学键的断裂
C.有效碰撞是活化分子在一定的方向上的碰撞
D.发生有效碰撞的分子具有最高的能量
演练—题组冲关
C
2.活泼自由基与氧气的反应一直是关注的热点。HNO自由基与O2反应过程的能量变化如图所示。下列说法正确的是( )
A.该反应为吸热反应
B.产物的稳定性:P1>P2
C.该历程中最大正反应的活化能
E正=186.19 kJ·mol-1
D.相同条件下,由中间产物Z转化为
产物的速率:v(P1)
C
课堂小结
CLASS SUMMARY
活化能
碰撞理论解释影响化学反应速率的因素
碰撞理论
基元反应和反应历程
有效碰撞
活化能与活化分子
