1.3 常见的酸 同步练习(含答案)
文档属性
| 名称 | 1.3 常见的酸 同步练习(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 149.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-07-26 00:00:00 | ||
图片预览


文档简介
常见的酸
一、单选题
1.硫酸是一种常见的酸,下列不属于浓硫酸性质的是( )
A.挥发性 B.脱水性 C.腐蚀性 D.吸水性
2.下列物质能与盐酸反应,但不产生气体的是( )
A.Fe B.Cu C.CuO D.CaCO3
3.向盐酸中加入浓硫酸会有白雾产生,下列叙述不属于导致产生这种现象的原因是( )
A.浓硫酸具脱水性B.浓硫酸具有吸水性C.盐酸具有挥发性
D.气态物质的溶解度随温度的升高而降低
4.在一台处于平衡的托盘天平的左右两盘中,分别放置两个等质量的盛有浓盐酸和浓硫酸的敞口烧杯,过一段时间后,天平会( )
A.左端下沉 B.右端下沉 C.仍处于平衡 D.无法判断
5.下列检测某溶液pH的操作正确的是( )
A.将pH试纸投入待测液,对照标准比色卡读数
B.用干燥、洁净的玻璃棒蘸取少量待测液,沾在置于洁净表面皿的pH试纸上,待试纸变色后,再对照标准比色卡读数
C.用玻璃棒蘸取待测液沾在用蒸馏水润湿的pH试纸上,对照标准比色卡读数
D.用蒸馏水冲洗玻璃棒,蘸取待测液沾在pH试纸上,对照标准比色卡读数
6.向盛有一定量氧化铁粉末的烧杯中不断加入稀盐酸,烧杯中相关量的变化与图象相符的是( )
A.B.C.D.
7.盐酸、稀硫酸在水溶液中都能产生H+,故有许多共同的性质。下列有关叙述正确的是( )
A.打开盛有浓盐酸和浓硫酸的试剂瓶瓶塞,在瓶口都有白雾B.稀盐酸和稀硫酸都可用于除铁锈
C.浓盐酸、浓硫酸都可用来干燥氧气D.在稀盐酸、稀硫酸中滴加氢氧化钡溶液,都有白色沉淀
8.下列有关酸的叙述中正确的是( )
A.冷的浓盐酸可以用铁桶存放B.硫酸溶液中K+、Ca2+、OH-、Cl-可以大量共存
C.稀盐酸能跟硝酸银反应体现了酸的通性
D.稀硝酸能跟铁反应,但不生成氢气
9.查阅资料可以知道柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出H+,从而呈现酸性,主要用于制造香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的是( )
A.Mg B.Fe2O3 C.CO2 D.Fe
10.实验室的浓硫酸、浓盐酸敞口放置一段时间后,下例图像描述正确的是( )
A.B.C. D.
11.鉴别稀盐酸和稀硫酸选用的试剂是( )
A.氯化钡 B.碳酸钠 C.硝酸银 D.石蕊
12.为研究盐酸的化学性质,小明进行如下实验。其中能产生白色沉淀的是( )
A.B.C. D.
13.用稀盐酸除去铁锈主要成分的原理是( )
A.FeO+2HCl=FeCl2+H2O B.FeO+2HCl=FeCl3+H2O
C.Fe2O3+6HCl=2FeCl2+3H2O D.Fe2O3+6HCl=2FeCl3+3H2O
14.氯气用于自来水的消毒和杀菌,它与水的反应式为Cl2+H2O=HCl+HClO,可用来鉴别自来水与蒸馏水的是( )
A.酚酞试液B.氯化钡溶液C.氢氧化钠溶液 D.硝酸银溶液
15.在Na2CO3溶液中逐渐加入盐酸,反应中溶液pH随加入盐酸质量变化的关系为( )
A. B. C. D.
二、填空题
16.实验室有两瓶标签已经破损的酸溶液,已知它们可能是浓硫酸和浓盐酸。
(1)区分两者的方法是,打开瓶盖就能确定哪瓶是浓盐酸。理由是 。
(2)浓硫酸常用来干燥氧气、氢气、二氧化碳等气体。原因是浓硫酸具有 性。
17.硫酸、盐酸是工业上常用的两种酸。
(1)打开盛有浓盐酸的试剂瓶的瓶盖,可观察到瓶口有 的现象。
(2)对于硫酸而言,溶质的质量分数越大,溶液的酸性越强。常温下,10%的稀硫酸的pH (填“大于”、“小于”或“等于”)2%的稀硫酸的pH。
(3)盐酸的下列用途中,不能用硫酸代替盐酸的是 (填编号)
①金属表面除锈②实验室制取二氧化碳③除去NaCl中的少量NaOH
(4)稀盐酸和稀硫酸具有相似的化学性质的根本原因是都含有相同的 离子(填离子符号)
18.某试剂瓶内装的估计是盐酸,要鉴别是否真是盐酸,应采用的实验操作是:首先用试管取少量待测液,加入 ,然后,再用试管取少量待测液,加入 ,如果是盐酸,前后两步的实验现象是 、 .
19.浓盐酸打开瓶子,瓶口有 ,这是因为浓盐酸具有 ,挥发出的 气体与空气中的 结合形成 .
20.在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图。
(1)该反应的化学方程式为: 。
(2)要得到此变化曲线,所进行的操作是 (填序号)。
①将稀盐酸滴加到氢氧化钠溶液中 ②将氢氧化钠溶液滴加到稀盐酸中
(3)当加入溶液的质量为ag时,所得溶液中的溶质为(写化学式) 。
(4)当加入溶液的质量为bg时,向所得溶液中滴加酚酞溶液,溶液呈 色。
21.实验室采用大理石和稀盐酸反应制取二氧化碳气体,则发生、收集装置应选择图中 (填字母)装置,该实验不能用稀硫酸代替稀盐酸,原因是 .
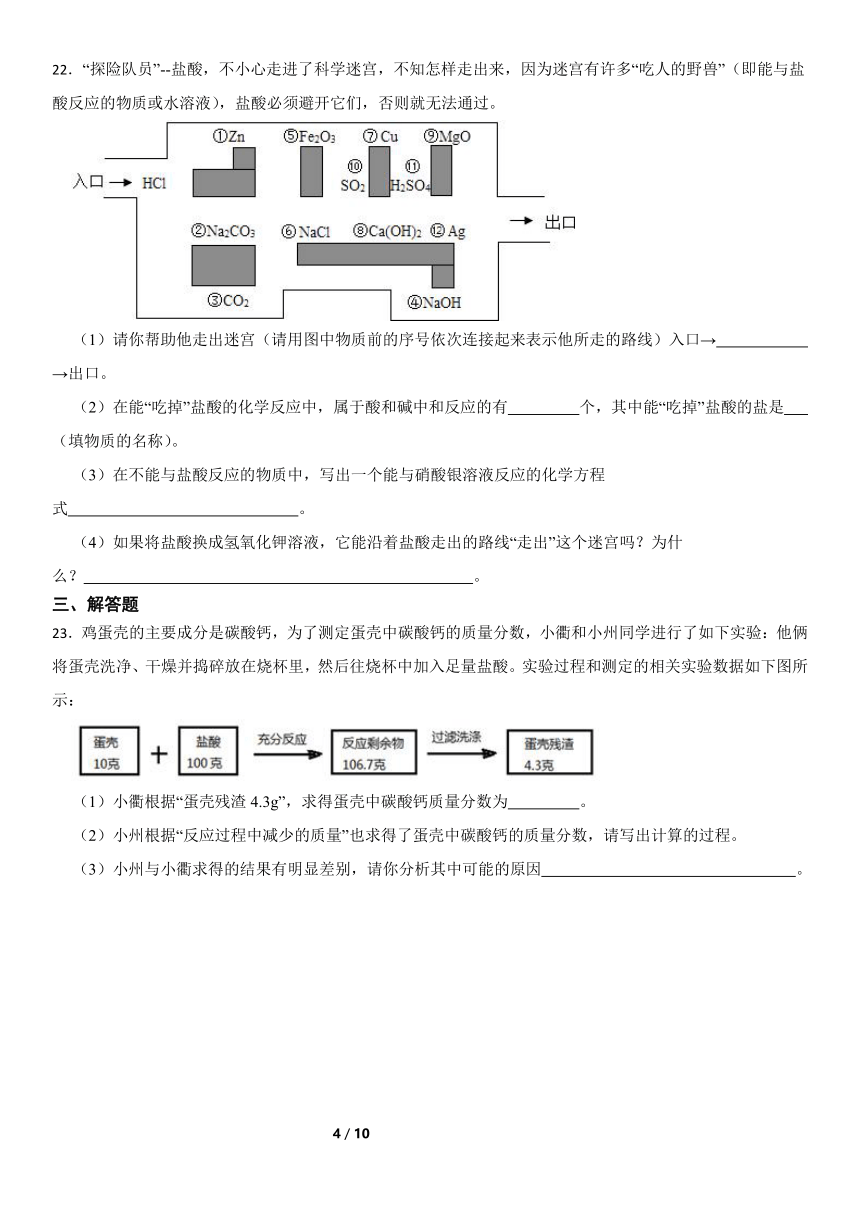
22.“探险队员”--盐酸,不小心走进了科学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或水溶液),盐酸必须避开它们,否则就无法通过。
(1)请你帮助他走出迷宫(请用图中物质前的序号依次连接起来表示他所走的路线)入口→ →出口。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有 个,其中能“吃掉”盐酸的盐是 (填物质的名称)。
(3)在不能与盐酸反应的物质中,写出一个能与硝酸银溶液反应的化学方程式 。
(4)如果将盐酸换成氢氧化钾溶液,它能沿着盐酸走出的路线“走出”这个迷宫吗?为什么? 。
三、解答题
23.鸡蛋壳的主要成分是碳酸钙,为了测定蛋壳中碳酸钙的质量分数,小衢和小州同学进行了如下实验:他俩将蛋壳洗净、干燥并捣碎放在烧杯里,然后往烧杯中加入足量盐酸。实验过程和测定的相关实验数据如下图所示:
(1)小衢根据“蛋壳残渣4.3g”,求得蛋壳中碳酸钙质量分数为 。
(2)小州根据“反应过程中减少的质量”也求得了蛋壳中碳酸钙的质量分数,请写出计算的过程。
(3)小州与小衢求得的结果有明显差别,请你分析其中可能的原因 。
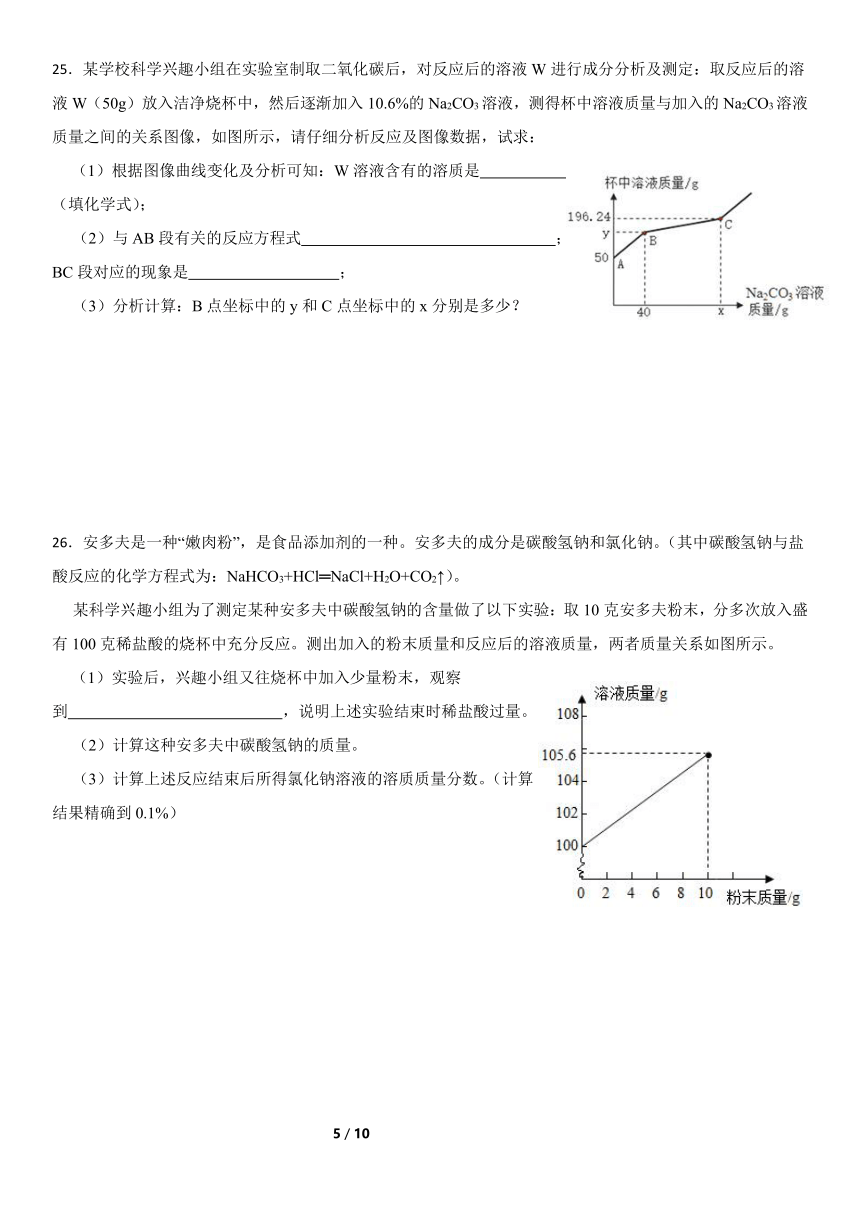
25.某学校科学兴趣小组在实验室制取二氧化碳后,对反应后的溶液W进行成分分析及测定:取反应后的溶液W(50g)放入洁净烧杯中,然后逐渐加入10.6%的Na2CO3溶液,测得杯中溶液质量与加入的Na2CO3溶液质量之间的关系图像,如图所示,请仔细分析反应及图像数据,试求:
(1)根据图像曲线变化及分析可知:W溶液含有的溶质是 (填化学式);
(2)与AB段有关的反应方程式 ;BC段对应的现象是 ;
(3)分析计算:B点坐标中的y和C点坐标中的x分别是多少?
26.安多夫是一种“嫩肉粉”,是食品添加剂的一种。安多夫的成分是碳酸氢钠和氯化钠。(其中碳酸氢钠与盐酸反应的化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑)。
某科学兴趣小组为了测定某种安多夫中碳酸氢钠的含量做了以下实验:取10克安多夫粉末,分多次放入盛有100克稀盐酸的烧杯中充分反应。测出加入的粉末质量和反应后的溶液质量,两者质量关系如图所示。
(1)实验后,兴趣小组又往烧杯中加入少量粉末,观察到 ,说明上述实验结束时稀盐酸过量。
(2)计算这种安多夫中碳酸氢钠的质量。
(3)计算上述反应结束后所得氯化钠溶液的溶质质量分数。(计算结果精确到0.1%)
27.某同学向质量分数为 7.3%的稀盐酸溶液中加入碳酸钙样品(含有杂质,且杂质不与酸反应也不溶于水),记录反应过程中有关的实验数据,最后得到下列图像。
(1)甲图中 a 点的 pH 值为 。
(2)本实验不要浓盐酸的原因是因为浓盐酸具有 性。
(3)样品中碳酸钙的质量分数为多少?
28.实验室保存﹣瓶浓盐酸,瓶上的标签部分内容如图所示,请根据标签上的信息回答下列各问:
(1)这﹣瓶浓盐酸中溶质的质量是多少克?(结果精确到0.1)
(2)取100克此瓶内的浓盐酸可以稀释成1.85%的稀盐酸多少克?同时加水多少克?
四、实验探究题
29.为验证“酸的化学通性”,某班同学在实验室进行如下实验。请分析并回答相关问题:
(1)写出能证明A中反应发生的现象 。
(2)要全面验证酸的化学通性,D试管中能与酸反应的固体单质是 (写一种即可)。
(3)实验完成后,将全部废液倒入废液缸内,测得pH=2,则废液中所含溶质最多有 种(溶质不计指示剂与气体)。
30.化学使世界变得绚丽多彩。如图是物质之间发生化学反应的颜色变化。
(1)请你在编号②、③处各填入一种物质。②是 ;③是 。
(2)根据图可以总结出稀盐酸的4个化学性质。请你写出编号①稀盐酸的化学性质 。
(3)编号④中产生白色沉淀,其化学式为 ;请写出编号③中的化学方程式 。
答案解析部分
1.【答案】A2.【答案】C3.【答案】A4.【答案】B5.【答案】B6.【答案】A7.【答案】B8.【答案】D
9.【答案】C10.【答案】C11.【答案】A12.【答案】A13.【答案】D14.【答案】D15.【答案】D
16.【答案】(1)浓盐酸具有挥发性
(2)吸水
17.【答案】(1)白雾形成或有刺激性气味的气体
(2)小于
(3)②③
(4)H+
18.【答案】紫色石蕊溶液;硝酸银溶液和稀硝酸;紫色石蕊溶液变红色;产生不溶于稀硝酸的白色沉淀
19.【答案】白雾;挥发性;氯化氢气体;水蒸气;盐酸小液滴
20.【答案】(1)NaOH+HCl=NaCl+H2O
(2)②
(3)HCl、NaCl
(4)红
21.【答案】CE;大理石与稀硫酸反应生成微溶于水的硫酸钙,硫酸钙覆盖在大理石表面,阻止反应进一步进行
22.【答案】(1)③→⑥→⑩→⑦→ →
(2)2;碳酸钠
(3)NaCl+AgNO3═AgCl↓+NaNO3
(4)不能;氢氧化钾与二氧化碳反应,从而被“吃掉”
23.【答案】(1)57%
(2)根据质量守恒定律,产生二氧化碳的质量=10g+100g-106.7g=3.3g,
设鸡蛋壳中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 3.3g
;
解得:x=7.5g。
该鸡蛋壳中碳酸钙的质量分数:。
(3)盐酸有挥发性,使CO2质量偏大
24.【答案】(1)3、4
(2)4.4
(3)80%
(4)解:以第3次反应进行分析,加15g样品,50g稀盐酸反应完全,生成4.4gCO2。设50g稀盐酸中HCl的质量为y。
CaCO3+ 2HCl=CaCl2+H2O+ CO2↑
73 44
y 4.4g
,
y=7.3g,
即稀盐酸中溶质的质量分数为 =14.6%。
25.【答案】(1)CaCl2、HCl
(2)Na2CO3+2HCl=2NaCl+H2O+CO2↑;有白色沉淀产生
(3)40g碳酸钠溶液中含溶质的质量为40g×10.6%=4.24g
设碳酸钠与盐酸反应产生二氧化碳气体的质量为m
Na2CO3+2HCl=2NaCl+H2O+ CO2↑
106 44
4.24g m
m=1.76g
B点时烧杯中溶液的质量为50g+40g -1.76g=88.24g,B点坐标中的y为88.24;
与氯化钙反应的碳酸钠的质量为(x-40g)×10.6%,根据质量守恒定律,反应产生碳酸钙沉淀的质量为x+50g-1.76g-196.24g=x-148g
Na2CO3+CaCl2= CaCO3↓+2NaCl
106 100
(x-40g)×10.6% x-148g
x=160g
C点坐标中的x为160。
26.【答案】(1)固体继续溶解,产生气泡
(2)由图中数据可知,反应结束后产生二氧化碳质量为100+10-105.6=4.4g;
设碳酸氢钠质量为x,生成氯化钠质量为Y
NaHCO3+HCl=NaCl+H2O+CO2↑
84 58.5 44
x y 4.4g
84:44=x:4.4g 58.5:44=y:4.4g
x=8.4g y=5.85g
(3)反应结束后所得氯化钠溶液的溶质质量分数为。
27.【答案】(1)7
(2)挥发
(3)解:设碳酸钙的质量为 x,
CaCO 3+ 2HCl= CaCl 2 +H2O+ CO2↑
100 73 44
x 6.6g
100:x=44:6.6g x=15g
样品中碳酸钙的质量分数为:15g/20g×100%=75%
28.【答案】解:(1)500mL=500cm3,这﹣瓶浓盐酸中溶质的质量是1.19g/cm3×500cm3×37%≈220.2g.
(2)设可以稀释成1.85%的稀盐酸的质量为x,根据溶液稀释前后溶质的质量不变,
则100g×37%=x×1.85% x=2000g.
同时加水的质量为2000g﹣100g=1900g.
答:(1)这﹣瓶浓盐酸中溶质的质量是220.2g;(2)可以稀释成1.85%的稀盐酸2000g,同时加水1900g.
29.【答案】(1)溶液红色褪去
(2)铁
(3)4
30.【答案】(1)铁(或Fe);氧化铜(或CuO)
(2)盐酸可使紫色石蕊试液变红
(3)AgCl;CuO+2HCl=CuCl2+H2O
1 / 1
一、单选题
1.硫酸是一种常见的酸,下列不属于浓硫酸性质的是( )
A.挥发性 B.脱水性 C.腐蚀性 D.吸水性
2.下列物质能与盐酸反应,但不产生气体的是( )
A.Fe B.Cu C.CuO D.CaCO3
3.向盐酸中加入浓硫酸会有白雾产生,下列叙述不属于导致产生这种现象的原因是( )
A.浓硫酸具脱水性B.浓硫酸具有吸水性C.盐酸具有挥发性
D.气态物质的溶解度随温度的升高而降低
4.在一台处于平衡的托盘天平的左右两盘中,分别放置两个等质量的盛有浓盐酸和浓硫酸的敞口烧杯,过一段时间后,天平会( )
A.左端下沉 B.右端下沉 C.仍处于平衡 D.无法判断
5.下列检测某溶液pH的操作正确的是( )
A.将pH试纸投入待测液,对照标准比色卡读数
B.用干燥、洁净的玻璃棒蘸取少量待测液,沾在置于洁净表面皿的pH试纸上,待试纸变色后,再对照标准比色卡读数
C.用玻璃棒蘸取待测液沾在用蒸馏水润湿的pH试纸上,对照标准比色卡读数
D.用蒸馏水冲洗玻璃棒,蘸取待测液沾在pH试纸上,对照标准比色卡读数
6.向盛有一定量氧化铁粉末的烧杯中不断加入稀盐酸,烧杯中相关量的变化与图象相符的是( )
A.B.C.D.
7.盐酸、稀硫酸在水溶液中都能产生H+,故有许多共同的性质。下列有关叙述正确的是( )
A.打开盛有浓盐酸和浓硫酸的试剂瓶瓶塞,在瓶口都有白雾B.稀盐酸和稀硫酸都可用于除铁锈
C.浓盐酸、浓硫酸都可用来干燥氧气D.在稀盐酸、稀硫酸中滴加氢氧化钡溶液,都有白色沉淀
8.下列有关酸的叙述中正确的是( )
A.冷的浓盐酸可以用铁桶存放B.硫酸溶液中K+、Ca2+、OH-、Cl-可以大量共存
C.稀盐酸能跟硝酸银反应体现了酸的通性
D.稀硝酸能跟铁反应,但不生成氢气
9.查阅资料可以知道柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出H+,从而呈现酸性,主要用于制造香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的是( )
A.Mg B.Fe2O3 C.CO2 D.Fe
10.实验室的浓硫酸、浓盐酸敞口放置一段时间后,下例图像描述正确的是( )
A.B.C. D.
11.鉴别稀盐酸和稀硫酸选用的试剂是( )
A.氯化钡 B.碳酸钠 C.硝酸银 D.石蕊
12.为研究盐酸的化学性质,小明进行如下实验。其中能产生白色沉淀的是( )
A.B.C. D.
13.用稀盐酸除去铁锈主要成分的原理是( )
A.FeO+2HCl=FeCl2+H2O B.FeO+2HCl=FeCl3+H2O
C.Fe2O3+6HCl=2FeCl2+3H2O D.Fe2O3+6HCl=2FeCl3+3H2O
14.氯气用于自来水的消毒和杀菌,它与水的反应式为Cl2+H2O=HCl+HClO,可用来鉴别自来水与蒸馏水的是( )
A.酚酞试液B.氯化钡溶液C.氢氧化钠溶液 D.硝酸银溶液
15.在Na2CO3溶液中逐渐加入盐酸,反应中溶液pH随加入盐酸质量变化的关系为( )
A. B. C. D.
二、填空题
16.实验室有两瓶标签已经破损的酸溶液,已知它们可能是浓硫酸和浓盐酸。
(1)区分两者的方法是,打开瓶盖就能确定哪瓶是浓盐酸。理由是 。
(2)浓硫酸常用来干燥氧气、氢气、二氧化碳等气体。原因是浓硫酸具有 性。
17.硫酸、盐酸是工业上常用的两种酸。
(1)打开盛有浓盐酸的试剂瓶的瓶盖,可观察到瓶口有 的现象。
(2)对于硫酸而言,溶质的质量分数越大,溶液的酸性越强。常温下,10%的稀硫酸的pH (填“大于”、“小于”或“等于”)2%的稀硫酸的pH。
(3)盐酸的下列用途中,不能用硫酸代替盐酸的是 (填编号)
①金属表面除锈②实验室制取二氧化碳③除去NaCl中的少量NaOH
(4)稀盐酸和稀硫酸具有相似的化学性质的根本原因是都含有相同的 离子(填离子符号)
18.某试剂瓶内装的估计是盐酸,要鉴别是否真是盐酸,应采用的实验操作是:首先用试管取少量待测液,加入 ,然后,再用试管取少量待测液,加入 ,如果是盐酸,前后两步的实验现象是 、 .
19.浓盐酸打开瓶子,瓶口有 ,这是因为浓盐酸具有 ,挥发出的 气体与空气中的 结合形成 .
20.在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图。
(1)该反应的化学方程式为: 。
(2)要得到此变化曲线,所进行的操作是 (填序号)。
①将稀盐酸滴加到氢氧化钠溶液中 ②将氢氧化钠溶液滴加到稀盐酸中
(3)当加入溶液的质量为ag时,所得溶液中的溶质为(写化学式) 。
(4)当加入溶液的质量为bg时,向所得溶液中滴加酚酞溶液,溶液呈 色。
21.实验室采用大理石和稀盐酸反应制取二氧化碳气体,则发生、收集装置应选择图中 (填字母)装置,该实验不能用稀硫酸代替稀盐酸,原因是 .
22.“探险队员”--盐酸,不小心走进了科学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或水溶液),盐酸必须避开它们,否则就无法通过。
(1)请你帮助他走出迷宫(请用图中物质前的序号依次连接起来表示他所走的路线)入口→ →出口。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有 个,其中能“吃掉”盐酸的盐是 (填物质的名称)。
(3)在不能与盐酸反应的物质中,写出一个能与硝酸银溶液反应的化学方程式 。
(4)如果将盐酸换成氢氧化钾溶液,它能沿着盐酸走出的路线“走出”这个迷宫吗?为什么? 。
三、解答题
23.鸡蛋壳的主要成分是碳酸钙,为了测定蛋壳中碳酸钙的质量分数,小衢和小州同学进行了如下实验:他俩将蛋壳洗净、干燥并捣碎放在烧杯里,然后往烧杯中加入足量盐酸。实验过程和测定的相关实验数据如下图所示:
(1)小衢根据“蛋壳残渣4.3g”,求得蛋壳中碳酸钙质量分数为 。
(2)小州根据“反应过程中减少的质量”也求得了蛋壳中碳酸钙的质量分数,请写出计算的过程。
(3)小州与小衢求得的结果有明显差别,请你分析其中可能的原因 。
25.某学校科学兴趣小组在实验室制取二氧化碳后,对反应后的溶液W进行成分分析及测定:取反应后的溶液W(50g)放入洁净烧杯中,然后逐渐加入10.6%的Na2CO3溶液,测得杯中溶液质量与加入的Na2CO3溶液质量之间的关系图像,如图所示,请仔细分析反应及图像数据,试求:
(1)根据图像曲线变化及分析可知:W溶液含有的溶质是 (填化学式);
(2)与AB段有关的反应方程式 ;BC段对应的现象是 ;
(3)分析计算:B点坐标中的y和C点坐标中的x分别是多少?
26.安多夫是一种“嫩肉粉”,是食品添加剂的一种。安多夫的成分是碳酸氢钠和氯化钠。(其中碳酸氢钠与盐酸反应的化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑)。
某科学兴趣小组为了测定某种安多夫中碳酸氢钠的含量做了以下实验:取10克安多夫粉末,分多次放入盛有100克稀盐酸的烧杯中充分反应。测出加入的粉末质量和反应后的溶液质量,两者质量关系如图所示。
(1)实验后,兴趣小组又往烧杯中加入少量粉末,观察到 ,说明上述实验结束时稀盐酸过量。
(2)计算这种安多夫中碳酸氢钠的质量。
(3)计算上述反应结束后所得氯化钠溶液的溶质质量分数。(计算结果精确到0.1%)
27.某同学向质量分数为 7.3%的稀盐酸溶液中加入碳酸钙样品(含有杂质,且杂质不与酸反应也不溶于水),记录反应过程中有关的实验数据,最后得到下列图像。
(1)甲图中 a 点的 pH 值为 。
(2)本实验不要浓盐酸的原因是因为浓盐酸具有 性。
(3)样品中碳酸钙的质量分数为多少?
28.实验室保存﹣瓶浓盐酸,瓶上的标签部分内容如图所示,请根据标签上的信息回答下列各问:
(1)这﹣瓶浓盐酸中溶质的质量是多少克?(结果精确到0.1)
(2)取100克此瓶内的浓盐酸可以稀释成1.85%的稀盐酸多少克?同时加水多少克?
四、实验探究题
29.为验证“酸的化学通性”,某班同学在实验室进行如下实验。请分析并回答相关问题:
(1)写出能证明A中反应发生的现象 。
(2)要全面验证酸的化学通性,D试管中能与酸反应的固体单质是 (写一种即可)。
(3)实验完成后,将全部废液倒入废液缸内,测得pH=2,则废液中所含溶质最多有 种(溶质不计指示剂与气体)。
30.化学使世界变得绚丽多彩。如图是物质之间发生化学反应的颜色变化。
(1)请你在编号②、③处各填入一种物质。②是 ;③是 。
(2)根据图可以总结出稀盐酸的4个化学性质。请你写出编号①稀盐酸的化学性质 。
(3)编号④中产生白色沉淀,其化学式为 ;请写出编号③中的化学方程式 。
答案解析部分
1.【答案】A2.【答案】C3.【答案】A4.【答案】B5.【答案】B6.【答案】A7.【答案】B8.【答案】D
9.【答案】C10.【答案】C11.【答案】A12.【答案】A13.【答案】D14.【答案】D15.【答案】D
16.【答案】(1)浓盐酸具有挥发性
(2)吸水
17.【答案】(1)白雾形成或有刺激性气味的气体
(2)小于
(3)②③
(4)H+
18.【答案】紫色石蕊溶液;硝酸银溶液和稀硝酸;紫色石蕊溶液变红色;产生不溶于稀硝酸的白色沉淀
19.【答案】白雾;挥发性;氯化氢气体;水蒸气;盐酸小液滴
20.【答案】(1)NaOH+HCl=NaCl+H2O
(2)②
(3)HCl、NaCl
(4)红
21.【答案】CE;大理石与稀硫酸反应生成微溶于水的硫酸钙,硫酸钙覆盖在大理石表面,阻止反应进一步进行
22.【答案】(1)③→⑥→⑩→⑦→ →
(2)2;碳酸钠
(3)NaCl+AgNO3═AgCl↓+NaNO3
(4)不能;氢氧化钾与二氧化碳反应,从而被“吃掉”
23.【答案】(1)57%
(2)根据质量守恒定律,产生二氧化碳的质量=10g+100g-106.7g=3.3g,
设鸡蛋壳中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 3.3g
;
解得:x=7.5g。
该鸡蛋壳中碳酸钙的质量分数:。
(3)盐酸有挥发性,使CO2质量偏大
24.【答案】(1)3、4
(2)4.4
(3)80%
(4)解:以第3次反应进行分析,加15g样品,50g稀盐酸反应完全,生成4.4gCO2。设50g稀盐酸中HCl的质量为y。
CaCO3+ 2HCl=CaCl2+H2O+ CO2↑
73 44
y 4.4g
,
y=7.3g,
即稀盐酸中溶质的质量分数为 =14.6%。
25.【答案】(1)CaCl2、HCl
(2)Na2CO3+2HCl=2NaCl+H2O+CO2↑;有白色沉淀产生
(3)40g碳酸钠溶液中含溶质的质量为40g×10.6%=4.24g
设碳酸钠与盐酸反应产生二氧化碳气体的质量为m
Na2CO3+2HCl=2NaCl+H2O+ CO2↑
106 44
4.24g m
m=1.76g
B点时烧杯中溶液的质量为50g+40g -1.76g=88.24g,B点坐标中的y为88.24;
与氯化钙反应的碳酸钠的质量为(x-40g)×10.6%,根据质量守恒定律,反应产生碳酸钙沉淀的质量为x+50g-1.76g-196.24g=x-148g
Na2CO3+CaCl2= CaCO3↓+2NaCl
106 100
(x-40g)×10.6% x-148g
x=160g
C点坐标中的x为160。
26.【答案】(1)固体继续溶解,产生气泡
(2)由图中数据可知,反应结束后产生二氧化碳质量为100+10-105.6=4.4g;
设碳酸氢钠质量为x,生成氯化钠质量为Y
NaHCO3+HCl=NaCl+H2O+CO2↑
84 58.5 44
x y 4.4g
84:44=x:4.4g 58.5:44=y:4.4g
x=8.4g y=5.85g
(3)反应结束后所得氯化钠溶液的溶质质量分数为。
27.【答案】(1)7
(2)挥发
(3)解:设碳酸钙的质量为 x,
CaCO 3+ 2HCl= CaCl 2 +H2O+ CO2↑
100 73 44
x 6.6g
100:x=44:6.6g x=15g
样品中碳酸钙的质量分数为:15g/20g×100%=75%
28.【答案】解:(1)500mL=500cm3,这﹣瓶浓盐酸中溶质的质量是1.19g/cm3×500cm3×37%≈220.2g.
(2)设可以稀释成1.85%的稀盐酸的质量为x,根据溶液稀释前后溶质的质量不变,
则100g×37%=x×1.85% x=2000g.
同时加水的质量为2000g﹣100g=1900g.
答:(1)这﹣瓶浓盐酸中溶质的质量是220.2g;(2)可以稀释成1.85%的稀盐酸2000g,同时加水1900g.
29.【答案】(1)溶液红色褪去
(2)铁
(3)4
30.【答案】(1)铁(或Fe);氧化铜(或CuO)
(2)盐酸可使紫色石蕊试液变红
(3)AgCl;CuO+2HCl=CuCl2+H2O
1 / 1
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
