1.3氧化还原反应 课件(共43张PPT)高中化学苏教版必修第一册专题三
文档属性
| 名称 | 1.3氧化还原反应 课件(共43张PPT)高中化学苏教版必修第一册专题三 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-26 23:36:37 | ||
图片预览











文档简介
(共43张PPT)
第3课时 氧化还原反应
课标定位素养阐释
1.能从微观视角理解电子转移与元素化合价变化的关系。
2.能用线桥分析氧化还原反应中电子转移的方向及数目。
3.能通过模型认知理解氧化还原反应的规律。
氧化还原反应
1.基本概念。
(1)定义:反应过程中有电子转移的化学反应。
(2)特征:反应前后元素的化合价发生了变化。
(3)关系:得电子,化合价降低;失电子,化合价升高。
如:2Mg+O2 2MgO反应中,Mg失去最外层2个电子,变为Mg2+,镁元素的化合价从0价升高到+2价,氧原子得到2个电子变为氧离子,形成稳定的电子层结构,从0价降低为-2价。
2.氧化还原反应概念间的关系。
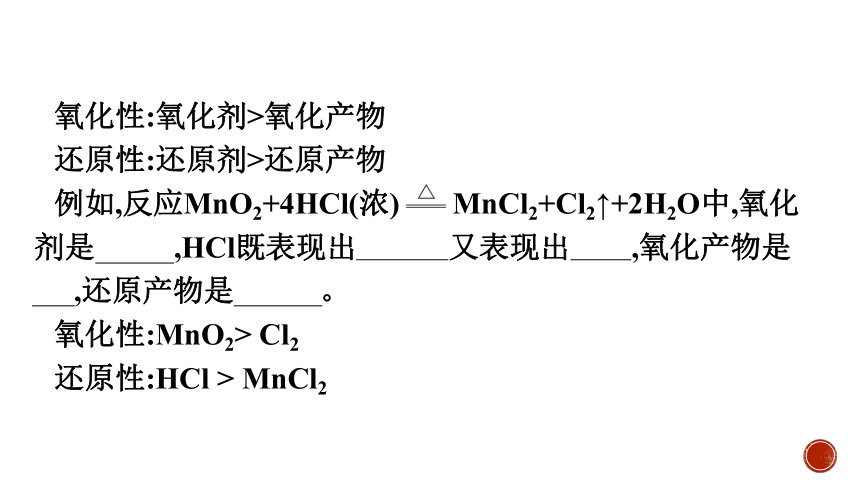
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
例如,反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O中,氧化剂是MnO2,HCl既表现出还原性又表现出酸性,氧化产物是Cl2,还原产物是MnCl2。
氧化性:MnO2> Cl2
还原性:HCl > MnCl2
3.常见氧化剂与还原剂。
(1)氧化剂:在反应中得到电子的物质。
常见氧化剂包括某些活泼的非金属单质、元素处于高价时的物质、过氧化物等。如:
氧化剂 —— Cl2 KMnO4
↓ ↓ ↓
还原产物——Cl- Mn2+
(2)还原剂:在反应中失去电子的物质。
常见还原剂包括活泼的金属单质、某些活泼的非金属单质、元素处于低价态时的物质等。如:
还原剂 —— Zn H2 CO
↓ ↓ ↓ ↓
氧化产物——Zn2+ H2O CO2
(3)具有中间价态的物质既有氧化性,又有还原性。
在一个氧化还原反应中,氧化剂和还原剂同时存在,它们可以是不同的物质,也可以是同一物质。如在反应Cl2+2NaOH══NaCl+NaClO+H2O中,Cl2既是氧化剂,又是还原剂。
【自主思考1】 氧化还原反应中是否所有元素的化合价都发生变化
提示:不一定;如Zn+H2SO4══ZnSO4+H2↑的反应中,Zn、H两种元素的化合价发生了变化,而S、O两种元素的化合价没有发生变化。
【自主思考2】 非金属单质在氧化还原反应中作反应物时一定是氧化剂吗 为什么
提示:不一定。非金属单质在氧化还原反应中,可能作氧化剂,如:Cl2、O2;也可能作还原剂,如:C、H2。
【自主思考3】 金属单质在氧化还原反应中作反应物时一定是还原剂吗 为什么
提示:是。金属无负价,在氧化还原反应中作反应物时一定是失电子,化合价升高,作还原剂。
【效果自测】
1.判断正误,正确的画“√”,错误的画“×”。
(1)有单质参加或有单质生成的化学反应一定是氧化还原反应。( )
(2)活泼金属通常只能作还原剂。( )
(3)氧化还原反应中的反应物,不是氧化剂就是还原剂。( )
(4)某元素从游离态变为化合态,该元素可能被氧化也可能被还原。( )
×
√
×
√
2.下列反应中:HCl作还原剂的是 ,HCl作氧化剂的是 ,HCl为还原产物的是 。
答案:② ⑤ ③
问题引领
1.实验室用反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O制备氯气,若生成1 mol氯气,转移多少摩尔电子
提示:氯元素从-1价升高到0价,1个氯原子失去1个电子。生成1 mol氯气,共失2 mol电子。因此转移2 mol电子。
探究任务1 氧化还原反应中电子转移的分析
2.ClO2是一种高效水处理剂,实验室通过以下反应制得ClO2: 2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O。
(1)上述反应中,若生成1 mol ClO2,反应转移电子的物质的量是多少
提示:1 mol。KClO3中Cl元素从+5价变为+4价,生成1分子ClO2,反应转移1个电子。
(2)上述反应中,失去的电子总数与得到的电子总数有什么关系
提示:相等。根据化学方程式中KClO3中Cl元素从+5价变为+4价,2个Cl原子共得到2个电子,H2C2O4中C元素从+3价变为+4价,2个C原子共失去2个电子,即得失电子总数相等。
归纳提升
常见电子转移的分析方法:
通常用电子转移的方向和数目来表示一个氧化还原反应。常用分析方法是双线桥法和单线桥法。
(1)双线桥法:表明同一元素反应前后的电子转移情况。
①双线桥法表示电子转移的基本步骤:
标价态—正确标明反应中化合价发生变化的元素的化合价,判断其升降
↓
连双线—一条线由反应物中较低价变价元素指向氧化产物中的相应元素,另一条线由反应物中较高价变价元素指向还原产物中的相应元素
↓
标得失—标出“失去”或“得到”电子的总数
③注意事项:
a.箭尾、箭头必须指向反应物、生成物中相应的同种元素。
b.采用a×be-形式表示得失电子数,a为得失电子的原子总数,b为每个原子得失电子数,a、b是“1”时省略。得到与失去的电子总数相等。
(2)单线桥法:表明反应中化合价变化的元素原子间的电子转移情况。
①单线桥法表示电子转移的基本步骤:
标价态—正确标明反应中化合价发生变化的元素的化合价,判断其升降,进而确定转移电子的数目
↓
连单线—从反应物中化合价升高的元素出发,箭头指向反应物中化合价降低的元素
↓
标转移—标出转移的电子总数
③注意事项:
a.单线桥法从反应物中失电子的原子指向反应物中得电子的原子,表示反应物中变价元素原子间电子的转移情况;
b.箭头已标明电子转移的方向,因此不需再标明“得到”或“失去”,只标明电子转移数目。
典型例题
【例题1】 下列氧化还原反应中,电子转移的方向和数目均正确的是( )。
B
解析:A项,该反应中转移电子数为12e-,错误;C项,该反应中铜元素化合价由+2价到0价,铜原子得到电子,碳原子失去电子,错误;D项,该反应氧元素化合价由0价变为-2价,氧原子得电子总数是4e-,错误。
【变式训练1】 H2O2在Fe2(SO4)3催化下发生分解反应,写出H2O2分解反应的化学方程式并用双线桥标出电子转移的方向和数目。
答案:
【变式训练2】 (1)分析下列反应的化学方程式,是氧化还原反应的用双线桥法标出电子转移的方向和数目,指出被氧化和被还原的元素。
①2Na+Cl2══2NaCl
②NaOH+HCl══NaCl+H2O
③Co2O3+6HCl(浓)══2CoCl2+Cl2↑+3H2O
(2)漂白粉长期露置于空气中失效,最终会生成CaCl2,请写出该过程所涉及的化学方程式,若是氧化还原反应的用单线桥法标出电子转移的方向和数目。
钠元素被氧化,氯元素被还原。
②非氧化还原反应。
氯元素被氧化,钴元素被还原。
(2)Ca(ClO)2+H2O+CO2══CaCO3+2HClO 非氧化还原反应
CaCO3+2HCl══CaCl2+H2O+CO2↑ 非氧化还原反应
问题引领
1.将CO2气体通入CaCl2溶液,溶液不会变浑浊,这是因为碳酸酸性弱于盐酸。而CaCO3+2HCl══CaCl2+H2O+CO2↑是合理的,符合强酸制弱酸的规律。在氧化还原反应中,也存在类似规律,试分析将铜粉投入硫酸亚铁溶液中,能否置换出铁
提示:不能。因为铁的还原性强于铜,铜不能与硫酸亚铁反应生成铁。
探究任务2 氧化还原反应的基本规律
2.浓硫酸具有强氧化性,SO2具有还原性,浓硫酸会与SO2发生氧化还原反应,所以SO2不能用浓硫酸干燥,这句话对吗
提示:不对。浓硫酸中的S为+6价,SO2中的S为+4价,它们之间没有中间价态,SO2与浓硫酸不发生反应,所以可以用浓硫酸干燥SO2。
归纳提升
氧化还原反应的规律
规律1 守恒律——得失电子相等。
氧化还原反应中氧化剂得电子总数等于还原剂失电子总数。
规律2 转化律——价态归中不交叉。
同种元素不同价态之间发生氧化还原反应时,其反应规律可总结为:价态相邻能共存,价态相间能归中;归中价态不交叉,低升高降只靠拢。
例如,不同价态含硫物质之间发生氧化还原反应时,H2S与SO2反应可以生成硫单质(硫元素化合价为0价);H2S 与浓硫酸反应时,H2S中硫元素由-2价升高到0价,浓硫酸中硫元素由+6价降低到+4价。
规律3 强弱律——以强制弱。
氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
特点:比什么性,找什么剂,产物之性弱于剂。
规律4 先后规律——强者优先。
在浓度相差不大的溶液中:
(1)同时含有几种还原剂时,加入氧化剂,将按照还原性由强到弱的顺序依次反应。如在FeBr2溶液中通入少量Cl2时,因为还原性Fe2+>Br-,所以Fe2+先与Cl2反应。
(2)同时含有几种氧化剂时,加入还原剂,将按照氧化性由强到弱的顺序依次反应。如在含有Fe3+、Cu2+的溶液中加入Fe粉,因为氧化性Fe3+>Cu2+,所以Fe粉先与Fe3+反应,然后再与Cu2+反应。
典型例题
【例题2】 根据下列反应判断有关物质还原性由强到弱的顺序是( )。
①H2SO3+I2+H2O══2HI+H2SO4
②2FeCl3+2HI══2FeCl2+2HCl+I2
A.H2SO3>HI>FeCl2
B.HI>FeCl2>H2SO3
C.FeCl2>HI>H2SO3
D.FeCl2>H2SO3>HI
A
解析:反应①中,还原剂是H2SO3,还原产物是HI,还原性H2SO3>HI。反应②中,还原剂是HI,还原产物是FeCl2,还原性HI>FeCl2。所以,还原性H2SO3>HI>FeCl2。
【例题3】 金属铜的提炼多从黄铜矿开始,黄铜矿在焙烧过程中主要反应之一的化学方程式为2CuFeS2+O2 Cu2S+2FeS+SO2。下列说法不正确的是( )。
A.O2只作氧化剂
B.CuFeS2既是氧化剂又是还原剂
C.SO2既是氧化产物又是还原产物
D.若有1 mol O2参加反应,则反应中共有4 mol电子转移
答案:D
解析:反应中元素的化合价变化为
在反应中,CuFeS2既是氧化剂又是还原剂,O2只作氧化剂,SO2既是氧化产物又是还原产物,若有1 mol O2参加反应,则反应中共有6 mol电子转移。
【变式训练3】 已知下列反应:
反应Ⅰ Co2O3+6HCl(浓)══2CoCl2+Cl2↑+3H2O
反应Ⅱ 5Cl2+I2+6H2O══10HCl+2HIO3
下列说法正确的是( )。
A.反应Ⅰ中HCl是氧化剂
B.反应Ⅱ中Cl2发生氧化反应
C.氧化性:Co2O3>Cl2>HIO3
D.还原性:CoCl2>HCl>I2
答案:C
解析:反应Ⅰ中氯元素的化合价升高,则HCl为还原剂,A项错误;反应Ⅱ中氯元素的化合价降低,则Cl2发生还原反应,B项错误;由氧化剂的氧化性强于氧化产物的氧化性可知,反应Ⅰ中氧化性:Co2O3>Cl2,反应Ⅱ中氧化性:Cl2>HIO3,则氧化性:Co2O3>Cl2>HIO3,C项正确;由还原剂的还原性强于还原产物的还原性,反应Ⅰ中还原性:HCl>CoCl2,反应Ⅱ中还原性:I2>HCl,故还原性:I2>HCl>CoCl2,D项错误。
【变式训练4】 (双选)反应①②分别是从海藻灰和某种矿石中提取碘的主要反应:①2NaI+MnO2+3H2SO4══2NaHSO4+MnSO4+2H2O+I2;②2NaIO3+5NaHSO3══2Na2SO4+3NaHSO4+H2O+I2。
下列说法正确的是( )。
A.两个反应中硫元素均被氧化
B.碘元素在反应①中被氧化,在反应②中被还原
D.反应①②中生成等量的I2时,转移电子数之比为1∶5
BD
解析:反应①中硫元素化合价未发生变化,反应②中硫元素化合价升高,被氧化,A错误;反应①中碘元素化合价升高,被氧化,反应②中碘元素化合价降低,被还原,B正确;由反应①可知氧化性:MnO2>I2,由反应②可知氧化性: ,C错误;由反应①得,生成1个I2转移2个电子,由反应②得,生成1个I2转移10个电子,所以当生成等量的I2时,转移电子数之比为1∶5,D正确。
第3课时 氧化还原反应
课标定位素养阐释
1.能从微观视角理解电子转移与元素化合价变化的关系。
2.能用线桥分析氧化还原反应中电子转移的方向及数目。
3.能通过模型认知理解氧化还原反应的规律。
氧化还原反应
1.基本概念。
(1)定义:反应过程中有电子转移的化学反应。
(2)特征:反应前后元素的化合价发生了变化。
(3)关系:得电子,化合价降低;失电子,化合价升高。
如:2Mg+O2 2MgO反应中,Mg失去最外层2个电子,变为Mg2+,镁元素的化合价从0价升高到+2价,氧原子得到2个电子变为氧离子,形成稳定的电子层结构,从0价降低为-2价。
2.氧化还原反应概念间的关系。
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
例如,反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O中,氧化剂是MnO2,HCl既表现出还原性又表现出酸性,氧化产物是Cl2,还原产物是MnCl2。
氧化性:MnO2> Cl2
还原性:HCl > MnCl2
3.常见氧化剂与还原剂。
(1)氧化剂:在反应中得到电子的物质。
常见氧化剂包括某些活泼的非金属单质、元素处于高价时的物质、过氧化物等。如:
氧化剂 —— Cl2 KMnO4
↓ ↓ ↓
还原产物——Cl- Mn2+
(2)还原剂:在反应中失去电子的物质。
常见还原剂包括活泼的金属单质、某些活泼的非金属单质、元素处于低价态时的物质等。如:
还原剂 —— Zn H2 CO
↓ ↓ ↓ ↓
氧化产物——Zn2+ H2O CO2
(3)具有中间价态的物质既有氧化性,又有还原性。
在一个氧化还原反应中,氧化剂和还原剂同时存在,它们可以是不同的物质,也可以是同一物质。如在反应Cl2+2NaOH══NaCl+NaClO+H2O中,Cl2既是氧化剂,又是还原剂。
【自主思考1】 氧化还原反应中是否所有元素的化合价都发生变化
提示:不一定;如Zn+H2SO4══ZnSO4+H2↑的反应中,Zn、H两种元素的化合价发生了变化,而S、O两种元素的化合价没有发生变化。
【自主思考2】 非金属单质在氧化还原反应中作反应物时一定是氧化剂吗 为什么
提示:不一定。非金属单质在氧化还原反应中,可能作氧化剂,如:Cl2、O2;也可能作还原剂,如:C、H2。
【自主思考3】 金属单质在氧化还原反应中作反应物时一定是还原剂吗 为什么
提示:是。金属无负价,在氧化还原反应中作反应物时一定是失电子,化合价升高,作还原剂。
【效果自测】
1.判断正误,正确的画“√”,错误的画“×”。
(1)有单质参加或有单质生成的化学反应一定是氧化还原反应。( )
(2)活泼金属通常只能作还原剂。( )
(3)氧化还原反应中的反应物,不是氧化剂就是还原剂。( )
(4)某元素从游离态变为化合态,该元素可能被氧化也可能被还原。( )
×
√
×
√
2.下列反应中:HCl作还原剂的是 ,HCl作氧化剂的是 ,HCl为还原产物的是 。
答案:② ⑤ ③
问题引领
1.实验室用反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O制备氯气,若生成1 mol氯气,转移多少摩尔电子
提示:氯元素从-1价升高到0价,1个氯原子失去1个电子。生成1 mol氯气,共失2 mol电子。因此转移2 mol电子。
探究任务1 氧化还原反应中电子转移的分析
2.ClO2是一种高效水处理剂,实验室通过以下反应制得ClO2: 2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O。
(1)上述反应中,若生成1 mol ClO2,反应转移电子的物质的量是多少
提示:1 mol。KClO3中Cl元素从+5价变为+4价,生成1分子ClO2,反应转移1个电子。
(2)上述反应中,失去的电子总数与得到的电子总数有什么关系
提示:相等。根据化学方程式中KClO3中Cl元素从+5价变为+4价,2个Cl原子共得到2个电子,H2C2O4中C元素从+3价变为+4价,2个C原子共失去2个电子,即得失电子总数相等。
归纳提升
常见电子转移的分析方法:
通常用电子转移的方向和数目来表示一个氧化还原反应。常用分析方法是双线桥法和单线桥法。
(1)双线桥法:表明同一元素反应前后的电子转移情况。
①双线桥法表示电子转移的基本步骤:
标价态—正确标明反应中化合价发生变化的元素的化合价,判断其升降
↓
连双线—一条线由反应物中较低价变价元素指向氧化产物中的相应元素,另一条线由反应物中较高价变价元素指向还原产物中的相应元素
↓
标得失—标出“失去”或“得到”电子的总数
③注意事项:
a.箭尾、箭头必须指向反应物、生成物中相应的同种元素。
b.采用a×be-形式表示得失电子数,a为得失电子的原子总数,b为每个原子得失电子数,a、b是“1”时省略。得到与失去的电子总数相等。
(2)单线桥法:表明反应中化合价变化的元素原子间的电子转移情况。
①单线桥法表示电子转移的基本步骤:
标价态—正确标明反应中化合价发生变化的元素的化合价,判断其升降,进而确定转移电子的数目
↓
连单线—从反应物中化合价升高的元素出发,箭头指向反应物中化合价降低的元素
↓
标转移—标出转移的电子总数
③注意事项:
a.单线桥法从反应物中失电子的原子指向反应物中得电子的原子,表示反应物中变价元素原子间电子的转移情况;
b.箭头已标明电子转移的方向,因此不需再标明“得到”或“失去”,只标明电子转移数目。
典型例题
【例题1】 下列氧化还原反应中,电子转移的方向和数目均正确的是( )。
B
解析:A项,该反应中转移电子数为12e-,错误;C项,该反应中铜元素化合价由+2价到0价,铜原子得到电子,碳原子失去电子,错误;D项,该反应氧元素化合价由0价变为-2价,氧原子得电子总数是4e-,错误。
【变式训练1】 H2O2在Fe2(SO4)3催化下发生分解反应,写出H2O2分解反应的化学方程式并用双线桥标出电子转移的方向和数目。
答案:
【变式训练2】 (1)分析下列反应的化学方程式,是氧化还原反应的用双线桥法标出电子转移的方向和数目,指出被氧化和被还原的元素。
①2Na+Cl2══2NaCl
②NaOH+HCl══NaCl+H2O
③Co2O3+6HCl(浓)══2CoCl2+Cl2↑+3H2O
(2)漂白粉长期露置于空气中失效,最终会生成CaCl2,请写出该过程所涉及的化学方程式,若是氧化还原反应的用单线桥法标出电子转移的方向和数目。
钠元素被氧化,氯元素被还原。
②非氧化还原反应。
氯元素被氧化,钴元素被还原。
(2)Ca(ClO)2+H2O+CO2══CaCO3+2HClO 非氧化还原反应
CaCO3+2HCl══CaCl2+H2O+CO2↑ 非氧化还原反应
问题引领
1.将CO2气体通入CaCl2溶液,溶液不会变浑浊,这是因为碳酸酸性弱于盐酸。而CaCO3+2HCl══CaCl2+H2O+CO2↑是合理的,符合强酸制弱酸的规律。在氧化还原反应中,也存在类似规律,试分析将铜粉投入硫酸亚铁溶液中,能否置换出铁
提示:不能。因为铁的还原性强于铜,铜不能与硫酸亚铁反应生成铁。
探究任务2 氧化还原反应的基本规律
2.浓硫酸具有强氧化性,SO2具有还原性,浓硫酸会与SO2发生氧化还原反应,所以SO2不能用浓硫酸干燥,这句话对吗
提示:不对。浓硫酸中的S为+6价,SO2中的S为+4价,它们之间没有中间价态,SO2与浓硫酸不发生反应,所以可以用浓硫酸干燥SO2。
归纳提升
氧化还原反应的规律
规律1 守恒律——得失电子相等。
氧化还原反应中氧化剂得电子总数等于还原剂失电子总数。
规律2 转化律——价态归中不交叉。
同种元素不同价态之间发生氧化还原反应时,其反应规律可总结为:价态相邻能共存,价态相间能归中;归中价态不交叉,低升高降只靠拢。
例如,不同价态含硫物质之间发生氧化还原反应时,H2S与SO2反应可以生成硫单质(硫元素化合价为0价);H2S 与浓硫酸反应时,H2S中硫元素由-2价升高到0价,浓硫酸中硫元素由+6价降低到+4价。
规律3 强弱律——以强制弱。
氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
特点:比什么性,找什么剂,产物之性弱于剂。
规律4 先后规律——强者优先。
在浓度相差不大的溶液中:
(1)同时含有几种还原剂时,加入氧化剂,将按照还原性由强到弱的顺序依次反应。如在FeBr2溶液中通入少量Cl2时,因为还原性Fe2+>Br-,所以Fe2+先与Cl2反应。
(2)同时含有几种氧化剂时,加入还原剂,将按照氧化性由强到弱的顺序依次反应。如在含有Fe3+、Cu2+的溶液中加入Fe粉,因为氧化性Fe3+>Cu2+,所以Fe粉先与Fe3+反应,然后再与Cu2+反应。
典型例题
【例题2】 根据下列反应判断有关物质还原性由强到弱的顺序是( )。
①H2SO3+I2+H2O══2HI+H2SO4
②2FeCl3+2HI══2FeCl2+2HCl+I2
A.H2SO3>HI>FeCl2
B.HI>FeCl2>H2SO3
C.FeCl2>HI>H2SO3
D.FeCl2>H2SO3>HI
A
解析:反应①中,还原剂是H2SO3,还原产物是HI,还原性H2SO3>HI。反应②中,还原剂是HI,还原产物是FeCl2,还原性HI>FeCl2。所以,还原性H2SO3>HI>FeCl2。
【例题3】 金属铜的提炼多从黄铜矿开始,黄铜矿在焙烧过程中主要反应之一的化学方程式为2CuFeS2+O2 Cu2S+2FeS+SO2。下列说法不正确的是( )。
A.O2只作氧化剂
B.CuFeS2既是氧化剂又是还原剂
C.SO2既是氧化产物又是还原产物
D.若有1 mol O2参加反应,则反应中共有4 mol电子转移
答案:D
解析:反应中元素的化合价变化为
在反应中,CuFeS2既是氧化剂又是还原剂,O2只作氧化剂,SO2既是氧化产物又是还原产物,若有1 mol O2参加反应,则反应中共有6 mol电子转移。
【变式训练3】 已知下列反应:
反应Ⅰ Co2O3+6HCl(浓)══2CoCl2+Cl2↑+3H2O
反应Ⅱ 5Cl2+I2+6H2O══10HCl+2HIO3
下列说法正确的是( )。
A.反应Ⅰ中HCl是氧化剂
B.反应Ⅱ中Cl2发生氧化反应
C.氧化性:Co2O3>Cl2>HIO3
D.还原性:CoCl2>HCl>I2
答案:C
解析:反应Ⅰ中氯元素的化合价升高,则HCl为还原剂,A项错误;反应Ⅱ中氯元素的化合价降低,则Cl2发生还原反应,B项错误;由氧化剂的氧化性强于氧化产物的氧化性可知,反应Ⅰ中氧化性:Co2O3>Cl2,反应Ⅱ中氧化性:Cl2>HIO3,则氧化性:Co2O3>Cl2>HIO3,C项正确;由还原剂的还原性强于还原产物的还原性,反应Ⅰ中还原性:HCl>CoCl2,反应Ⅱ中还原性:I2>HCl,故还原性:I2>HCl>CoCl2,D项错误。
【变式训练4】 (双选)反应①②分别是从海藻灰和某种矿石中提取碘的主要反应:①2NaI+MnO2+3H2SO4══2NaHSO4+MnSO4+2H2O+I2;②2NaIO3+5NaHSO3══2Na2SO4+3NaHSO4+H2O+I2。
下列说法正确的是( )。
A.两个反应中硫元素均被氧化
B.碘元素在反应①中被氧化,在反应②中被还原
D.反应①②中生成等量的I2时,转移电子数之比为1∶5
BD
解析:反应①中硫元素化合价未发生变化,反应②中硫元素化合价升高,被氧化,A错误;反应①中碘元素化合价升高,被氧化,反应②中碘元素化合价降低,被还原,B正确;由反应①可知氧化性:MnO2>I2,由反应②可知氧化性: ,C错误;由反应①得,生成1个I2转移2个电子,由反应②得,生成1个I2转移10个电子,所以当生成等量的I2时,转移电子数之比为1∶5,D正确。
