人教版九年级化学 第十单元 课题1 常见的酸和碱 课时2 酸的化学性质课件(共23张PPT)
文档属性
| 名称 | 人教版九年级化学 第十单元 课题1 常见的酸和碱 课时2 酸的化学性质课件(共23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 669.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-27 09:50:09 | ||
图片预览






文档简介
(共23张PPT)
第十单元 酸 和 碱
课题1 常见的酸和碱
课时2 酸的化学性质
目录
01
课程要求
02
03
04
知识点精讲
课堂检测
课前预习
1. 以盐酸和硫酸为例,通过实验探究认识酸的主要化学性质和用途,并能用化学方程式表示。
2. 能利用酸的性质,分析、解释一些简单的化学现象和事实。
有气泡产生,溶液由
无色变为浅绿色
H2↑+FeSO4
大理石和稀盐酸
+CO2↑
1. 酸与指示剂作用,酸使紫色石蕊溶液变 红 , 不能 使无色酚酞溶液变色。
2. 酸与活泼金属反应生成 金属化合物(盐) 和 氢气 (基本反应类型为 置换反应 ,酸主要是指 稀盐酸 和 稀硫酸 ,金属主要是指在金属活动性顺序表中排在 氢 前的金属,K、Ca、Na除外)。
红
不
能
金属化合物(盐)
氢
气
置换反应
稀
盐酸
稀硫酸
氢
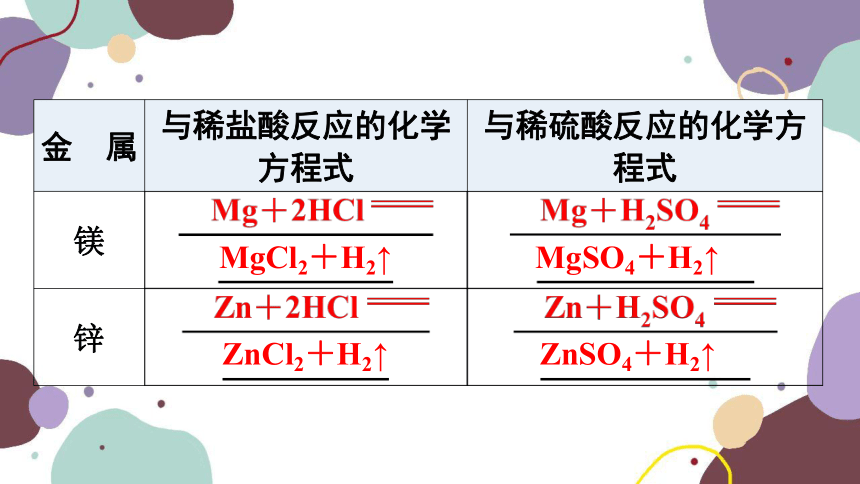
知识点 酸的化学性质
金 属 与稀盐酸反应的化学方程式 与稀硫酸反应的化学方程式
镁
锌
MgCl2+H2↑
MgSO4+H2↑
ZnCl2+H2↑
ZnSO4+H2↑
FeCl2+H2↑
FeSO4+H2↑
金 属 与稀盐酸反应的化学方程式 与稀硫酸反应的化学方程式
铁
续表
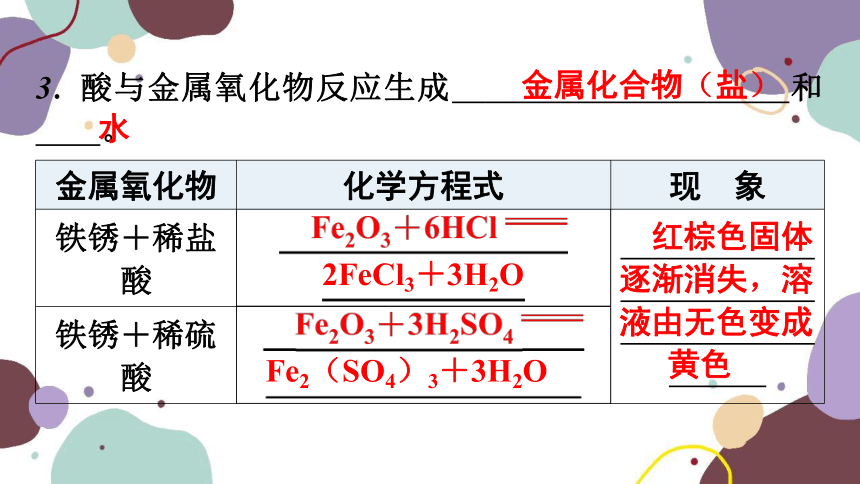
3. 酸与金属氧化物反应生成 金属化合物(盐) 和 水 。
金属氧化物 化学方程式 现 象
铁锈+稀盐酸 红棕色固体逐渐消失,溶液由无色变成黄色
铁锈+稀硫酸
金属化合物(盐)
水
2FeCl3+3H2O
红棕色固体
逐渐消失,溶
液由无色变成
黄色
Fe2(SO4)3+3H2O
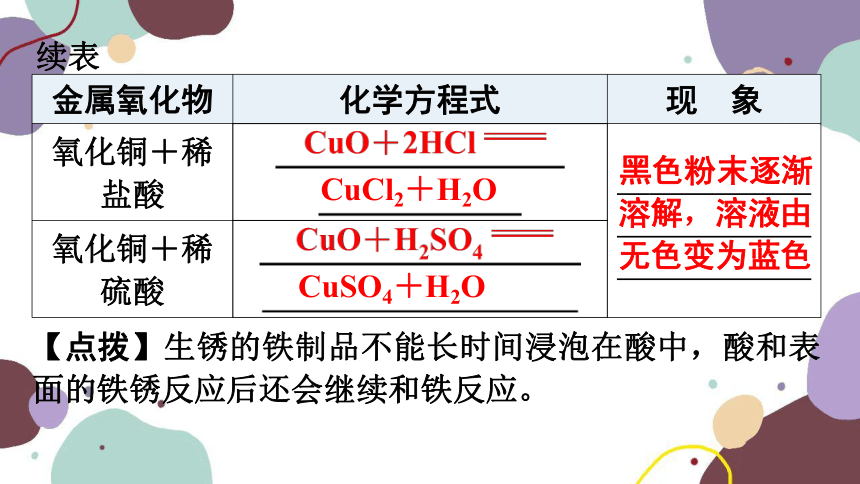
金属氧化物 化学方程式 现 象
氧化铜+稀盐酸 红棕色固体逐渐消失,溶液由无色变成
氧化铜+稀硫酸
CuCl2+H2O
黑色粉末逐渐
溶解,溶液由
无色变为蓝色
CuSO4+H2O
【点拨】生锈的铁制品不能长时间浸泡在酸中,酸和表面的铁锈反应后还会继续和铁反应。
续表
课堂练习
1. 我国获批使用的新冠疫苗中,最早期的灭活疫苗是在石炭酸(化学式为C6H6O,具有酸的性质)防腐的条件下制成的。下列关于石炭酸的说法正确的是( D )
A. 紫色石蕊溶液遇石炭酸变蓝色
B. 石炭酸的水溶液中不一定含H+
C. 石炭酸属于氧化物
D. 石炭酸能与活泼金属反应生成氢气
D
2. 利用图10-1-5所示装置对酸的化学性质探究。
图10-1-5
(1)实验A中,在点滴板的a、b穴中滴入酸溶液后,溶液变红的是 a (填“a”或“b”)穴,发生了 化学 (填“物理”或“化学”)变化;使用点滴板的优点之一是 节约药品 。
(2)实验B中,①②中均可观察到的现象是 固体溶解,溶液由无色变成黄色 。
a
化
学
节约药品
固体溶
解,溶液由无色变成黄色
图10-1-5
产生气泡,溶液由无
色变成浅绿色
Fe+
图10-1-5
(5)实验C~F中无明显现象的是实验 C (填序号,下同),有蓝色溶液产生的是实验 F 。
CaCO3+
澄清石灰水
C
F
图10-1-5
思路点拨 (1)酸由H+和酸根离子构成,所以酸中一定含有H+。(2)注意铁和酸反应生成的是亚铁离子(溶液呈浅绿色),氧化铁和酸反应生成的是铁离子(溶液呈黄色)。
1. 柠檬酸(C6H8O7)是一种酸性较强的有机酸,在水溶液中可以解离出H+,从而呈现酸性,主要用于制造香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的( A )
A. CO2 B. Fe2O3 C. Mg D. Fe
A
2. 除去铜粉中混有的少量氧化铜,方法正确的是( D )
A. 在空气中加热
B. 加入足量的水,充分搅拌后过滤
C. 加入足量的铁粉,反应后过滤
D. 加入足量的盐酸,充分反应后过滤
D
3. 下列去污渍的方法,不正确的是( B )
A. 用白醋除铁锈
B. 用稀硫酸清洗试管内壁上的铜
C. 用汽油清洗手上的油漆
D. 用稀盐酸清洗长期盛放石灰水的试剂瓶
B
4. 图10-1-6是某实验中各物质间的转化关系,据图回答下列问题。
图10-1-6
(1)写出物质C、E的化学式:C H2 ,E Cu 。
H2
Cu
(3)溶液D中一定含有的溶质是 FeSO4(填化学式)。
CuO+
FeSO4
FeSO4+H2↑
图10-1-6
5. 某兴趣小组同学设计了如图10-1-7所示的装置,装置气密性良好,实验时将装置A中分液漏斗的活塞打开,使稀硫酸滴入瓶内和锌粒接触,在装置B中尖嘴导管口观察到有“喷泉”产生。
图10-1-7
Zn+H2SO4
(2)装置B中尖嘴导管口产生“喷泉”的原因是 装置A中物质反应生成氢气,氢气进入装置B使装置内压强增大,把水从尖嘴导管口压出 。
(3)若要产生相同的实验现象,装置A中的分液漏斗 不能 (填“能”或“不能”)改为长颈漏斗。
装置
A中物质反应生成氢气,氢气进入装置B使装置内压强增
大,把水从尖嘴导管口压出
不能
图10-1-7
谢 谢!
第十单元 酸 和 碱
课题1 常见的酸和碱
课时2 酸的化学性质
目录
01
课程要求
02
03
04
知识点精讲
课堂检测
课前预习
1. 以盐酸和硫酸为例,通过实验探究认识酸的主要化学性质和用途,并能用化学方程式表示。
2. 能利用酸的性质,分析、解释一些简单的化学现象和事实。
有气泡产生,溶液由
无色变为浅绿色
H2↑+FeSO4
大理石和稀盐酸
+CO2↑
1. 酸与指示剂作用,酸使紫色石蕊溶液变 红 , 不能 使无色酚酞溶液变色。
2. 酸与活泼金属反应生成 金属化合物(盐) 和 氢气 (基本反应类型为 置换反应 ,酸主要是指 稀盐酸 和 稀硫酸 ,金属主要是指在金属活动性顺序表中排在 氢 前的金属,K、Ca、Na除外)。
红
不
能
金属化合物(盐)
氢
气
置换反应
稀
盐酸
稀硫酸
氢
知识点 酸的化学性质
金 属 与稀盐酸反应的化学方程式 与稀硫酸反应的化学方程式
镁
锌
MgCl2+H2↑
MgSO4+H2↑
ZnCl2+H2↑
ZnSO4+H2↑
FeCl2+H2↑
FeSO4+H2↑
金 属 与稀盐酸反应的化学方程式 与稀硫酸反应的化学方程式
铁
续表
3. 酸与金属氧化物反应生成 金属化合物(盐) 和 水 。
金属氧化物 化学方程式 现 象
铁锈+稀盐酸 红棕色固体逐渐消失,溶液由无色变成黄色
铁锈+稀硫酸
金属化合物(盐)
水
2FeCl3+3H2O
红棕色固体
逐渐消失,溶
液由无色变成
黄色
Fe2(SO4)3+3H2O
金属氧化物 化学方程式 现 象
氧化铜+稀盐酸 红棕色固体逐渐消失,溶液由无色变成
氧化铜+稀硫酸
CuCl2+H2O
黑色粉末逐渐
溶解,溶液由
无色变为蓝色
CuSO4+H2O
【点拨】生锈的铁制品不能长时间浸泡在酸中,酸和表面的铁锈反应后还会继续和铁反应。
续表
课堂练习
1. 我国获批使用的新冠疫苗中,最早期的灭活疫苗是在石炭酸(化学式为C6H6O,具有酸的性质)防腐的条件下制成的。下列关于石炭酸的说法正确的是( D )
A. 紫色石蕊溶液遇石炭酸变蓝色
B. 石炭酸的水溶液中不一定含H+
C. 石炭酸属于氧化物
D. 石炭酸能与活泼金属反应生成氢气
D
2. 利用图10-1-5所示装置对酸的化学性质探究。
图10-1-5
(1)实验A中,在点滴板的a、b穴中滴入酸溶液后,溶液变红的是 a (填“a”或“b”)穴,发生了 化学 (填“物理”或“化学”)变化;使用点滴板的优点之一是 节约药品 。
(2)实验B中,①②中均可观察到的现象是 固体溶解,溶液由无色变成黄色 。
a
化
学
节约药品
固体溶
解,溶液由无色变成黄色
图10-1-5
产生气泡,溶液由无
色变成浅绿色
Fe+
图10-1-5
(5)实验C~F中无明显现象的是实验 C (填序号,下同),有蓝色溶液产生的是实验 F 。
CaCO3+
澄清石灰水
C
F
图10-1-5
思路点拨 (1)酸由H+和酸根离子构成,所以酸中一定含有H+。(2)注意铁和酸反应生成的是亚铁离子(溶液呈浅绿色),氧化铁和酸反应生成的是铁离子(溶液呈黄色)。
1. 柠檬酸(C6H8O7)是一种酸性较强的有机酸,在水溶液中可以解离出H+,从而呈现酸性,主要用于制造香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的( A )
A. CO2 B. Fe2O3 C. Mg D. Fe
A
2. 除去铜粉中混有的少量氧化铜,方法正确的是( D )
A. 在空气中加热
B. 加入足量的水,充分搅拌后过滤
C. 加入足量的铁粉,反应后过滤
D. 加入足量的盐酸,充分反应后过滤
D
3. 下列去污渍的方法,不正确的是( B )
A. 用白醋除铁锈
B. 用稀硫酸清洗试管内壁上的铜
C. 用汽油清洗手上的油漆
D. 用稀盐酸清洗长期盛放石灰水的试剂瓶
B
4. 图10-1-6是某实验中各物质间的转化关系,据图回答下列问题。
图10-1-6
(1)写出物质C、E的化学式:C H2 ,E Cu 。
H2
Cu
(3)溶液D中一定含有的溶质是 FeSO4(填化学式)。
CuO+
FeSO4
FeSO4+H2↑
图10-1-6
5. 某兴趣小组同学设计了如图10-1-7所示的装置,装置气密性良好,实验时将装置A中分液漏斗的活塞打开,使稀硫酸滴入瓶内和锌粒接触,在装置B中尖嘴导管口观察到有“喷泉”产生。
图10-1-7
Zn+H2SO4
(2)装置B中尖嘴导管口产生“喷泉”的原因是 装置A中物质反应生成氢气,氢气进入装置B使装置内压强增大,把水从尖嘴导管口压出 。
(3)若要产生相同的实验现象,装置A中的分液漏斗 不能 (填“能”或“不能”)改为长颈漏斗。
装置
A中物质反应生成氢气,氢气进入装置B使装置内压强增
大,把水从尖嘴导管口压出
不能
图10-1-7
谢 谢!
同课章节目录
