化学人教版(2019)必修第一册3.2.2金属材料和金属与酸反应(共25张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.2.2金属材料和金属与酸反应(共25张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-27 20:27:27 | ||
图片预览







文档简介
(共25张PPT)
金属材料、金属与酸反应
框架导图
金属材料
金属的化学性质
金属与酸反应的图像
金属锈蚀条件和防锈方法
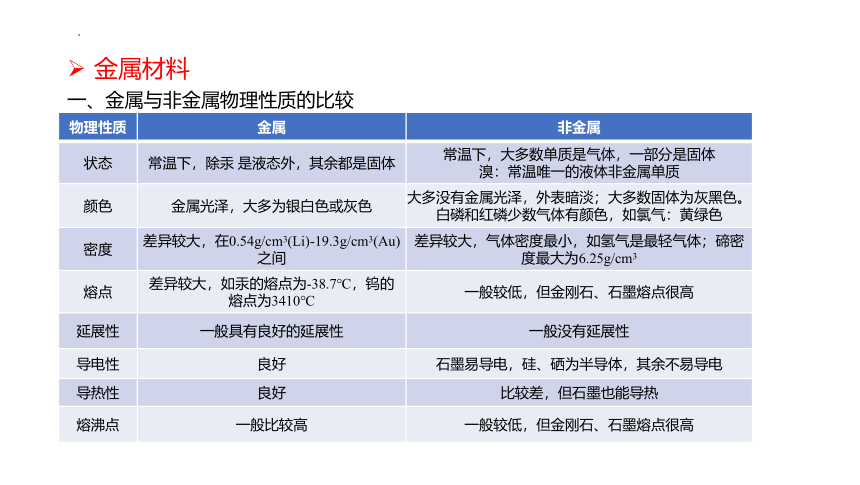
物理性质 金属 非金属
状态 常温下,除汞 是液态外,其余都是固体 常温下,大多数单质是气体,一部分是固体
溴:常温唯一的液体非金属单质
颜色 金属光泽,大多为银白色或灰色 大多没有金属光泽,外表暗淡;大多数固体为灰黑色。
白磷和红磷少数气体有颜色,如氯气:黄绿色
密度 差异较大,在0.54g/cm3(Li)-19.3g/cm3(Au)之间 差异较大,气体密度最小,如氢气是最轻气体;碲密度最大为6.25g/cm3
熔点 差异较大,如汞的熔点为-38.7℃,钨的熔点为3410℃ 一般较低,但金刚石、石墨熔点很高
延展性 一般具有良好的延展性 一般没有延展性
导电性 良好 石墨易导电,硅、硒为半导体,其余不易导电
导热性 良好 比较差,但石墨也能导热
熔沸点 一般比较高 一般较低,但金刚石、石墨熔点很高
金属材料
一、金属与非金属物理性质的比较
二、金属之最
地壳中含量最多的金属元素
人体中含量最多的金属元素
世界年产量最多的金属元素
导电导热性最好的金属元素
熔点最高金属元素
硬度最大金属元素
密度最大金属元素
熔点最低金属元素
Al
O>Si>Al>Fe>Ca
Ca
Fe
Fe>Al>Cu
Ag
Cr
W
Os(锇)
Hg
2、合金:一种金属跟其他一种或几种金属(或非金属)一起熔合而成的具有金属特性的物质
3、合金特点:
①合金是混合物。
②合金中至少含有一种金属。
③合金中金属或非金属均以单质形式存在。
④合金与纯金属性能比较
硬度大
熔点偏低
抗腐蚀性能较优
三、常见的金属材料
1、金属材料包括金属单质和合金。
<例题1>
<巩固1>
C
A
1、有些金属能在氧气中燃烧
2、有些金属不能燃烧,但能生成氧化物
3Fe+2O2 = Fe3O4
点燃
2Cu+O2 = 2CuO
一、金属与氧气反应
2Mg+O2 = 2MgO
金属的化学性质
①镁在氧气中燃烧
点燃
现象:银白色的镁带很快燃烧起来,发出耀眼的白光,放出大量的热,生成一种白色固体。
②铁在氧气中燃烧
现象:铁剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体。
现象:铜丝加热后表面会由紫红色变成黑色。
3、金属铁在潮湿的空气中被氧化成铁锈(主要成分是Fe2O3),铁锈是一种混合物。
4、金属铝的表面易生成一层致密的氧化铝(Al2O3)保护膜,能阻止铝继续被空气氧化,因此铝具有很好的抗腐蚀性能。
铝制品不能用钢刷擦洗,还不能盛放酸性或碱性物质,原因是:
①Al2O3+6HCl=2AlCl3+3H2O
②Al2O3+2NaOH=2NaAlO2+H2O
二、金属与酸反应
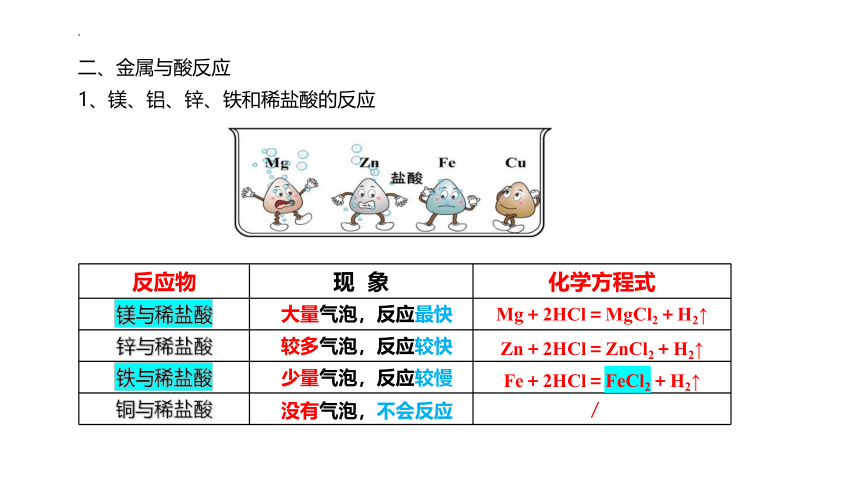
1、镁、铝、锌、铁和稀盐酸的反应
反应物 现 象 化学方程式
镁与稀盐酸
锌与稀盐酸
铁与稀盐酸
铜与稀盐酸
大量气泡,反应最快
较多气泡,反应较快
少量气泡,反应较慢
没有气泡,不会反应
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
/
2、实验室制备氢气:
Zn+H2SO4=H2↑+ZnSO4
(3)酸不用浓硫酸、硝酸的理由:浓硫酸和浓硝酸具有强氧化性,和锌反应不产生氢气
(1)金属选用锌的理由:反应速率适中,有利于氢气收集
(2)酸不选盐酸的理由:盐酸易挥发,收集到的氢气不纯
H2(HCl、H2O)
①氢氧化钠溶液;②浓硫酸
3、置换反应:一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。
形式:A+BC→B+AC(或A+BC →BA+C)
<例题2>
<巩固2>
C
A
金属与酸反应的图像
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
由强逐渐减弱
一、金属活动顺序表
等质量镁、铝、锌、铁与足量稀硫酸反应
金属与酸的反应速率
☆金属活动顺序:Mg>Al>Zn>Fe
m(氢气)=×m(金属质量)
制
☆氢气产量:Al>Mg>Fe>Zn
二、读取图像信息的一般步骤:
①看横轴坐标
②看斜率意义
③看最高点(产生氢气最大量)。
时间、酸的质量、金属质量
时间——金属活动性
酸的质量——等质量酸产生的氢气量
金属质量——制氢率
酸反应完——等量氢气
金属反应完——制氢率决定
Mg
Al
Zn
Fe
<例题3>
<巩固3>
C
C
<例题4>
<巩固4>
D
A
三、图像辨识解析
若等质量的镁、铁和等质量等浓度的稀盐酸充分反应,如下图所示,
可得出的信息有:
a.M为镁,N为铁
b.镁一定过量,铁可能反应完
c.酸一定反应完
d.完全反应后所得溶液的质量:M<例题5>
<巩固5>
D
B
反应中天平倾斜,看反应速率(考虑金属活动性)
偏向金属活动性弱的金属
四、金属与酸反应的天平问题
反应结束天平倾斜,看产生氢气的质量大小(考虑制氢率)
偏向产生氢气少的金属
考虑1:天平指针的最先偏转方向
考虑2:天平指针的最终偏转方向
<例题6>
<巩固6>
C
C
金属锈蚀的条件和防锈方法
一、铜生锈的条件
二、铁生锈的条件
三、防止铁制品生锈的措施
铜与O2、H2O、CO2接触。铜绿的主要成分:Cu2(OH)2CO3
2Cu+O2+H2O+CO2= Cu2(OH)2CO3
Cu2(OH)2CO3 = 2CuO+H2O+CO2 ↑
既与周围环境里水、空气等物质的作用有关,也与金属内部的结构有关。
铁锈的主要成分:Fe2O3·xH2O,铁锈是混合物。
1、保持铁制品表面的清洁、干燥。
2、表面涂保护膜:如涂油、刷漆、电镀、烤蓝等。
3、改变内部结构法:制成合金钢,如不锈钢等。
<例题7>
<巩固7>
C
D
<巩固1>
<巩固2>
课后巩固
<巩固3>
<巩固4>
<巩固5>
<巩固6>
谢谢
金属材料、金属与酸反应
框架导图
金属材料
金属的化学性质
金属与酸反应的图像
金属锈蚀条件和防锈方法
物理性质 金属 非金属
状态 常温下,除汞 是液态外,其余都是固体 常温下,大多数单质是气体,一部分是固体
溴:常温唯一的液体非金属单质
颜色 金属光泽,大多为银白色或灰色 大多没有金属光泽,外表暗淡;大多数固体为灰黑色。
白磷和红磷少数气体有颜色,如氯气:黄绿色
密度 差异较大,在0.54g/cm3(Li)-19.3g/cm3(Au)之间 差异较大,气体密度最小,如氢气是最轻气体;碲密度最大为6.25g/cm3
熔点 差异较大,如汞的熔点为-38.7℃,钨的熔点为3410℃ 一般较低,但金刚石、石墨熔点很高
延展性 一般具有良好的延展性 一般没有延展性
导电性 良好 石墨易导电,硅、硒为半导体,其余不易导电
导热性 良好 比较差,但石墨也能导热
熔沸点 一般比较高 一般较低,但金刚石、石墨熔点很高
金属材料
一、金属与非金属物理性质的比较
二、金属之最
地壳中含量最多的金属元素
人体中含量最多的金属元素
世界年产量最多的金属元素
导电导热性最好的金属元素
熔点最高金属元素
硬度最大金属元素
密度最大金属元素
熔点最低金属元素
Al
O>Si>Al>Fe>Ca
Ca
Fe
Fe>Al>Cu
Ag
Cr
W
Os(锇)
Hg
2、合金:一种金属跟其他一种或几种金属(或非金属)一起熔合而成的具有金属特性的物质
3、合金特点:
①合金是混合物。
②合金中至少含有一种金属。
③合金中金属或非金属均以单质形式存在。
④合金与纯金属性能比较
硬度大
熔点偏低
抗腐蚀性能较优
三、常见的金属材料
1、金属材料包括金属单质和合金。
<例题1>
<巩固1>
C
A
1、有些金属能在氧气中燃烧
2、有些金属不能燃烧,但能生成氧化物
3Fe+2O2 = Fe3O4
点燃
2Cu+O2 = 2CuO
一、金属与氧气反应
2Mg+O2 = 2MgO
金属的化学性质
①镁在氧气中燃烧
点燃
现象:银白色的镁带很快燃烧起来,发出耀眼的白光,放出大量的热,生成一种白色固体。
②铁在氧气中燃烧
现象:铁剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体。
现象:铜丝加热后表面会由紫红色变成黑色。
3、金属铁在潮湿的空气中被氧化成铁锈(主要成分是Fe2O3),铁锈是一种混合物。
4、金属铝的表面易生成一层致密的氧化铝(Al2O3)保护膜,能阻止铝继续被空气氧化,因此铝具有很好的抗腐蚀性能。
铝制品不能用钢刷擦洗,还不能盛放酸性或碱性物质,原因是:
①Al2O3+6HCl=2AlCl3+3H2O
②Al2O3+2NaOH=2NaAlO2+H2O
二、金属与酸反应
1、镁、铝、锌、铁和稀盐酸的反应
反应物 现 象 化学方程式
镁与稀盐酸
锌与稀盐酸
铁与稀盐酸
铜与稀盐酸
大量气泡,反应最快
较多气泡,反应较快
少量气泡,反应较慢
没有气泡,不会反应
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
/
2、实验室制备氢气:
Zn+H2SO4=H2↑+ZnSO4
(3)酸不用浓硫酸、硝酸的理由:浓硫酸和浓硝酸具有强氧化性,和锌反应不产生氢气
(1)金属选用锌的理由:反应速率适中,有利于氢气收集
(2)酸不选盐酸的理由:盐酸易挥发,收集到的氢气不纯
H2(HCl、H2O)
①氢氧化钠溶液;②浓硫酸
3、置换反应:一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。
形式:A+BC→B+AC(或A+BC →BA+C)
<例题2>
<巩固2>
C
A
金属与酸反应的图像
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
由强逐渐减弱
一、金属活动顺序表
等质量镁、铝、锌、铁与足量稀硫酸反应
金属与酸的反应速率
☆金属活动顺序:Mg>Al>Zn>Fe
m(氢气)=×m(金属质量)
制
☆氢气产量:Al>Mg>Fe>Zn
二、读取图像信息的一般步骤:
①看横轴坐标
②看斜率意义
③看最高点(产生氢气最大量)。
时间、酸的质量、金属质量
时间——金属活动性
酸的质量——等质量酸产生的氢气量
金属质量——制氢率
酸反应完——等量氢气
金属反应完——制氢率决定
Mg
Al
Zn
Fe
<例题3>
<巩固3>
C
C
<例题4>
<巩固4>
D
A
三、图像辨识解析
若等质量的镁、铁和等质量等浓度的稀盐酸充分反应,如下图所示,
可得出的信息有:
a.M为镁,N为铁
b.镁一定过量,铁可能反应完
c.酸一定反应完
d.完全反应后所得溶液的质量:M
<巩固5>
D
B
反应中天平倾斜,看反应速率(考虑金属活动性)
偏向金属活动性弱的金属
四、金属与酸反应的天平问题
反应结束天平倾斜,看产生氢气的质量大小(考虑制氢率)
偏向产生氢气少的金属
考虑1:天平指针的最先偏转方向
考虑2:天平指针的最终偏转方向
<例题6>
<巩固6>
C
C
金属锈蚀的条件和防锈方法
一、铜生锈的条件
二、铁生锈的条件
三、防止铁制品生锈的措施
铜与O2、H2O、CO2接触。铜绿的主要成分:Cu2(OH)2CO3
2Cu+O2+H2O+CO2= Cu2(OH)2CO3
Cu2(OH)2CO3 = 2CuO+H2O+CO2 ↑
既与周围环境里水、空气等物质的作用有关,也与金属内部的结构有关。
铁锈的主要成分:Fe2O3·xH2O,铁锈是混合物。
1、保持铁制品表面的清洁、干燥。
2、表面涂保护膜:如涂油、刷漆、电镀、烤蓝等。
3、改变内部结构法:制成合金钢,如不锈钢等。
<例题7>
<巩固7>
C
D
<巩固1>
<巩固2>
课后巩固
<巩固3>
<巩固4>
<巩固5>
<巩固6>
谢谢
