2.1钠的性质与制备 课件(共41张PPT)高中化学苏教版必修第一册专题三
文档属性
| 名称 | 2.1钠的性质与制备 课件(共41张PPT)高中化学苏教版必修第一册专题三 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-27 20:42:18 | ||
图片预览








文档简介
(共41张PPT)
第二单元 金属钠及钠的化合物
第1课时 钠的性质与制备
课标定位素养阐释
1.能够掌握钠单质的生产原理及钠的保存和用途。
2.能够从微观视角理解钠是一种很活泼的金属,通过实验探究掌握钠的化学性质。
3.能够从模型认知角度理解Na2O、Na2O2的性质。
钠的性质与制备
1.钠的存在:在自然界中钠元素都以化合态存在,如氯化钠、碳酸钠、硫酸钠等。
2.钠的物理性质。
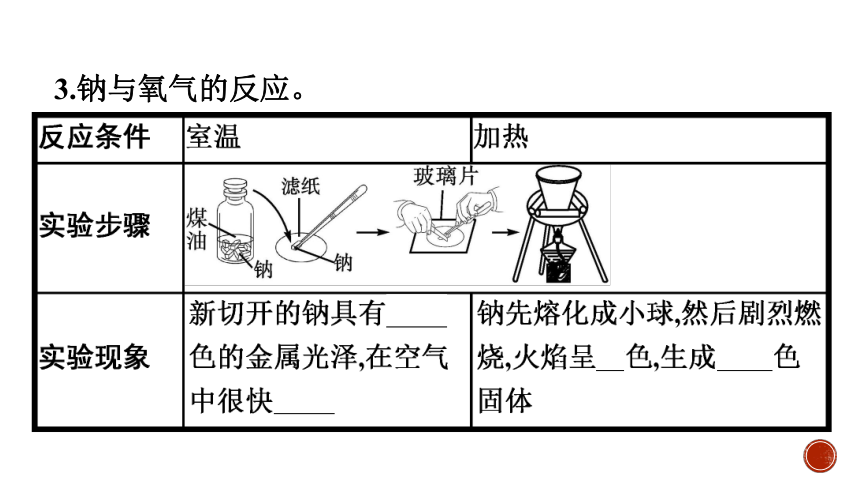
3.钠与氧气的反应。
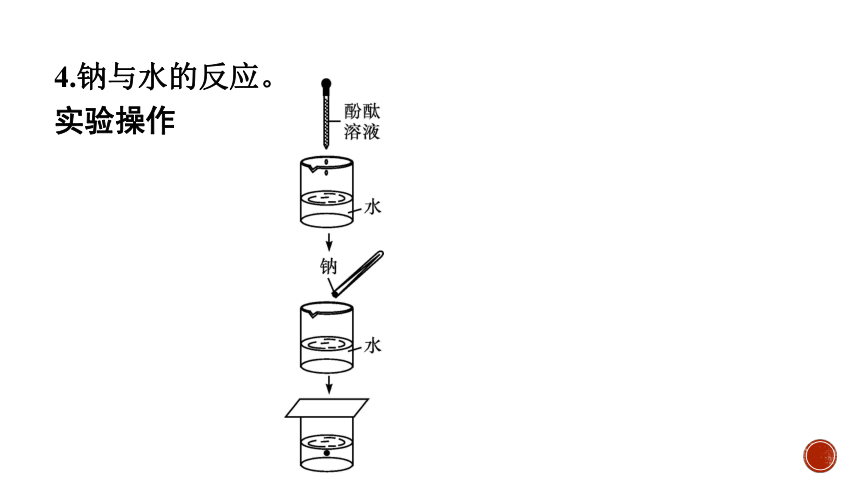
4.钠与水的反应。
实验操作
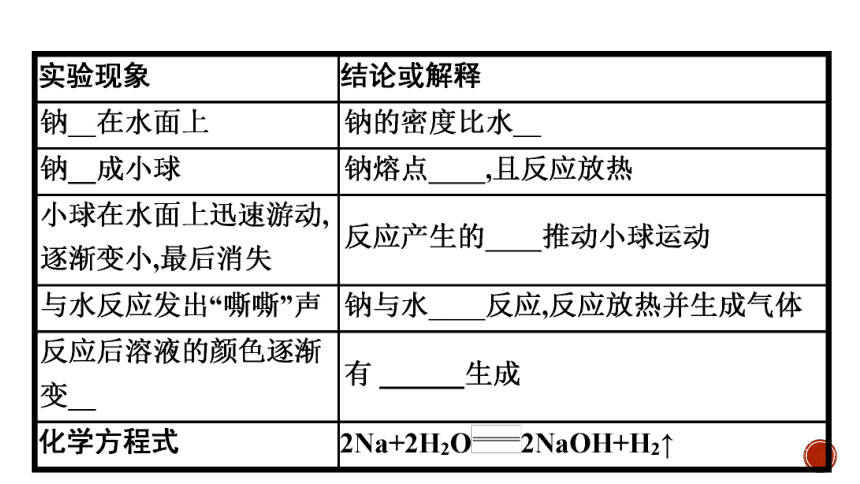
(1)钠原子最外电子层上只有一个电子,反应容易失去,钠表现还原性且性质活泼。
(2)钠与水(滴有酚酞溶液)反应的现象概括为“浮熔游响红”。
5.钠的制备与保存。
(1)制备:电解熔融氯化钠,化学方程式为2NaCl 2Na+Cl2↑。
(2)保存:钠易与空气中O2、H2O反应,通常将钠保存在煤油中。
6.钠的用途。
(1)制取Na2O2等化合物。
(2)钠钾合金(液态)可用于快中子反应堆的热交换剂。
(3)作强还原剂,将钛、锆、铌等稀有金属从它们的氯化物中置换出来,如4Na+TiCl4 Ti+4NaCl。
(4)用作电光源,制作高压钠灯。
7.氧化钠。
(1)物理性质:Na2O是
一种白色粉末状固体。
(2)化学性质:
写出有关反应的化学方程式:
①Na2O+H2O══2NaOH;
②Na2O+2HCl══2NaCl+H2O;
③Na2O+CO2══Na2CO3。
8.过氧化钠。
(1)物理性质:淡黄色固体。
(2)化学性质。
①与水的反应:2Na2O2+2H2O══4NaOH+O2↑
②与二氧化碳的反应:2Na2O2+2CO2══2Na2CO3+O2。
(3)用途。
①供氧剂:可用于呼吸面具或潜水艇中作为氧气的来源。
②强氧化剂。
③漂白剂:用于漂白某些物质。
【自主思考1】 实验室如何保存金属钠 能否用手直接取用金属钠 取用金属钠时剩余的金属钠如何处理
提示:少量的金属钠保存在煤油中。金属钠具有腐蚀性,不能用手直接接触金属钠。剩余的金属钠应放回原试剂瓶中。
【自主思考2】 金属钠长期露置于空气中最终完全转变为白色粉末,试分析此过程中有哪些现象和反应。
发生的主要变化的化学方程式为
①4Na+O2══2Na2O;
②Na2O+H2O══2NaOH;
④2NaOH+CO2══Na2CO3+H2O,
Na2CO3+10H2O══Na2CO3·10H2O;
⑤Na2CO3·10H2O══Na2CO3+10H2O。
【效果自测】
1.金属钠是一种活泼金属,除了具有金属的一般性质外,还具有自己的特性。下列关于钠的叙述中正确的是( )。
A.钠是银白色金属,熔点低,硬度大
B.钠放置在空气中,会迅速被氧化而生成淡黄色的Na2O
C.在氧气中加热时,金属钠剧烈燃烧,发出黄色火焰
D.金属钠着火时,可用泡沫灭火器或干燥的沙土灭火
答案:C
解析:A项,钠可用小刀切割,硬度小;B项,钠放置在空气中,被缓慢氧化生成白色的Na2O;D项,钠着火时生成Na2O2,泡沫灭火器释放的泡沫中有CO2、H2O,CO2会与Na2O2反应生成O2,H2O会与Na反应生成H2,故金属钠着火时,不能用泡沫灭火器灭火。
2.取一块金属钠,放在燃烧匙里加热,下列对实验现象的描述正确的是( )。
①金属先熔化 ②在空气中燃烧,生成氧化钠 ③燃烧后得白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成淡黄色固体
A.②⑤ B.①②③
C.①④⑤ D.④⑤
答案:C
解析:钠燃烧时,先受热熔化成闪亮的小球,然后燃烧,燃烧时火焰为黄色,燃烧后生成淡黄色的过氧化钠固体。
问题引领
1.将一块钠放入少量的盐酸中,发生哪些反应 写出反应的化学方程式。
提示:钠先与盐酸反应,过量的钠再与水反应。反应的化学方程式分别为2Na+2HCl══2NaCl+H2↑, 2Na+2H2O══2NaOH+H2↑。
探究任务1 钠与酸、碱、盐溶液的反应
2.把一小块钠放入CuSO4溶液中,可观察到哪些现象 写出反应的化学方程式。
提示:观察到钠浮在液面上,熔化成一闪亮的小球到处游动,有蓝色沉淀生成。反应的化学方程式为2Na+2H2O══
2NaOH+H2↑,CuSO4+2NaOH══Cu(OH)2↓+Na2SO4。合并后可得2Na+2H2O+CuSO4══Na2SO4+Cu(OH)2↓+H2↑。
归纳提升
钠与酸、碱、盐溶液的反应
1.钠与酸溶液的反应。
(1)钠与酸溶液反应时先与酸反应生成H2。
(2)如果钠过量,钠把酸消耗尽之后,再与水反应。
2.钠与碱溶液的反应,实质就是钠与水的反应。
3.钠与盐溶液反应时,首先与水反应生成NaOH,然后NaOH与盐发生复分解反应(若氢氧化钠不与盐反应,则只有钠与水的反应)。
例如:
(1)Na与Fe2(SO4)3溶液的反应
2Na+2H2O══2NaOH+H2↑,
6NaOH+Fe2(SO4)3══2Fe(OH)3↓+3Na2SO4。
(2)Na与K2SO4溶液的反应
2Na+2H2O══2NaOH+H2↑(仅此一步反应)。
典型例题
【例题1】 金属钠分别与下列溶液反应时,既有气体放出又有沉淀产生的是( )。
A.BaCl2溶液 B.K2SO4溶液
C.FeCl3溶液 D.NaNO3溶液
答案:C
解析:钠与盐溶液中的水反应生成NaOH和H2,故将钠放入水溶液中均有气体产生。A、B、D中均无沉淀生成,C中FeCl3与NaOH反应生成Fe(OH)3沉淀。
素养提升 钠与盐溶液的模型认知
【变式训练1】 将金属钠分别放入下列物质的水溶液中,生成白色沉淀的是( )。
A.MgCl2 B.NaCl C.CuCl2 D.HCl
答案:A
解析:金属钠与水反应生成氢氧化钠和氢气,再分析氢氧化钠能否与盐发生复分解反应。A项,氢氧化钠与氯化镁反应,生成氢氧化镁白色沉淀,正确;B项,氢氧化钠与氯化钠不反应,错误;C项,氢氧化钠与氯化铜反应产生蓝色沉淀,错误;D项,无沉淀产生,错误。
问题引领
1.Na2O2属于碱性氧化物吗 为什么
提示:不是碱性氧化物。原因是Na2O2与水反应时,除生成氢氧化钠外,还生成O2,因此,Na2O2不是碱性氧化物,而属于过氧化物。
探究任务2 Na2O2与CO2 、 H2O反应的三大关系
2.2.24 L的CO2和水蒸气的混合气体与足量的Na2O2反应,能得到相同条件下的气体多少升
提示:根据CO2与Na2O2、H2O与Na2O2反应的化学方程式可知,相同条件下,2.24 L CO2和水蒸气的混合气体与足量Na2O2反应生成1.12 L O2。
3.7.8 g Na2O2与足量水反应时转移电子的物质的量是多少
提示:由Na2O2与水反应的化学方程式可知,0.1 mol Na2O2与水反应转移0.1 mol电子。
归纳提升
Na2O2与CO2、H2O反应的三大关系:
反应的化学方程式为
2Na2O2+2CO2══2Na2CO3+O2①
2Na2O2+2H2O══4NaOH+O2↑②
1.物质的量关系。
不论是CO2还是H2O,通过足量的Na2O2时,放出O2的物质的量与CO2或H2O的物质的量之比均为1∶2。
2.电子转移关系。
在Na2O2与CO2或H2O的反应中,Na2O2既是氧化剂又是还原剂,每生成1 mol O2都转移2 mol电子。
3.固体质量关系。
(1)2Na2O2+2CO2══2Na2CO3+O2 Δm(固体)
2×78 g 2 mol 2×106 g 56 g
(2 mol CO的质量)
即发生反应①时,固体增加的质量等于与CO2等物质的量的CO的质量。
(2)2Na2O2+2H2O══4NaOH+O2↑ Δm(固体)
2×78 g 2 mol 4×40 g 4 g
(2 mol H2的质量)
即发生反应②时,固体增加的质量等于与H2O等物质的量的H2的质量。
(1)Na2O2中氧元素的化合价是-1价,Na2O中氧元素的化合价是-2价,Na2O2与水、CO2反应中,Na2O2既是氧化剂又是还原剂。
(2)Na2O2中阴、阳离子个数比是1∶2而不是1∶1。
典型例题
【例题2】 下列关于Na2O、Na2O2的比较,正确的是( )。
A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物
B.Na2O2、Na2O都是可溶于水(或能与水反应)的白色固体
C.Na2O2与CO2的反应中,Na2O2既是氧化剂,又是还原剂
D.Na2O2与水反应时,1 mol Na2O2转移2 mol电子
答案:C
解析:A项,Na2O2与水反应除了生成NaOH外,还有O2生成,所以Na2O2只是Na的氧化物,但不属于碱性氧化物;B项,Na2O2是淡黄色固体;C项,Na2O2与CO2的反应中,Na2O2既是氧化剂,又是还原剂;D项,Na2O2与H2O反应时,Na2O2中-1价的O变成了-2价的O和0价的O,故1 mol Na2O2转移1 mol电子。
【例题3】 CO和H2的混合气体21.2 g,与足量O2反应后,通过足量Na2O2,固体质量增加( )。
A.21.2 g B.14 g
C.6.78 g D.不能确定
答案:A
2Na2O2+2H2O══4NaOH+O2↑,2Na2O2+2CO2══2Na2CO3+O2。
将上述化学方程式合并可得:Na2O2+H2══2NaOH, Na2O2+CO══Na2CO3即反应结果相当于CO、H2恰好被Na2O2吸收,固体增加的质量就是CO和H2的总质量。
【变式训练2】 设NA表示阿伏加德罗常数的值,下列说法正确的是( )。
A.1 mol Na2O2固体中含离子总数为4NA
B.二氧化碳通过Na2O2粉末,反应后固体物质质量增大
C.Na2O2溶于水产生O2:Na2O2+H2O══2NaOH+O2↑
D.标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5NA
答案:B
解析:1 mol Na2O2固体中含离子总数为3NA,A项错误;C项中氧原子不守恒,错误;标准状况下5.6 L(0.25 mol)CO2与足量Na2O2反应转移0.25NA个电子,D项错误。
【变式训练3】 (双选)某实验小组通过下图所示实验,探究Na2O2与水的反应,下列说法中正确的是( )。
A.②中大量气泡中气
体的主要成分是氢气
B.③中溶液变红,说明
有碱性物质生成
C.④中现象可能是由于溶液中含有强氧化性物质造成的
D.⑤中MnO2的主要作用是降低了水中氧气的溶解度
答案:BC
解析:过氧化钠与水反应生成NaOH和氧气,则②中大量气泡中气体的主要成分是氧气,A错误;酚酞变红色说明溶液显碱性,③中溶液变红,说明有碱性物质生成,B正确;④中红色褪去,应该是由于溶液中的强氧化性物质氧化酚酞导致酚酞变质造成的,C正确;⑤中加入MnO2产生较多气泡,说明溶液中存在H2O2,MnO2的主要作用是作催化剂,D错误。
第二单元 金属钠及钠的化合物
第1课时 钠的性质与制备
课标定位素养阐释
1.能够掌握钠单质的生产原理及钠的保存和用途。
2.能够从微观视角理解钠是一种很活泼的金属,通过实验探究掌握钠的化学性质。
3.能够从模型认知角度理解Na2O、Na2O2的性质。
钠的性质与制备
1.钠的存在:在自然界中钠元素都以化合态存在,如氯化钠、碳酸钠、硫酸钠等。
2.钠的物理性质。
3.钠与氧气的反应。
4.钠与水的反应。
实验操作
(1)钠原子最外电子层上只有一个电子,反应容易失去,钠表现还原性且性质活泼。
(2)钠与水(滴有酚酞溶液)反应的现象概括为“浮熔游响红”。
5.钠的制备与保存。
(1)制备:电解熔融氯化钠,化学方程式为2NaCl 2Na+Cl2↑。
(2)保存:钠易与空气中O2、H2O反应,通常将钠保存在煤油中。
6.钠的用途。
(1)制取Na2O2等化合物。
(2)钠钾合金(液态)可用于快中子反应堆的热交换剂。
(3)作强还原剂,将钛、锆、铌等稀有金属从它们的氯化物中置换出来,如4Na+TiCl4 Ti+4NaCl。
(4)用作电光源,制作高压钠灯。
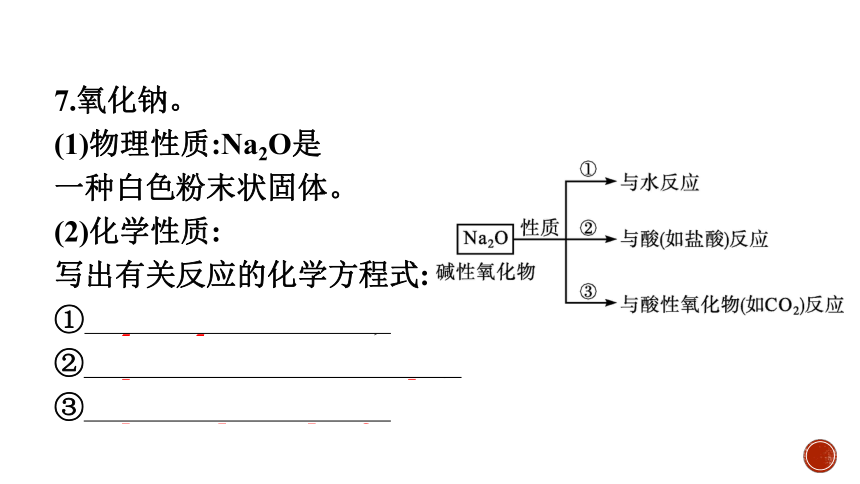
7.氧化钠。
(1)物理性质:Na2O是
一种白色粉末状固体。
(2)化学性质:
写出有关反应的化学方程式:
①Na2O+H2O══2NaOH;
②Na2O+2HCl══2NaCl+H2O;
③Na2O+CO2══Na2CO3。
8.过氧化钠。
(1)物理性质:淡黄色固体。
(2)化学性质。
①与水的反应:2Na2O2+2H2O══4NaOH+O2↑
②与二氧化碳的反应:2Na2O2+2CO2══2Na2CO3+O2。
(3)用途。
①供氧剂:可用于呼吸面具或潜水艇中作为氧气的来源。
②强氧化剂。
③漂白剂:用于漂白某些物质。
【自主思考1】 实验室如何保存金属钠 能否用手直接取用金属钠 取用金属钠时剩余的金属钠如何处理
提示:少量的金属钠保存在煤油中。金属钠具有腐蚀性,不能用手直接接触金属钠。剩余的金属钠应放回原试剂瓶中。
【自主思考2】 金属钠长期露置于空气中最终完全转变为白色粉末,试分析此过程中有哪些现象和反应。
发生的主要变化的化学方程式为
①4Na+O2══2Na2O;
②Na2O+H2O══2NaOH;
④2NaOH+CO2══Na2CO3+H2O,
Na2CO3+10H2O══Na2CO3·10H2O;
⑤Na2CO3·10H2O══Na2CO3+10H2O。
【效果自测】
1.金属钠是一种活泼金属,除了具有金属的一般性质外,还具有自己的特性。下列关于钠的叙述中正确的是( )。
A.钠是银白色金属,熔点低,硬度大
B.钠放置在空气中,会迅速被氧化而生成淡黄色的Na2O
C.在氧气中加热时,金属钠剧烈燃烧,发出黄色火焰
D.金属钠着火时,可用泡沫灭火器或干燥的沙土灭火
答案:C
解析:A项,钠可用小刀切割,硬度小;B项,钠放置在空气中,被缓慢氧化生成白色的Na2O;D项,钠着火时生成Na2O2,泡沫灭火器释放的泡沫中有CO2、H2O,CO2会与Na2O2反应生成O2,H2O会与Na反应生成H2,故金属钠着火时,不能用泡沫灭火器灭火。
2.取一块金属钠,放在燃烧匙里加热,下列对实验现象的描述正确的是( )。
①金属先熔化 ②在空气中燃烧,生成氧化钠 ③燃烧后得白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成淡黄色固体
A.②⑤ B.①②③
C.①④⑤ D.④⑤
答案:C
解析:钠燃烧时,先受热熔化成闪亮的小球,然后燃烧,燃烧时火焰为黄色,燃烧后生成淡黄色的过氧化钠固体。
问题引领
1.将一块钠放入少量的盐酸中,发生哪些反应 写出反应的化学方程式。
提示:钠先与盐酸反应,过量的钠再与水反应。反应的化学方程式分别为2Na+2HCl══2NaCl+H2↑, 2Na+2H2O══2NaOH+H2↑。
探究任务1 钠与酸、碱、盐溶液的反应
2.把一小块钠放入CuSO4溶液中,可观察到哪些现象 写出反应的化学方程式。
提示:观察到钠浮在液面上,熔化成一闪亮的小球到处游动,有蓝色沉淀生成。反应的化学方程式为2Na+2H2O══
2NaOH+H2↑,CuSO4+2NaOH══Cu(OH)2↓+Na2SO4。合并后可得2Na+2H2O+CuSO4══Na2SO4+Cu(OH)2↓+H2↑。
归纳提升
钠与酸、碱、盐溶液的反应
1.钠与酸溶液的反应。
(1)钠与酸溶液反应时先与酸反应生成H2。
(2)如果钠过量,钠把酸消耗尽之后,再与水反应。
2.钠与碱溶液的反应,实质就是钠与水的反应。
3.钠与盐溶液反应时,首先与水反应生成NaOH,然后NaOH与盐发生复分解反应(若氢氧化钠不与盐反应,则只有钠与水的反应)。
例如:
(1)Na与Fe2(SO4)3溶液的反应
2Na+2H2O══2NaOH+H2↑,
6NaOH+Fe2(SO4)3══2Fe(OH)3↓+3Na2SO4。
(2)Na与K2SO4溶液的反应
2Na+2H2O══2NaOH+H2↑(仅此一步反应)。
典型例题
【例题1】 金属钠分别与下列溶液反应时,既有气体放出又有沉淀产生的是( )。
A.BaCl2溶液 B.K2SO4溶液
C.FeCl3溶液 D.NaNO3溶液
答案:C
解析:钠与盐溶液中的水反应生成NaOH和H2,故将钠放入水溶液中均有气体产生。A、B、D中均无沉淀生成,C中FeCl3与NaOH反应生成Fe(OH)3沉淀。
素养提升 钠与盐溶液的模型认知
【变式训练1】 将金属钠分别放入下列物质的水溶液中,生成白色沉淀的是( )。
A.MgCl2 B.NaCl C.CuCl2 D.HCl
答案:A
解析:金属钠与水反应生成氢氧化钠和氢气,再分析氢氧化钠能否与盐发生复分解反应。A项,氢氧化钠与氯化镁反应,生成氢氧化镁白色沉淀,正确;B项,氢氧化钠与氯化钠不反应,错误;C项,氢氧化钠与氯化铜反应产生蓝色沉淀,错误;D项,无沉淀产生,错误。
问题引领
1.Na2O2属于碱性氧化物吗 为什么
提示:不是碱性氧化物。原因是Na2O2与水反应时,除生成氢氧化钠外,还生成O2,因此,Na2O2不是碱性氧化物,而属于过氧化物。
探究任务2 Na2O2与CO2 、 H2O反应的三大关系
2.2.24 L的CO2和水蒸气的混合气体与足量的Na2O2反应,能得到相同条件下的气体多少升
提示:根据CO2与Na2O2、H2O与Na2O2反应的化学方程式可知,相同条件下,2.24 L CO2和水蒸气的混合气体与足量Na2O2反应生成1.12 L O2。
3.7.8 g Na2O2与足量水反应时转移电子的物质的量是多少
提示:由Na2O2与水反应的化学方程式可知,0.1 mol Na2O2与水反应转移0.1 mol电子。
归纳提升
Na2O2与CO2、H2O反应的三大关系:
反应的化学方程式为
2Na2O2+2CO2══2Na2CO3+O2①
2Na2O2+2H2O══4NaOH+O2↑②
1.物质的量关系。
不论是CO2还是H2O,通过足量的Na2O2时,放出O2的物质的量与CO2或H2O的物质的量之比均为1∶2。
2.电子转移关系。
在Na2O2与CO2或H2O的反应中,Na2O2既是氧化剂又是还原剂,每生成1 mol O2都转移2 mol电子。
3.固体质量关系。
(1)2Na2O2+2CO2══2Na2CO3+O2 Δm(固体)
2×78 g 2 mol 2×106 g 56 g
(2 mol CO的质量)
即发生反应①时,固体增加的质量等于与CO2等物质的量的CO的质量。
(2)2Na2O2+2H2O══4NaOH+O2↑ Δm(固体)
2×78 g 2 mol 4×40 g 4 g
(2 mol H2的质量)
即发生反应②时,固体增加的质量等于与H2O等物质的量的H2的质量。
(1)Na2O2中氧元素的化合价是-1价,Na2O中氧元素的化合价是-2价,Na2O2与水、CO2反应中,Na2O2既是氧化剂又是还原剂。
(2)Na2O2中阴、阳离子个数比是1∶2而不是1∶1。
典型例题
【例题2】 下列关于Na2O、Na2O2的比较,正确的是( )。
A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物
B.Na2O2、Na2O都是可溶于水(或能与水反应)的白色固体
C.Na2O2与CO2的反应中,Na2O2既是氧化剂,又是还原剂
D.Na2O2与水反应时,1 mol Na2O2转移2 mol电子
答案:C
解析:A项,Na2O2与水反应除了生成NaOH外,还有O2生成,所以Na2O2只是Na的氧化物,但不属于碱性氧化物;B项,Na2O2是淡黄色固体;C项,Na2O2与CO2的反应中,Na2O2既是氧化剂,又是还原剂;D项,Na2O2与H2O反应时,Na2O2中-1价的O变成了-2价的O和0价的O,故1 mol Na2O2转移1 mol电子。
【例题3】 CO和H2的混合气体21.2 g,与足量O2反应后,通过足量Na2O2,固体质量增加( )。
A.21.2 g B.14 g
C.6.78 g D.不能确定
答案:A
2Na2O2+2H2O══4NaOH+O2↑,2Na2O2+2CO2══2Na2CO3+O2。
将上述化学方程式合并可得:Na2O2+H2══2NaOH, Na2O2+CO══Na2CO3即反应结果相当于CO、H2恰好被Na2O2吸收,固体增加的质量就是CO和H2的总质量。
【变式训练2】 设NA表示阿伏加德罗常数的值,下列说法正确的是( )。
A.1 mol Na2O2固体中含离子总数为4NA
B.二氧化碳通过Na2O2粉末,反应后固体物质质量增大
C.Na2O2溶于水产生O2:Na2O2+H2O══2NaOH+O2↑
D.标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5NA
答案:B
解析:1 mol Na2O2固体中含离子总数为3NA,A项错误;C项中氧原子不守恒,错误;标准状况下5.6 L(0.25 mol)CO2与足量Na2O2反应转移0.25NA个电子,D项错误。
【变式训练3】 (双选)某实验小组通过下图所示实验,探究Na2O2与水的反应,下列说法中正确的是( )。
A.②中大量气泡中气
体的主要成分是氢气
B.③中溶液变红,说明
有碱性物质生成
C.④中现象可能是由于溶液中含有强氧化性物质造成的
D.⑤中MnO2的主要作用是降低了水中氧气的溶解度
答案:BC
解析:过氧化钠与水反应生成NaOH和氧气,则②中大量气泡中气体的主要成分是氧气,A错误;酚酞变红色说明溶液显碱性,③中溶液变红,说明有碱性物质生成,B正确;④中红色褪去,应该是由于溶液中的强氧化性物质氧化酚酞导致酚酞变质造成的,C正确;⑤中加入MnO2产生较多气泡,说明溶液中存在H2O2,MnO2的主要作用是作催化剂,D错误。
