2.2碳酸钠和碳酸氢钠 课件(共29张PPT)高中化学苏教版必修第一册专题三
文档属性
| 名称 | 2.2碳酸钠和碳酸氢钠 课件(共29张PPT)高中化学苏教版必修第一册专题三 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1000.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-27 00:00:00 | ||
图片预览







文档简介
(共29张PPT)
第二单元 金属钠及钠的化合物
第2课时 碳酸钠和碳酸氢钠
课标定位素养阐释
1.通过实验探究掌握Na2CO3、NaHCO3的主要性质。
2.了解Na2CO3、NaHCO3的主要用途。
3.通过阅读科学史话“侯氏制碱法”,了解纯碱的生产历史,认识化学在纯碱生产中的贡献,增强科学探究与创新意识,提升科学态度与社会责任。
碳酸钠和碳酸氢钠
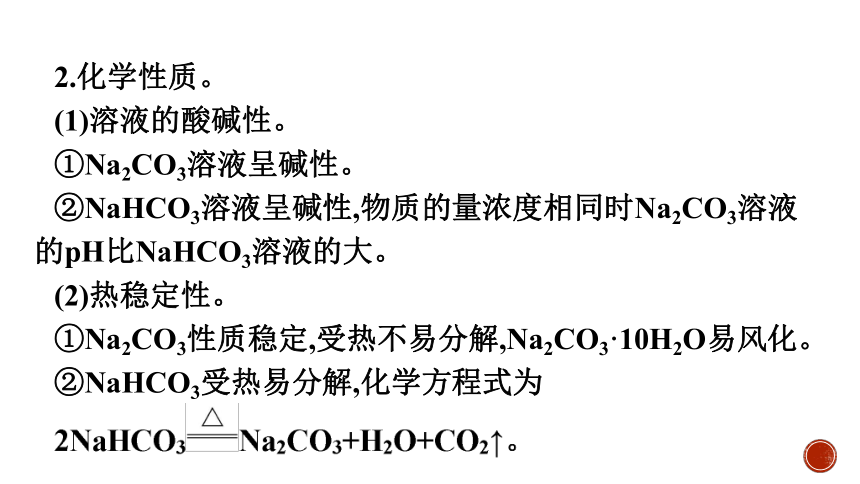
1.物理性质。
2.化学性质。
(1)溶液的酸碱性。
①Na2CO3溶液呈碱性。
②NaHCO3溶液呈碱性,物质的量浓度相同时Na2CO3溶液的pH比NaHCO3溶液的大。
(2)热稳定性。
①Na2CO3性质稳定,受热不易分解,Na2CO3·10H2O易风化。
②NaHCO3受热易分解,化学方程式为
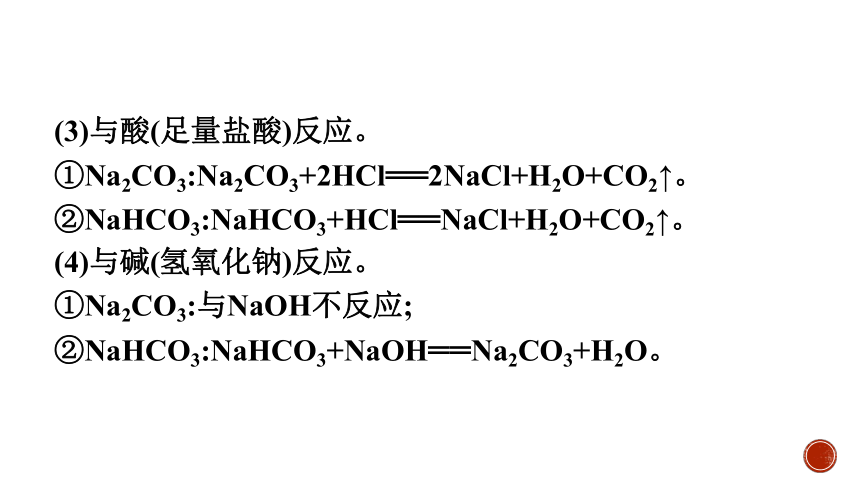
(3)与酸(足量盐酸)反应。
①Na2CO3:Na2CO3+2HCl══2NaCl+H2O+CO2↑。
②NaHCO3:NaHCO3+HCl══NaCl+H2O+CO2↑。
(4)与碱(氢氧化钠)反应。
①Na2CO3:与NaOH不反应;
②NaHCO3:NaHCO3+NaOH══Na2CO3+H2O。
(5)相互转化。
①Na2CO3→NaHCO3:
向Na2CO3溶液中通入CO2,化学方程式为
Na2CO3+H2O+CO2══2NaHCO3。
②NaHCO3→Na2CO3:
NaHCO3固体加热分解转化成Na2CO3。
NaHCO3溶液中加入适量NaOH溶液。
3.碳酸钠的制法——侯氏制碱法。写出主要反应的化学方程式:
(1)NaCl+NH3+CO2+H2O══NaHCO3↓+NH4Cl,
4.用途。
(1)碳酸钠:日常生活中,常用热的纯碱溶液去除物品表面的油污。在工业上,纯碱还是一种重要的化工原料,用途很广。纺织、造纸、制皂、玻璃生产等都需要大量的碳酸钠。
(2)碳酸氢钠:是发酵粉的主要成分之一,医疗上可用于治疗胃酸过多,常见的苏打水饮料中也含有碳酸氢钠。
【自主思考1】 发酵粉的主要成分为碳酸氢钠和酒石酸,请分析碳酸氢钠在面包制作中的作用是什么 化学反应原理是什么
提示:发酵粉溶于水后,碳酸氢钠与酒石酸和食物里含有的酸性物质发生反应生成水和二氧化碳气体,二氧化碳可以起蓬松食物的作用。
【自主思考2】 油炸黄鱼、鲜虾、鸡排或排骨时,在面粉糊里加入一点小苏打,吃起来又松又脆。你知道其中的道理吗
提示:因为小苏打受热后分解,会产生大量的二氧化碳气体,使油炸面糊里留下许多气孔。
【自主思考3】 如果面团发酵过头,会有酸味,此时可以加入碱性物质如碳酸钠,这是为什么
提示:面团发酵时产生的乳酸、醋酸等可与Na2CO3反应,减轻酸味,同时,产生的CO2还可以使面团变得更加松软。
【效果自测】
1.判断正误,正确的画“√”,错误的画“×”。
(1)用试管加热碳酸氢钠固体时,使试管口竖直向上。( )
(2)分别加热Na2CO3和NaHCO3固体,试管内壁均有水珠出现,则说明两种物质均受热分解。( )
(3)苏打是面包发酵粉的主要成分之一。( )
(4)向小苏打和苏打溶液中分别加入盐酸,均有气泡冒出,说明两者均能与盐酸反应。( )
×
×
×
√
2.下列各组内的两种物质发生反应时,其产物不随反应物用量的改变而发生变化的是( )。
A.CO2与澄清石灰水 B.NaOH溶液与CO2
C.Na2CO3溶液与盐酸 D.NaHCO3溶液与盐酸
答案:D
解析:A项,CO2不足量时生成CaCO3,CO2过量时生成Ca(HCO3)2;B项,CO2不足时生成Na2CO3,CO2过量时生成NaHCO3;C项,盐酸不足时生成NaHCO3和NaCl,盐酸足量时生成NaCl、H2O和CO2。
3.用“>”或“<”填空。
(1)热稳定性:NaHCO3 Na2CO3。
(2)与同浓度盐酸反应的剧烈程度:NaHCO3 Na2CO3。
(3)相同温度时,在水中的溶解性:NaHCO3 Na2CO3。
(4)等物质的量浓度溶液的pH:NaHCO3 Na2CO3。
答案:(1)< (2)> (3)< (4)<
问题引领
1.分别向等物质的量浓度的Na2CO3、NaHCO3的稀溶液中滴加同物质的量浓度的CaCl2溶液(如图1、图2所示),产生的实验现象相同吗 原因是什么
探究任务 碳酸钠与碳酸氢钠的鉴别
提示:不相同。图1试管中有白色沉淀生成,发生的反应为Na2CO3+CaCl2══CaCO3↓+2NaCl。
图2试管中无明显现象,因为NaHCO3与CaCl2不反应。
2.实验中若用盐酸替代CaCl2溶液,能否鉴别Na2CO3和NaHCO3两种溶液
提示:能。向溶液中逐滴加入盐酸,Na2CO3溶液中开始无气泡,过一会儿才会有气泡产生;NaHCO3溶液中一开始即有大量气泡产生。
3.能否用澄清石灰水鉴别NaHCO3和Na2CO3溶液 为什么
提示:不能。二者均与澄清石灰水反应生成CaCO3沉淀。
归纳提升
1.Na2CO3与NaHCO3的鉴别方法。
2.Na2CO3、NaHCO3的除杂方法。
依据两者性质的差异确定除杂方法(后者为杂质)
典型例题
【例题1】 (双选)下列说法正确的是( )。
A.溶解度:Na2CO3B.NaHCO3受热易分解,所以可用于制胃酸中和剂
D.用Na2CO3溶液鉴别CaCl2溶液、NaCl溶液和稀硫酸
答案:CD
解析:碳酸钠的溶解度大于碳酸氢钠的溶解度,A错误; NaHCO3可用于制胃酸中和剂是因为NaHCO3可以与胃酸中的HCl反应,而不是因为其受热易分解,B错误;2NaHCO3 Na2CO3+CO2↑+H2O,Na2CO3+Ca(OH)2══CaCO3↓+2NaOH,C正确;将Na2CO3溶液分别加入CaCl2溶液、NaCl溶液和稀硫酸中,所能观察到的现象分别为产生白色沉淀、无明显现象、产生大量气泡,能鉴别三者,D正确。
【例题2】 为除去括号内的杂质,所选用的试剂或方法不正确的是( )。
A.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
答案:D
解析:Ba(OH)2与Na2CO3和Na2SO4均发生化学反应生成白色沉淀,不符合除杂的要求。
【变式训练1】 有两试管分别装有Na2CO3和NaHCO3溶液,下列操作或判断正确的是( )。
答案:C
解析:A项中发生的反应分别为Na2CO3+Ca(OH)2══CaCO3↓+2NaOH,2NaHCO3+Ca(OH)2══CaCO3↓+Na2CO3+2H2O,两者现象相同均产生白色沉淀;B项滴加等浓度的稀盐酸时,NaHCO3溶液反应更剧烈;C项Na2CO3与CaCl2发生反应:Na2CO3+CaCl2══ CaCO3↓+2NaCl,产生白色沉淀,NaHCO3与CaCl2不反应;D项逐滴加入盐酸时,NaHCO3立即产生气泡,Na2CO3开始无气泡产生,过一会儿才产生气泡。
【变式训练2】 某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。
(1)只根据图Ⅰ所示实验,不能够达到实验目的的原因是 。
(2)图Ⅱ、Ⅲ所示实验均能鉴别这两种物质,其反应的化学方程式为 。
(3)若用实验Ⅱ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是 (填化学式)。
答案:(1)无论是Na2CO3还是NaHCO3均可以与盐酸反应产生CO2,两者的反应现象相同,故达不到鉴别目的
(2)2NaHCO3 Na2CO3+H2O+CO2↑,
CO2+Ca(OH)2══CaCO3↓+H2O
(3)NaHCO3
解析:(1)NaHCO3、Na2CO3都与盐酸反应放出CO2,不能达到目的。
(2)Ⅱ、Ⅲ都是利用NaHCO3的不稳定性进行鉴别。
(3)试管B中装入碳酸氢钠,试管A中装入碳酸钠,这样直接加热的碳酸钠温度高,不分解,不能使澄清石灰水变浑浊,而间接加热的碳酸氢钠分解,使澄清石灰水变浑浊,表明了碳酸氢钠很不稳定。
第二单元 金属钠及钠的化合物
第2课时 碳酸钠和碳酸氢钠
课标定位素养阐释
1.通过实验探究掌握Na2CO3、NaHCO3的主要性质。
2.了解Na2CO3、NaHCO3的主要用途。
3.通过阅读科学史话“侯氏制碱法”,了解纯碱的生产历史,认识化学在纯碱生产中的贡献,增强科学探究与创新意识,提升科学态度与社会责任。
碳酸钠和碳酸氢钠
1.物理性质。
2.化学性质。
(1)溶液的酸碱性。
①Na2CO3溶液呈碱性。
②NaHCO3溶液呈碱性,物质的量浓度相同时Na2CO3溶液的pH比NaHCO3溶液的大。
(2)热稳定性。
①Na2CO3性质稳定,受热不易分解,Na2CO3·10H2O易风化。
②NaHCO3受热易分解,化学方程式为
(3)与酸(足量盐酸)反应。
①Na2CO3:Na2CO3+2HCl══2NaCl+H2O+CO2↑。
②NaHCO3:NaHCO3+HCl══NaCl+H2O+CO2↑。
(4)与碱(氢氧化钠)反应。
①Na2CO3:与NaOH不反应;
②NaHCO3:NaHCO3+NaOH══Na2CO3+H2O。
(5)相互转化。
①Na2CO3→NaHCO3:
向Na2CO3溶液中通入CO2,化学方程式为
Na2CO3+H2O+CO2══2NaHCO3。
②NaHCO3→Na2CO3:
NaHCO3固体加热分解转化成Na2CO3。
NaHCO3溶液中加入适量NaOH溶液。
3.碳酸钠的制法——侯氏制碱法。写出主要反应的化学方程式:
(1)NaCl+NH3+CO2+H2O══NaHCO3↓+NH4Cl,
4.用途。
(1)碳酸钠:日常生活中,常用热的纯碱溶液去除物品表面的油污。在工业上,纯碱还是一种重要的化工原料,用途很广。纺织、造纸、制皂、玻璃生产等都需要大量的碳酸钠。
(2)碳酸氢钠:是发酵粉的主要成分之一,医疗上可用于治疗胃酸过多,常见的苏打水饮料中也含有碳酸氢钠。
【自主思考1】 发酵粉的主要成分为碳酸氢钠和酒石酸,请分析碳酸氢钠在面包制作中的作用是什么 化学反应原理是什么
提示:发酵粉溶于水后,碳酸氢钠与酒石酸和食物里含有的酸性物质发生反应生成水和二氧化碳气体,二氧化碳可以起蓬松食物的作用。
【自主思考2】 油炸黄鱼、鲜虾、鸡排或排骨时,在面粉糊里加入一点小苏打,吃起来又松又脆。你知道其中的道理吗
提示:因为小苏打受热后分解,会产生大量的二氧化碳气体,使油炸面糊里留下许多气孔。
【自主思考3】 如果面团发酵过头,会有酸味,此时可以加入碱性物质如碳酸钠,这是为什么
提示:面团发酵时产生的乳酸、醋酸等可与Na2CO3反应,减轻酸味,同时,产生的CO2还可以使面团变得更加松软。
【效果自测】
1.判断正误,正确的画“√”,错误的画“×”。
(1)用试管加热碳酸氢钠固体时,使试管口竖直向上。( )
(2)分别加热Na2CO3和NaHCO3固体,试管内壁均有水珠出现,则说明两种物质均受热分解。( )
(3)苏打是面包发酵粉的主要成分之一。( )
(4)向小苏打和苏打溶液中分别加入盐酸,均有气泡冒出,说明两者均能与盐酸反应。( )
×
×
×
√
2.下列各组内的两种物质发生反应时,其产物不随反应物用量的改变而发生变化的是( )。
A.CO2与澄清石灰水 B.NaOH溶液与CO2
C.Na2CO3溶液与盐酸 D.NaHCO3溶液与盐酸
答案:D
解析:A项,CO2不足量时生成CaCO3,CO2过量时生成Ca(HCO3)2;B项,CO2不足时生成Na2CO3,CO2过量时生成NaHCO3;C项,盐酸不足时生成NaHCO3和NaCl,盐酸足量时生成NaCl、H2O和CO2。
3.用“>”或“<”填空。
(1)热稳定性:NaHCO3 Na2CO3。
(2)与同浓度盐酸反应的剧烈程度:NaHCO3 Na2CO3。
(3)相同温度时,在水中的溶解性:NaHCO3 Na2CO3。
(4)等物质的量浓度溶液的pH:NaHCO3 Na2CO3。
答案:(1)< (2)> (3)< (4)<
问题引领
1.分别向等物质的量浓度的Na2CO3、NaHCO3的稀溶液中滴加同物质的量浓度的CaCl2溶液(如图1、图2所示),产生的实验现象相同吗 原因是什么
探究任务 碳酸钠与碳酸氢钠的鉴别
提示:不相同。图1试管中有白色沉淀生成,发生的反应为Na2CO3+CaCl2══CaCO3↓+2NaCl。
图2试管中无明显现象,因为NaHCO3与CaCl2不反应。
2.实验中若用盐酸替代CaCl2溶液,能否鉴别Na2CO3和NaHCO3两种溶液
提示:能。向溶液中逐滴加入盐酸,Na2CO3溶液中开始无气泡,过一会儿才会有气泡产生;NaHCO3溶液中一开始即有大量气泡产生。
3.能否用澄清石灰水鉴别NaHCO3和Na2CO3溶液 为什么
提示:不能。二者均与澄清石灰水反应生成CaCO3沉淀。
归纳提升
1.Na2CO3与NaHCO3的鉴别方法。
2.Na2CO3、NaHCO3的除杂方法。
依据两者性质的差异确定除杂方法(后者为杂质)
典型例题
【例题1】 (双选)下列说法正确的是( )。
A.溶解度:Na2CO3
D.用Na2CO3溶液鉴别CaCl2溶液、NaCl溶液和稀硫酸
答案:CD
解析:碳酸钠的溶解度大于碳酸氢钠的溶解度,A错误; NaHCO3可用于制胃酸中和剂是因为NaHCO3可以与胃酸中的HCl反应,而不是因为其受热易分解,B错误;2NaHCO3 Na2CO3+CO2↑+H2O,Na2CO3+Ca(OH)2══CaCO3↓+2NaOH,C正确;将Na2CO3溶液分别加入CaCl2溶液、NaCl溶液和稀硫酸中,所能观察到的现象分别为产生白色沉淀、无明显现象、产生大量气泡,能鉴别三者,D正确。
【例题2】 为除去括号内的杂质,所选用的试剂或方法不正确的是( )。
A.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
答案:D
解析:Ba(OH)2与Na2CO3和Na2SO4均发生化学反应生成白色沉淀,不符合除杂的要求。
【变式训练1】 有两试管分别装有Na2CO3和NaHCO3溶液,下列操作或判断正确的是( )。
答案:C
解析:A项中发生的反应分别为Na2CO3+Ca(OH)2══CaCO3↓+2NaOH,2NaHCO3+Ca(OH)2══CaCO3↓+Na2CO3+2H2O,两者现象相同均产生白色沉淀;B项滴加等浓度的稀盐酸时,NaHCO3溶液反应更剧烈;C项Na2CO3与CaCl2发生反应:Na2CO3+CaCl2══ CaCO3↓+2NaCl,产生白色沉淀,NaHCO3与CaCl2不反应;D项逐滴加入盐酸时,NaHCO3立即产生气泡,Na2CO3开始无气泡产生,过一会儿才产生气泡。
【变式训练2】 某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。
(1)只根据图Ⅰ所示实验,不能够达到实验目的的原因是 。
(2)图Ⅱ、Ⅲ所示实验均能鉴别这两种物质,其反应的化学方程式为 。
(3)若用实验Ⅱ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是 (填化学式)。
答案:(1)无论是Na2CO3还是NaHCO3均可以与盐酸反应产生CO2,两者的反应现象相同,故达不到鉴别目的
(2)2NaHCO3 Na2CO3+H2O+CO2↑,
CO2+Ca(OH)2══CaCO3↓+H2O
(3)NaHCO3
解析:(1)NaHCO3、Na2CO3都与盐酸反应放出CO2,不能达到目的。
(2)Ⅱ、Ⅲ都是利用NaHCO3的不稳定性进行鉴别。
(3)试管B中装入碳酸氢钠,试管A中装入碳酸钠,这样直接加热的碳酸钠温度高,不分解,不能使澄清石灰水变浑浊,而间接加热的碳酸氢钠分解,使澄清石灰水变浑浊,表明了碳酸氢钠很不稳定。
