贵州省贵阳市白云区兴农中学2022-2023学年高一下学期期中考试化学试题(含解析)
文档属性
| 名称 | 贵州省贵阳市白云区兴农中学2022-2023学年高一下学期期中考试化学试题(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 820.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-27 00:00:00 | ||
图片预览




文档简介
贵州省贵阳市白云区兴农中学2022-2023学年高一下学期期中考试
化学试题
命时长90分钟 满分100分
供参考的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cu 64
第Ⅰ卷 (选择题共48分)
一、单项选择题(本题共16小题,每小题3分,共48分)
1.近年来,大数据电子信息产业蓬勃发展,长安携手华为和宁德时代让“中国智造”更强大。下列有关说法不正确的是
A.新能源汽车中使用的芯片材料为高纯硅
B.华为数据中心进行信息传输的光导纤维成分为
C.宁德时代的年产能约16GWh的锂电池属于一次电池
D.新能源汽车的推广与使用有助于减少光化学烟雾的产生
2.硫在自然界的循环过程如图所示。下列说法中不正确的是
A.火山喷发、森林火灾会产生
B.产生的气体溶于水形成硫酸型酸雨,反应为
C.工厂产生的烟气应经脱硫处理后再排放
D.硫在自然界中,既有化合态形式存在,也有游离态形式存在
3.下列四种有色溶液与作用,均能使其褪色,其实质相同的是
①品红溶液 ②酸性溶液 ③溴水 ④滴有酚酞的溶液
A.①④ B.①② C.②③ D.③④
4.硫酸能在金星的上层大气中找到,离星球表面约45~70公里的硫酸云层覆盖整个金星表面。下列叙述正确的是
A.浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体
B.浓硫酸与单质硫反应的化学方程式为,在此反应中,浓硫酸既表现了强氧化性又表现了酸性
C.常温下能够用铁、铝等容器盛放浓,是因为浓的强氧化性使铁、铝钝化
D.浓硫酸具有吸水性,因而能使蔗糖碳化
5.在汽车尾气净化装置中,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法不正确的是
A.该反应为固氮反应之一
B.NO为无色气体,为红棕色气体
C.NO、CO均能与人体中的血红蛋白结合
D.该催化转化的总反应的化学方程式为
6.某同学进行如图所示实验:先在培养皿中央的固体上滴几滴浓氨水,立即用一个表面皿扣在上面。下列对实验现象与解释不正确的是
选项 实验现象 解释
A 浓盐酸附近产生白烟 与反应生成固体
B 浓硫酸附近无白烟 浓硫酸无挥发性,但可以吸收氨气
C 湿润的蓝色石蕊试纸变红 与水反应生成的显碱性
D 溶液变浑浊 反应生成沉淀
A.A B.B C.C D.D
7.用以下三种途径来制取相同质量的硝酸铜:①铜跟浓硝酸反应;②铜跟稀硝酸反应;③铜跟氧气反应生成氧化铜,氧化铜再跟稀硝酸反应。以下叙述正确的是
A.三种途径所消耗的铜的物质的量不相等
B.三种途径所消耗的硝酸的物质的量相等
C.所消耗铜的物质的量:途径③>途径①>途径②
D.所消耗硝酸的物质的量:途径①>途径②>途径③
8.硅是带来人类文明的重要元素之一,科学家也提出硅是“21世纪的能源”。这主要是由于硅及其化合物对社会发展所起的巨大促进作用。下列关于硅及其化合物的说法中错误的是
A.传统无机非金属材料是指玻璃、水泥、陶瓷等硅酸盐材料
B.传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐
C.硅的导电性能介于导体和绝缘体之间,是良好的半导体材料。
D.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
9.已知某化学反应(、、的结构式分别为、、),反应过程中的能量变化如图所示,下列有关叙述正确的是
A.该反应的进行一定需要加热或点燃才能进行
B.该反应若生成,则放出的热量为
C.该反应断开反应物中化学键吸收的总能量大于形成生成物中化学键释放的总能量
D.反应的能量变化跟上图相似
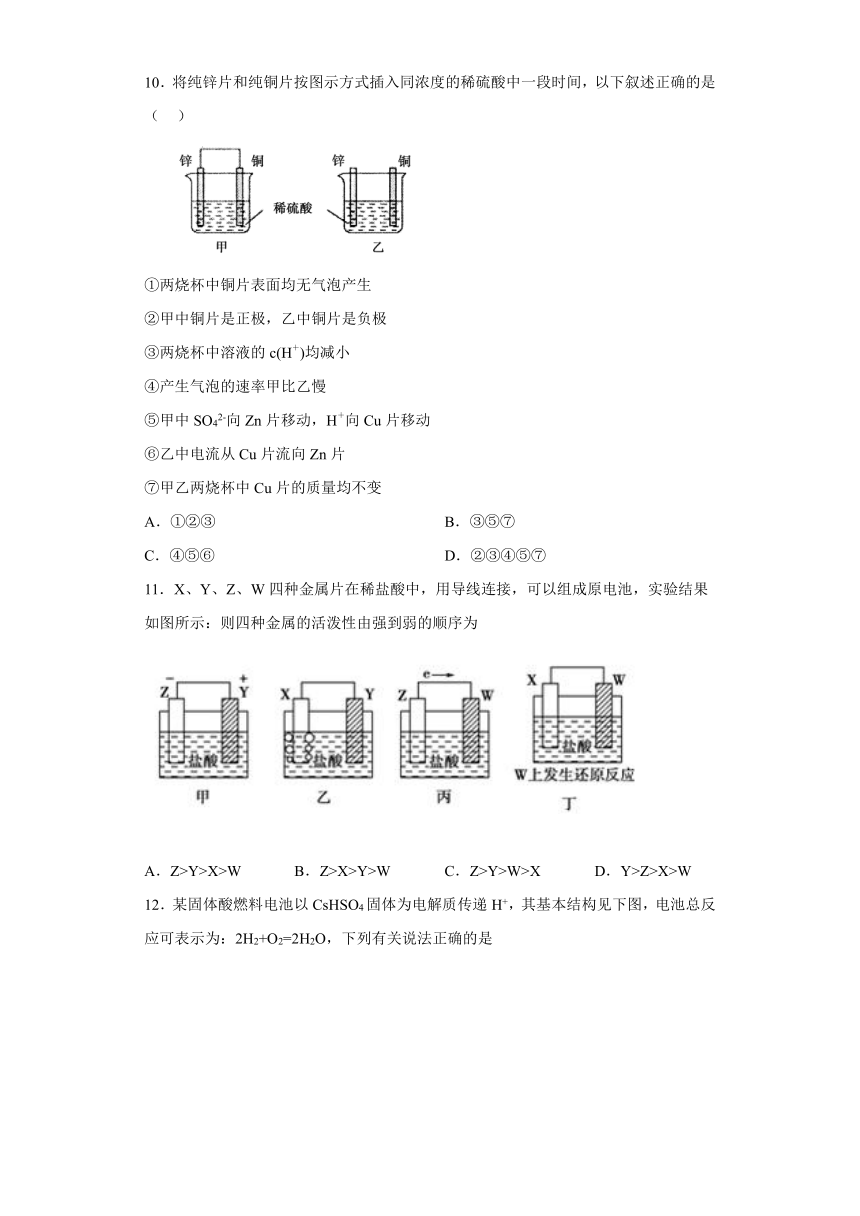
10.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
①两烧杯中铜片表面均无气泡产生
②甲中铜片是正极,乙中铜片是负极
③两烧杯中溶液的c(H+)均减小
④产生气泡的速率甲比乙慢
⑤甲中SO42-向Zn片移动,H+向Cu片移动
⑥乙中电流从Cu片流向Zn片
⑦甲乙两烧杯中Cu片的质量均不变
A.①②③ B.③⑤⑦
C.④⑤⑥ D.②③④⑤⑦
11.X、Y、Z、W四种金属片在稀盐酸中,用导线连接,可以组成原电池,实验结果如图所示:则四种金属的活泼性由强到弱的顺序为
A.Z>Y>X>W B.Z>X>Y>W C.Z>Y>W>X D.Y>Z>X>W
12.某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e--=4OH--
C.每转移0.1mol电子,消耗1.12L的H2
D.H+由a极通过固体酸电解质传递到b极
13.对于反应,下列反应速率的关系正确的是
A. B.
C. D.
14.在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8mol/L和5.4mol/L,在一定条件下发生N2+ 3H2= 2NH3,10min后测得N2的浓度是0.8mol/L,则在这10min内N2的平均反应速率是( )
A.0.2mol/(L·min) B.0.3 mol/(L·min)
C.0.1 mol/(L·min) D.0.6 mol/(L·min)
15.为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A~D四个实验,你认为结论不正确的是
A.在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快
B.将相同大小、形状的镁条和铝条分别与相同浓度的盐酸反应时,铝条反应快
C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解
D.两支试管中分别加入相同浓度相同体积的双氧水,其中一支试管中再加入几滴氯化铁溶液,产生氧气的快慢不同
16.下列装置所示的实验中,能达到实验目的的是
图1 图2 图3 图4
A.图1分离碘酒中的碘和酒精 B.图2实验室制氨气
C.图3除去Cl2中的HCl D.图4排水集气法收集NO
第Ⅱ卷 (非选择题共52分)
17.按要求填空
向盛有等量铜片的四支试管中分别加入等体积的①浓硫酸;②稀硫酸;③浓硝酸;④稀硝酸,能随即发生反应的是(填序号,下同) ,微热则发生反应的是 ,加热后发生反应的是 ,加热也不发生反应的是 。由此可以得到上述四种酸氧化性由强到弱的顺序是 (填序号)。写出Cu与浓硫酸反应的化学方程式 。
18.下图是甲、乙两位同学探究铜与稀硝酸反应还原产物的实验装置图,请回答下列问题:
(1)写出铜和稀硝酸反应的离子方程式: 。
(2)实验装置甲能否证明铜和稀硝酸反应的产物是NO气体 (填“能”或“不能”),请简述理由(用文字和化学方程式表示):
(3)若用实验装置乙进行实验,该装置的优点是 。
19.已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置可以实现该反应。
回答下列问题:
(1)A中加入的物质是 ,发生反应的化学方程式是 ;
(2)B中加入的物质是 ,其作用是 ;
(3)实验时在C中观察到的现象是 。发生反应的化学方程式是 ;
(4)D中收集到的物质是 ,检验该物质的方法和现象是 。
20.根据原电池原理,结合装置图,按要求解答问题:
(1)若X为Zn,Y为硫酸铜溶液,则X为 (填电极名称),溶液中的移向 (填“Cu”或“X”)电极。该电池所发生的离子反应为
(2)若X为银,Y为硝酸银溶液,则X为 (填电极名称),溶液中的移向 (填“Cu”或“X”)电极。X电极上的电极反应式为 。
(3)若X为石墨,Y为稀硝酸溶液,则X为 (填电极名称),Cu电极上发生 反应(填氧化或还原)。X电极上的电极反应式为 。
21.把在空气中久置的铝片5.0g投入盛有盐酸溶液的烧杯中,该铝片与盐酸反应产生氢气的速率与反应时间的关系可用下图所示的坐标曲线来表示,回答下列问题:
(1)曲线段不产生氢气的原因是因为表面形成致密的氧化膜,写出离子方程式为 ;
(2)曲线b→c段产生氢气的速率增加较快的主要原因是 ;
(3)曲线C以后的速率下降的主要原因 。
(4)若反应进行了10s,收集标况下的氢气的体积为1.12L,用盐酸表示该反应的速率为 。
(5)向溶液中加入少量的Cu,也能加快上述化学反应速率的原因 。
1.C
【详解】A.高纯硅为良好的半导体材料,是制造芯片的材料,故A正确;
B.二氧化硅具有良好的导光性,是制造光导纤维主要原料,故B正确;
C.锂电池可进行充放电,属于二次电池,故C错误;
D.燃油汽车尾气中含有大量氮氧化物,能引起光化学烟雾,新能源汽车的推广与使用可以减少燃油汽车尾气排放,有助于减少光化学烟雾的产生,故D正确;
故答案选C。
2.B
【详解】A.由图可知,火山喷发、森林火灾会产生,A正确;
B.含硫燃料燃烧生成二氧化硫、排放到空气中的二氧化硫与氧气反应生成三氧化硫、三氧化硫与水反应生成硫酸;二氧化硫也可以和水分反应生成亚硫酸、亚硫酸被氧气氧化成为硫酸, B不正确;
C. 二氧化硫会引起酸雨,故工厂产生的烟气应经脱硫处理后再排放,可减少酸雨的产生,C正确;
D. 硫在自然界中,有化合态形式存在,例如硫化物、硫酸盐等,也有游离态形式存在,以单质硫存在于火山喷发口附近,D正确;
答案选B。
3.C
【详解】①二氧化硫具有漂白性,能使品红溶液褪色;
②二氧化硫具有还原性,能与酸性高锰酸钾溶液发生氧化还原反应,使酸性高锰酸钾溶液褪色;
③二氧化硫具有还原性,能与溴水发生氧化还原反应,使溴水褪色;
④二氧化硫是酸性氧化物,能与滴有酚酞的氢氧化钠溶液反应使溶液褪色;
由以上分析可知,②③褪色的实质相同;
故选C。
4.C
【详解】A. 浓硫酸能与氨气反应,不能够干燥氨气,A错误;
B. 浓硫酸与单质硫反应的化学方程式为中,浓硫酸中S化合价全部降低,只表现了强氧化性,B错误;
C.浓的强氧化性使铁、铝钝化,故常温下能够用铁、铝等容器盛放浓, C正确;
D. 浓硫酸使蔗糖碳化体现其脱水性, D错误;
答案选C。
5.A
【详解】A. 氮的固定是游离态氮元素变化为化合态氮元素,该反应为含氮化合物转变为氮气,不属于固氮反应,A错误;
B. 通常,NO为无色气体、为红棕色气体,B正确;
C. NO、CO均能与人体中的血红蛋白结合,超过一定量的NO、CO均能使人中毒,C正确;
D. 由图、结合电子数守恒、元素质量守恒可知,该催化转化的总反应的化学方程式为,D正确;
答案选A。
6.C
【分析】在培养皿中央的固体上滴几滴浓氨水,立即产生氨气。
【详解】A.氨气与挥发性酸盐酸反应生成白色固体氯化铵,现象产生大量白烟,故A正确;
B.浓硫酸虽然难挥发,但是氨气与浓硫酸二者可以反应生成硫酸铵,故现象为:浓硫酸附近无白烟,故B正确;
C.氨气与水反应生成一水合氨,一水合氨电离产生氢氧根离子,溶液显碱性,所以应该是湿润的红色石蕊试纸变蓝,故C错误;
D.氨气与硫酸镁溶液反应生成硫酸铵和氢氧化镁沉淀,故现象是硫酸镁溶液变浑浊,故D正确;
故选C。
7.D
【分析】根据题意,有关反应为:①Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;②3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;③2Cu+O22CuO,CuO+2HNO3(稀)=Cu(NO3)2+H2O,由以上三组反应,可以看出:生成相同质量的Cu(NO3)2,消耗相同质量的铜,但消耗硝酸的质量(或物质的量)不相同,途径①消耗HNO3最多,途径②次之,途径③消耗HNO3最少。通过比较可以看出,生产Cu(NO3)2,途径③效果最佳,既不造成污染,又能提高HNO3的利用,以此来解答。
【详解】A.根据原子守恒,铜单质最终转化为硝酸铜,则三种途径制取相同质量的硝酸铜,所消耗的铜的物质的量相等,故A错误;
B.由分析可知,三种途径耗相同质量的铜,但消耗硝酸的质量(或物质的量)不相同,途径①消耗HNO3最多,途径②次之,途径③消耗HNO3最少,故B错误;
C.根据A项分析可知,三种途径消耗铜的质量相等,则所消耗铜的物质的量也相等:途径①=途径②=途径③,故C错误;
D.根据分析可知,耗硝酸的质量(或物质的量)不相同,途径①消耗HNO3最多,途径②次之,途径③消耗HNO3最少,则所消耗硝酸的物质的量:途径①>途径②>途径③,故D正确;
答案选D。
8.B
【详解】A.玻璃、水泥、陶瓷等硅酸盐材料是传统的无机非金属材料,A正确;
B.新型无机非金属材料的主要成分不是硅酸盐,例如高温结构陶瓷的成分可以是氮化硅、光导纤维的成分是二氧化硅等,B不正确;
C. 硅是良好的半导体材料,其导电性能介于导体和绝缘体之间, C正确;
D. 高纯度的二氧化硅广泛用于制作光导纤维,二氧化硅是酸性氧化物,能与氢氧化钠等强碱反应生成可溶性盐,故光导纤维遇强碱会“断路” ,D正确;
答案选B。
9.C
【详解】A.ΔH>0,ΔS<0,反应为吸热反应,吸热反应不一定需要加热或点燃的条件,例如:氢氧化钡和氯化铵在常温下就可以进行,A错误;
B.该反应若生成,则吸收的热量为,B错误;
C.该反应断开反应物中化学键吸收的总能量大于形成生成物中化学键释放的总能量,C正确;
D.为放热反应,反应的能量变化跟上图不相似,D错误;
故选AC。
10.B
【分析】甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑;乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此解答该题。
【详解】①甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故错误;
②乙没有形成原电池反应,没有正负极,故错误;
③两烧杯中的氢离子发生反应,c(H+)减少,故正确;
④甲能形成原电池,乙不能构成原电池,所以产生气泡的速度甲比乙快,故错误;
⑤甲为原电池,锌为负极,铜为正极,阴离子向负极移动,阳离子向正极移动,故正确;
⑥乙没有形成原电池,没有电流产生,故错误;
⑦甲中Cu为正极,质量不变,乙中铜与氢离子不反应,质量不变,故正确;
故选B。
11.A
【解析】形成原电池时,较为活泼的金属为负极,较不活泼的金属为正极,负极发生氧化反应,正极发生还原反应,可生成金属、气体等,结合两极反应的现象进行判断。
【详解】甲中Z、Y组合时,Z为负极,则活泼性Z>Y;
乙中X、Y组合时,X电极上有气泡,则X为正极,则活泼性Y>X;
丙中Z、W组合时,电子从Z流向W,则Z为负极,则活泼性Z>W;
丁中X、W组合时,W上发生还原反应,说明W为正极,活泼性X>W;
因此活泼性Z>Y>X>W,故选A。
12.D
【详解】A.燃料电池中,通入燃料氢气的电极是负极,则a是负极,通入氧化剂的电极b是正极,电子从负极a沿导线流向正极b,A错误;
B.b是正极,电极反应式为O2+4e-+4H+=2H2O,B错误;
C.温度和压强未知,导致气体摩尔体积未知,所以无法计算氢气体积,C错误;
D.放电时,a是负极、b是正极,阳离子氢离子从负极a通过固体酸电解质传递到b极,D正确,答案选选D。
13.D
【分析】在同一时间段,用不同物质表示反应速率时,速率比等于化学方程式中相应物质的化学计量数的比,据此分析判断。
【详解】A.v(NH3):v(O2)=4:5,所以v(O2)=v(NH3),A错误;
B.v(O2):v(H2O)=5:6,所以v(H2O)=v(O2),B错误;
C.v(NH3):v(H2O)=4:6,所以v(H2O)=v(NH3),C错误;
D.v(NO):v(O2)=4:5,所以v(NO)=v(O2),D正确;
故合理选项是D。
14.C
【详解】10min内N2浓度的变化量为△c(N2)=(1.8-0.8)mol/L=1.0mol/L,则这段时间内用氮气表示的平均反应速率v(N2)== =0.1 mol L-1 min-1,故选C。
15.B
【详解】A.其它条件相同,只有CaCO3固体表面积不同,反应速率不同,说明在相同条件下,固体表面积越大,反应速率越快,A结论合理;
B.Mg、Al两种不同的金属与同浓度的盐酸反应,两种反应速率不同,说明金属活动性不同,反应速率不变,即参加反应的物质本身的性质影响化学反应速率,镁活泼性大于铝,镁条反应快,B结论不合理;
C.同一浓度的浓硝酸在光照时分解速率大于在暗处的分解速率,说明光照可以加快浓硝酸的分解速率,C结论合理;
D.相同浓度相同体积的双氧水中,加入氯化铁溶液的反应产生氧气的速率大于未滴加氯化铁溶液的速率,说明氯化铁是双氧水分解的催化剂,可加快反应速率,D结论合理;
故选:B。
16.D
【详解】A. 碘易溶于酒精,不能用分液法分离碘酒中的碘和酒精, A错误;
B. 实验室不能通过氯化铵分解制氨气,因为氯化铵受热分解生成的氨气和氯化氢会重新化合成氯化铵,应通过加热熟石灰和氯化铵固体的混合物制取氨气,熟石灰与氯化铵共热反应生成氯化钙、氨气和水,B错误;
C. NaOH既能与HCl反应,也能与Cl2反应,所以不能用NaOH溶液除去氯气中的HCl,C错误;
D. NO难溶于水,可用排水法收集,D正确;
答案选D。
17. ③ ④ ① ② ③④①②
【分析】浓硝酸和铜常温下可以直接反应,稀硝酸需要微热,浓硫酸与铜加热情况下也可以发生反应,稀硫酸与铜加热也不反应;氧化性强弱和反应的难易程度有关,故顺序为③④①②,铜和浓硫酸反应生成硫酸铜、水和二氧化硫。
【详解】浓硝酸和铜常温下可以直接反应,故填③;稀硝酸需要微热,故填④;浓硫酸与铜加热情况下也可以发生反应,故填①;稀硫酸与铜加热也不反应,故填②;氧化性强弱和反应的难易程度有关,故顺序为③④①②;铜和浓硫酸反应生成硫酸铜、水和二氧化硫,故答案为:。
18.(1)
(2) 不能 NO极易被空气中的氧气氧化为NO2,无法证明。
(3)稀硝酸与铜片产生的气体直接产生的NO与空气不接触,不易被氧气氧化。
【分析】甲图为铜和稀硝酸反应生成NO,圆底烧瓶中有大量空气,NO极易被氧化为NO2,NO2与水反应生成NO,乙图中整个U型管中充满稀硝酸,防止产生的NO被氧化。
【详解】(1)铜和稀硝酸反应的离子方程式:。
(2)不能;NO极易被空气中的氧气氧化为NO2,无法证明。
(3)乙图中整个U型管中充满稀硝酸,防止产生的NO被氧化。
19.(1) NH4Cl、Ca(OH)2 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(2) 碱石灰(或固体CaO或固体NaOH) 除去NH3气流中的水蒸气(或干燥NH3)
(3) 黑色粉末逐渐变为红色 2NH3+3CuON2+3H2O+3Cu
(4) 氨水 可用用红色石蕊试纸检验,试纸变蓝,用无水硫酸铜检验,无水硫酸铜变蓝
【分析】装置A中,NH4Cl与Ca(OH)2在加热条件下反应制取NH3;装置B中碱石灰等用于吸收NH3中的水蒸气;装置C用于进行NH3还原CuO的实验;装置D用于冷凝水蒸气,并收集到氨水;装置E用于收集N2。
【详解】(1)装置A中加入的物质为NH4Cl与Ca(OH)2,在加热条件下发生反应生成氨气等,化学方程式是2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O。
(2)B中药品用于干燥氨气,加入的物质是碱石灰(或固体CaO或固体NaOH),其作用是:除去NH3气流中的水汽(或干燥NH3)。
(3)装置C中,进行NH3还原CuO的实验,此时CuO部分被还原为Cu,实验时在C中观察到的现象是:黑色粉末部分逐渐变为红色,发生反应的化学方程式是:2NH3+3CuON2+3H2O+3Cu。
(4)实验时生成的水蒸气在D中液化,同时未反应的NH3溶解在液化的水中形成氨水,故D中收集到的物质是氨水;氨水具有碱性,能使红色石蕊试纸变蓝,水会使无水硫酸铜变蓝,故检验该物质时,可用红色石蕊试纸检验,试纸变蓝,用无水硫酸铜检验,无水硫酸铜变蓝。
20.(1) 负极 Cu Zn+Cu2+=Zn2++Cu
(2) 正极 X Ag++e-= Ag
(3) 正极 氧化
【分析】原电池中活泼金属为负极,失去电子发生氧化反应,不活泼金属或者非金属为正极,发生还原反应,原电池工作时,阳离子移向正极,阴离子移向负极。
【详解】(1)若X为Zn,形成了Zn-Cu-CuSO4溶液原电池,Zn是活泼金属为负极,Cu是不活泼金属为正极,Cu2+离子向正极Cu一边移动,总反应的离子方程式为Zn+Cu2+=Zn2++Cu;
(2)若X为Ag,形成了Cu-Ag-AgNO3溶液的原电池,与Ag相比,Cu是活泼金属为负极,Ag为正极,Ag+离子向正极Ag一边移动,正极上发生还原反应,Ag+离子变成Ag单质,电极反应式为Ag++e-= Ag;
(3)X为石墨,形成了Cu-C-HNO3溶液原电池,Cu是活泼金属为负极,C是非金属为正极,负极Cu电极发生氧化反应,正极上是硝酸根离子得电子生成NO,电极反应式为:。
21.(1)。
(2)Al与HCl反应为放热反应,溶液温度升高,化学反应速率加快。
(3)盐酸浓度下降,导致化学反应速率下降。
(4)0.02mol/L-1·s-1。
(5)构成了Al-HCl-Cu原电池,加快了反应速率。
【分析】把在空气中久置的铝片5.0g投入盛有盐酸溶液的烧杯中,反应开始时,氧化铝和盐酸反应生成水,无气体产生,之后铝和盐酸反应,盐酸浓度逐渐下降,反应速率上升,考虑铝与盐酸反应放热,溶液温度升高,反应速率加快,之后反应速率下降,考虑盐酸浓度下降过多之后反应速率主要和浓度相关,反应速率根据氢气的物质的量是盐酸的一般列式进行计算,加入少量的Cu,形成Al-HCl-Cu原电池,原电池可以加快化学反应速率。
【详解】(1)反应开始时,氧化铝和盐酸反应生成水,无气体产生,故答案为:。
(2)铝和盐酸反应,盐酸浓度逐渐下降,反应速率上升,考虑铝与盐酸反应放热,溶液温度升高,反应速率加快。
(3)反应速率下降段,考虑盐酸浓度下降过多之后反应速率主要和浓度相关,盐酸浓度下降,反应速率下降。
(4)反应速率根据氢气的物质的量是盐酸的一般列式进行计算,设反应的盐酸物质的量为Δn,则有:
(5)加入少量的Cu,形成Al-HCl-Cu原电池,原电池可以加快化学反应速率。
化学试题
命时长90分钟 满分100分
供参考的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cu 64
第Ⅰ卷 (选择题共48分)
一、单项选择题(本题共16小题,每小题3分,共48分)
1.近年来,大数据电子信息产业蓬勃发展,长安携手华为和宁德时代让“中国智造”更强大。下列有关说法不正确的是
A.新能源汽车中使用的芯片材料为高纯硅
B.华为数据中心进行信息传输的光导纤维成分为
C.宁德时代的年产能约16GWh的锂电池属于一次电池
D.新能源汽车的推广与使用有助于减少光化学烟雾的产生
2.硫在自然界的循环过程如图所示。下列说法中不正确的是
A.火山喷发、森林火灾会产生
B.产生的气体溶于水形成硫酸型酸雨,反应为
C.工厂产生的烟气应经脱硫处理后再排放
D.硫在自然界中,既有化合态形式存在,也有游离态形式存在
3.下列四种有色溶液与作用,均能使其褪色,其实质相同的是
①品红溶液 ②酸性溶液 ③溴水 ④滴有酚酞的溶液
A.①④ B.①② C.②③ D.③④
4.硫酸能在金星的上层大气中找到,离星球表面约45~70公里的硫酸云层覆盖整个金星表面。下列叙述正确的是
A.浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体
B.浓硫酸与单质硫反应的化学方程式为,在此反应中,浓硫酸既表现了强氧化性又表现了酸性
C.常温下能够用铁、铝等容器盛放浓,是因为浓的强氧化性使铁、铝钝化
D.浓硫酸具有吸水性,因而能使蔗糖碳化
5.在汽车尾气净化装置中,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法不正确的是
A.该反应为固氮反应之一
B.NO为无色气体,为红棕色气体
C.NO、CO均能与人体中的血红蛋白结合
D.该催化转化的总反应的化学方程式为
6.某同学进行如图所示实验:先在培养皿中央的固体上滴几滴浓氨水,立即用一个表面皿扣在上面。下列对实验现象与解释不正确的是
选项 实验现象 解释
A 浓盐酸附近产生白烟 与反应生成固体
B 浓硫酸附近无白烟 浓硫酸无挥发性,但可以吸收氨气
C 湿润的蓝色石蕊试纸变红 与水反应生成的显碱性
D 溶液变浑浊 反应生成沉淀
A.A B.B C.C D.D
7.用以下三种途径来制取相同质量的硝酸铜:①铜跟浓硝酸反应;②铜跟稀硝酸反应;③铜跟氧气反应生成氧化铜,氧化铜再跟稀硝酸反应。以下叙述正确的是
A.三种途径所消耗的铜的物质的量不相等
B.三种途径所消耗的硝酸的物质的量相等
C.所消耗铜的物质的量:途径③>途径①>途径②
D.所消耗硝酸的物质的量:途径①>途径②>途径③
8.硅是带来人类文明的重要元素之一,科学家也提出硅是“21世纪的能源”。这主要是由于硅及其化合物对社会发展所起的巨大促进作用。下列关于硅及其化合物的说法中错误的是
A.传统无机非金属材料是指玻璃、水泥、陶瓷等硅酸盐材料
B.传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐
C.硅的导电性能介于导体和绝缘体之间,是良好的半导体材料。
D.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
9.已知某化学反应(、、的结构式分别为、、),反应过程中的能量变化如图所示,下列有关叙述正确的是
A.该反应的进行一定需要加热或点燃才能进行
B.该反应若生成,则放出的热量为
C.该反应断开反应物中化学键吸收的总能量大于形成生成物中化学键释放的总能量
D.反应的能量变化跟上图相似
10.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
①两烧杯中铜片表面均无气泡产生
②甲中铜片是正极,乙中铜片是负极
③两烧杯中溶液的c(H+)均减小
④产生气泡的速率甲比乙慢
⑤甲中SO42-向Zn片移动,H+向Cu片移动
⑥乙中电流从Cu片流向Zn片
⑦甲乙两烧杯中Cu片的质量均不变
A.①②③ B.③⑤⑦
C.④⑤⑥ D.②③④⑤⑦
11.X、Y、Z、W四种金属片在稀盐酸中,用导线连接,可以组成原电池,实验结果如图所示:则四种金属的活泼性由强到弱的顺序为
A.Z>Y>X>W B.Z>X>Y>W C.Z>Y>W>X D.Y>Z>X>W
12.某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e--=4OH--
C.每转移0.1mol电子,消耗1.12L的H2
D.H+由a极通过固体酸电解质传递到b极
13.对于反应,下列反应速率的关系正确的是
A. B.
C. D.
14.在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8mol/L和5.4mol/L,在一定条件下发生N2+ 3H2= 2NH3,10min后测得N2的浓度是0.8mol/L,则在这10min内N2的平均反应速率是( )
A.0.2mol/(L·min) B.0.3 mol/(L·min)
C.0.1 mol/(L·min) D.0.6 mol/(L·min)
15.为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A~D四个实验,你认为结论不正确的是
A.在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快
B.将相同大小、形状的镁条和铝条分别与相同浓度的盐酸反应时,铝条反应快
C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解
D.两支试管中分别加入相同浓度相同体积的双氧水,其中一支试管中再加入几滴氯化铁溶液,产生氧气的快慢不同
16.下列装置所示的实验中,能达到实验目的的是
图1 图2 图3 图4
A.图1分离碘酒中的碘和酒精 B.图2实验室制氨气
C.图3除去Cl2中的HCl D.图4排水集气法收集NO
第Ⅱ卷 (非选择题共52分)
17.按要求填空
向盛有等量铜片的四支试管中分别加入等体积的①浓硫酸;②稀硫酸;③浓硝酸;④稀硝酸,能随即发生反应的是(填序号,下同) ,微热则发生反应的是 ,加热后发生反应的是 ,加热也不发生反应的是 。由此可以得到上述四种酸氧化性由强到弱的顺序是 (填序号)。写出Cu与浓硫酸反应的化学方程式 。
18.下图是甲、乙两位同学探究铜与稀硝酸反应还原产物的实验装置图,请回答下列问题:
(1)写出铜和稀硝酸反应的离子方程式: 。
(2)实验装置甲能否证明铜和稀硝酸反应的产物是NO气体 (填“能”或“不能”),请简述理由(用文字和化学方程式表示):
(3)若用实验装置乙进行实验,该装置的优点是 。
19.已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置可以实现该反应。
回答下列问题:
(1)A中加入的物质是 ,发生反应的化学方程式是 ;
(2)B中加入的物质是 ,其作用是 ;
(3)实验时在C中观察到的现象是 。发生反应的化学方程式是 ;
(4)D中收集到的物质是 ,检验该物质的方法和现象是 。
20.根据原电池原理,结合装置图,按要求解答问题:
(1)若X为Zn,Y为硫酸铜溶液,则X为 (填电极名称),溶液中的移向 (填“Cu”或“X”)电极。该电池所发生的离子反应为
(2)若X为银,Y为硝酸银溶液,则X为 (填电极名称),溶液中的移向 (填“Cu”或“X”)电极。X电极上的电极反应式为 。
(3)若X为石墨,Y为稀硝酸溶液,则X为 (填电极名称),Cu电极上发生 反应(填氧化或还原)。X电极上的电极反应式为 。
21.把在空气中久置的铝片5.0g投入盛有盐酸溶液的烧杯中,该铝片与盐酸反应产生氢气的速率与反应时间的关系可用下图所示的坐标曲线来表示,回答下列问题:
(1)曲线段不产生氢气的原因是因为表面形成致密的氧化膜,写出离子方程式为 ;
(2)曲线b→c段产生氢气的速率增加较快的主要原因是 ;
(3)曲线C以后的速率下降的主要原因 。
(4)若反应进行了10s,收集标况下的氢气的体积为1.12L,用盐酸表示该反应的速率为 。
(5)向溶液中加入少量的Cu,也能加快上述化学反应速率的原因 。
1.C
【详解】A.高纯硅为良好的半导体材料,是制造芯片的材料,故A正确;
B.二氧化硅具有良好的导光性,是制造光导纤维主要原料,故B正确;
C.锂电池可进行充放电,属于二次电池,故C错误;
D.燃油汽车尾气中含有大量氮氧化物,能引起光化学烟雾,新能源汽车的推广与使用可以减少燃油汽车尾气排放,有助于减少光化学烟雾的产生,故D正确;
故答案选C。
2.B
【详解】A.由图可知,火山喷发、森林火灾会产生,A正确;
B.含硫燃料燃烧生成二氧化硫、排放到空气中的二氧化硫与氧气反应生成三氧化硫、三氧化硫与水反应生成硫酸;二氧化硫也可以和水分反应生成亚硫酸、亚硫酸被氧气氧化成为硫酸, B不正确;
C. 二氧化硫会引起酸雨,故工厂产生的烟气应经脱硫处理后再排放,可减少酸雨的产生,C正确;
D. 硫在自然界中,有化合态形式存在,例如硫化物、硫酸盐等,也有游离态形式存在,以单质硫存在于火山喷发口附近,D正确;
答案选B。
3.C
【详解】①二氧化硫具有漂白性,能使品红溶液褪色;
②二氧化硫具有还原性,能与酸性高锰酸钾溶液发生氧化还原反应,使酸性高锰酸钾溶液褪色;
③二氧化硫具有还原性,能与溴水发生氧化还原反应,使溴水褪色;
④二氧化硫是酸性氧化物,能与滴有酚酞的氢氧化钠溶液反应使溶液褪色;
由以上分析可知,②③褪色的实质相同;
故选C。
4.C
【详解】A. 浓硫酸能与氨气反应,不能够干燥氨气,A错误;
B. 浓硫酸与单质硫反应的化学方程式为中,浓硫酸中S化合价全部降低,只表现了强氧化性,B错误;
C.浓的强氧化性使铁、铝钝化,故常温下能够用铁、铝等容器盛放浓, C正确;
D. 浓硫酸使蔗糖碳化体现其脱水性, D错误;
答案选C。
5.A
【详解】A. 氮的固定是游离态氮元素变化为化合态氮元素,该反应为含氮化合物转变为氮气,不属于固氮反应,A错误;
B. 通常,NO为无色气体、为红棕色气体,B正确;
C. NO、CO均能与人体中的血红蛋白结合,超过一定量的NO、CO均能使人中毒,C正确;
D. 由图、结合电子数守恒、元素质量守恒可知,该催化转化的总反应的化学方程式为,D正确;
答案选A。
6.C
【分析】在培养皿中央的固体上滴几滴浓氨水,立即产生氨气。
【详解】A.氨气与挥发性酸盐酸反应生成白色固体氯化铵,现象产生大量白烟,故A正确;
B.浓硫酸虽然难挥发,但是氨气与浓硫酸二者可以反应生成硫酸铵,故现象为:浓硫酸附近无白烟,故B正确;
C.氨气与水反应生成一水合氨,一水合氨电离产生氢氧根离子,溶液显碱性,所以应该是湿润的红色石蕊试纸变蓝,故C错误;
D.氨气与硫酸镁溶液反应生成硫酸铵和氢氧化镁沉淀,故现象是硫酸镁溶液变浑浊,故D正确;
故选C。
7.D
【分析】根据题意,有关反应为:①Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;②3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;③2Cu+O22CuO,CuO+2HNO3(稀)=Cu(NO3)2+H2O,由以上三组反应,可以看出:生成相同质量的Cu(NO3)2,消耗相同质量的铜,但消耗硝酸的质量(或物质的量)不相同,途径①消耗HNO3最多,途径②次之,途径③消耗HNO3最少。通过比较可以看出,生产Cu(NO3)2,途径③效果最佳,既不造成污染,又能提高HNO3的利用,以此来解答。
【详解】A.根据原子守恒,铜单质最终转化为硝酸铜,则三种途径制取相同质量的硝酸铜,所消耗的铜的物质的量相等,故A错误;
B.由分析可知,三种途径耗相同质量的铜,但消耗硝酸的质量(或物质的量)不相同,途径①消耗HNO3最多,途径②次之,途径③消耗HNO3最少,故B错误;
C.根据A项分析可知,三种途径消耗铜的质量相等,则所消耗铜的物质的量也相等:途径①=途径②=途径③,故C错误;
D.根据分析可知,耗硝酸的质量(或物质的量)不相同,途径①消耗HNO3最多,途径②次之,途径③消耗HNO3最少,则所消耗硝酸的物质的量:途径①>途径②>途径③,故D正确;
答案选D。
8.B
【详解】A.玻璃、水泥、陶瓷等硅酸盐材料是传统的无机非金属材料,A正确;
B.新型无机非金属材料的主要成分不是硅酸盐,例如高温结构陶瓷的成分可以是氮化硅、光导纤维的成分是二氧化硅等,B不正确;
C. 硅是良好的半导体材料,其导电性能介于导体和绝缘体之间, C正确;
D. 高纯度的二氧化硅广泛用于制作光导纤维,二氧化硅是酸性氧化物,能与氢氧化钠等强碱反应生成可溶性盐,故光导纤维遇强碱会“断路” ,D正确;
答案选B。
9.C
【详解】A.ΔH>0,ΔS<0,反应为吸热反应,吸热反应不一定需要加热或点燃的条件,例如:氢氧化钡和氯化铵在常温下就可以进行,A错误;
B.该反应若生成,则吸收的热量为,B错误;
C.该反应断开反应物中化学键吸收的总能量大于形成生成物中化学键释放的总能量,C正确;
D.为放热反应,反应的能量变化跟上图不相似,D错误;
故选AC。
10.B
【分析】甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑;乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此解答该题。
【详解】①甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故错误;
②乙没有形成原电池反应,没有正负极,故错误;
③两烧杯中的氢离子发生反应,c(H+)减少,故正确;
④甲能形成原电池,乙不能构成原电池,所以产生气泡的速度甲比乙快,故错误;
⑤甲为原电池,锌为负极,铜为正极,阴离子向负极移动,阳离子向正极移动,故正确;
⑥乙没有形成原电池,没有电流产生,故错误;
⑦甲中Cu为正极,质量不变,乙中铜与氢离子不反应,质量不变,故正确;
故选B。
11.A
【解析】形成原电池时,较为活泼的金属为负极,较不活泼的金属为正极,负极发生氧化反应,正极发生还原反应,可生成金属、气体等,结合两极反应的现象进行判断。
【详解】甲中Z、Y组合时,Z为负极,则活泼性Z>Y;
乙中X、Y组合时,X电极上有气泡,则X为正极,则活泼性Y>X;
丙中Z、W组合时,电子从Z流向W,则Z为负极,则活泼性Z>W;
丁中X、W组合时,W上发生还原反应,说明W为正极,活泼性X>W;
因此活泼性Z>Y>X>W,故选A。
12.D
【详解】A.燃料电池中,通入燃料氢气的电极是负极,则a是负极,通入氧化剂的电极b是正极,电子从负极a沿导线流向正极b,A错误;
B.b是正极,电极反应式为O2+4e-+4H+=2H2O,B错误;
C.温度和压强未知,导致气体摩尔体积未知,所以无法计算氢气体积,C错误;
D.放电时,a是负极、b是正极,阳离子氢离子从负极a通过固体酸电解质传递到b极,D正确,答案选选D。
13.D
【分析】在同一时间段,用不同物质表示反应速率时,速率比等于化学方程式中相应物质的化学计量数的比,据此分析判断。
【详解】A.v(NH3):v(O2)=4:5,所以v(O2)=v(NH3),A错误;
B.v(O2):v(H2O)=5:6,所以v(H2O)=v(O2),B错误;
C.v(NH3):v(H2O)=4:6,所以v(H2O)=v(NH3),C错误;
D.v(NO):v(O2)=4:5,所以v(NO)=v(O2),D正确;
故合理选项是D。
14.C
【详解】10min内N2浓度的变化量为△c(N2)=(1.8-0.8)mol/L=1.0mol/L,则这段时间内用氮气表示的平均反应速率v(N2)== =0.1 mol L-1 min-1,故选C。
15.B
【详解】A.其它条件相同,只有CaCO3固体表面积不同,反应速率不同,说明在相同条件下,固体表面积越大,反应速率越快,A结论合理;
B.Mg、Al两种不同的金属与同浓度的盐酸反应,两种反应速率不同,说明金属活动性不同,反应速率不变,即参加反应的物质本身的性质影响化学反应速率,镁活泼性大于铝,镁条反应快,B结论不合理;
C.同一浓度的浓硝酸在光照时分解速率大于在暗处的分解速率,说明光照可以加快浓硝酸的分解速率,C结论合理;
D.相同浓度相同体积的双氧水中,加入氯化铁溶液的反应产生氧气的速率大于未滴加氯化铁溶液的速率,说明氯化铁是双氧水分解的催化剂,可加快反应速率,D结论合理;
故选:B。
16.D
【详解】A. 碘易溶于酒精,不能用分液法分离碘酒中的碘和酒精, A错误;
B. 实验室不能通过氯化铵分解制氨气,因为氯化铵受热分解生成的氨气和氯化氢会重新化合成氯化铵,应通过加热熟石灰和氯化铵固体的混合物制取氨气,熟石灰与氯化铵共热反应生成氯化钙、氨气和水,B错误;
C. NaOH既能与HCl反应,也能与Cl2反应,所以不能用NaOH溶液除去氯气中的HCl,C错误;
D. NO难溶于水,可用排水法收集,D正确;
答案选D。
17. ③ ④ ① ② ③④①②
【分析】浓硝酸和铜常温下可以直接反应,稀硝酸需要微热,浓硫酸与铜加热情况下也可以发生反应,稀硫酸与铜加热也不反应;氧化性强弱和反应的难易程度有关,故顺序为③④①②,铜和浓硫酸反应生成硫酸铜、水和二氧化硫。
【详解】浓硝酸和铜常温下可以直接反应,故填③;稀硝酸需要微热,故填④;浓硫酸与铜加热情况下也可以发生反应,故填①;稀硫酸与铜加热也不反应,故填②;氧化性强弱和反应的难易程度有关,故顺序为③④①②;铜和浓硫酸反应生成硫酸铜、水和二氧化硫,故答案为:。
18.(1)
(2) 不能 NO极易被空气中的氧气氧化为NO2,无法证明。
(3)稀硝酸与铜片产生的气体直接产生的NO与空气不接触,不易被氧气氧化。
【分析】甲图为铜和稀硝酸反应生成NO,圆底烧瓶中有大量空气,NO极易被氧化为NO2,NO2与水反应生成NO,乙图中整个U型管中充满稀硝酸,防止产生的NO被氧化。
【详解】(1)铜和稀硝酸反应的离子方程式:。
(2)不能;NO极易被空气中的氧气氧化为NO2,无法证明。
(3)乙图中整个U型管中充满稀硝酸,防止产生的NO被氧化。
19.(1) NH4Cl、Ca(OH)2 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(2) 碱石灰(或固体CaO或固体NaOH) 除去NH3气流中的水蒸气(或干燥NH3)
(3) 黑色粉末逐渐变为红色 2NH3+3CuON2+3H2O+3Cu
(4) 氨水 可用用红色石蕊试纸检验,试纸变蓝,用无水硫酸铜检验,无水硫酸铜变蓝
【分析】装置A中,NH4Cl与Ca(OH)2在加热条件下反应制取NH3;装置B中碱石灰等用于吸收NH3中的水蒸气;装置C用于进行NH3还原CuO的实验;装置D用于冷凝水蒸气,并收集到氨水;装置E用于收集N2。
【详解】(1)装置A中加入的物质为NH4Cl与Ca(OH)2,在加热条件下发生反应生成氨气等,化学方程式是2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O。
(2)B中药品用于干燥氨气,加入的物质是碱石灰(或固体CaO或固体NaOH),其作用是:除去NH3气流中的水汽(或干燥NH3)。
(3)装置C中,进行NH3还原CuO的实验,此时CuO部分被还原为Cu,实验时在C中观察到的现象是:黑色粉末部分逐渐变为红色,发生反应的化学方程式是:2NH3+3CuON2+3H2O+3Cu。
(4)实验时生成的水蒸气在D中液化,同时未反应的NH3溶解在液化的水中形成氨水,故D中收集到的物质是氨水;氨水具有碱性,能使红色石蕊试纸变蓝,水会使无水硫酸铜变蓝,故检验该物质时,可用红色石蕊试纸检验,试纸变蓝,用无水硫酸铜检验,无水硫酸铜变蓝。
20.(1) 负极 Cu Zn+Cu2+=Zn2++Cu
(2) 正极 X Ag++e-= Ag
(3) 正极 氧化
【分析】原电池中活泼金属为负极,失去电子发生氧化反应,不活泼金属或者非金属为正极,发生还原反应,原电池工作时,阳离子移向正极,阴离子移向负极。
【详解】(1)若X为Zn,形成了Zn-Cu-CuSO4溶液原电池,Zn是活泼金属为负极,Cu是不活泼金属为正极,Cu2+离子向正极Cu一边移动,总反应的离子方程式为Zn+Cu2+=Zn2++Cu;
(2)若X为Ag,形成了Cu-Ag-AgNO3溶液的原电池,与Ag相比,Cu是活泼金属为负极,Ag为正极,Ag+离子向正极Ag一边移动,正极上发生还原反应,Ag+离子变成Ag单质,电极反应式为Ag++e-= Ag;
(3)X为石墨,形成了Cu-C-HNO3溶液原电池,Cu是活泼金属为负极,C是非金属为正极,负极Cu电极发生氧化反应,正极上是硝酸根离子得电子生成NO,电极反应式为:。
21.(1)。
(2)Al与HCl反应为放热反应,溶液温度升高,化学反应速率加快。
(3)盐酸浓度下降,导致化学反应速率下降。
(4)0.02mol/L-1·s-1。
(5)构成了Al-HCl-Cu原电池,加快了反应速率。
【分析】把在空气中久置的铝片5.0g投入盛有盐酸溶液的烧杯中,反应开始时,氧化铝和盐酸反应生成水,无气体产生,之后铝和盐酸反应,盐酸浓度逐渐下降,反应速率上升,考虑铝与盐酸反应放热,溶液温度升高,反应速率加快,之后反应速率下降,考虑盐酸浓度下降过多之后反应速率主要和浓度相关,反应速率根据氢气的物质的量是盐酸的一般列式进行计算,加入少量的Cu,形成Al-HCl-Cu原电池,原电池可以加快化学反应速率。
【详解】(1)反应开始时,氧化铝和盐酸反应生成水,无气体产生,故答案为:。
(2)铝和盐酸反应,盐酸浓度逐渐下降,反应速率上升,考虑铝与盐酸反应放热,溶液温度升高,反应速率加快。
(3)反应速率下降段,考虑盐酸浓度下降过多之后反应速率主要和浓度相关,盐酸浓度下降,反应速率下降。
(4)反应速率根据氢气的物质的量是盐酸的一般列式进行计算,设反应的盐酸物质的量为Δn,则有:
(5)加入少量的Cu,形成Al-HCl-Cu原电池,原电池可以加快化学反应速率。
同课章节目录
