2.3离子反应 课件(共50张PPT)高中化学苏教版必修第一册 专题三
文档属性
| 名称 | 2.3离子反应 课件(共50张PPT)高中化学苏教版必修第一册 专题三 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-27 23:29:18 | ||
图片预览









文档简介
(共50张PPT)
第二单元 金属钠及钠的化合物
第3课时 离子反应
课标定位素养阐释
1.能通过实验探究理解强、弱电解质的概念。
2.能够掌握书写电离方程式的方法。
3.能通过微观视角认识离子反应实质及其发生的条件。
4.能够书写离子方程式并能进行正误判断。
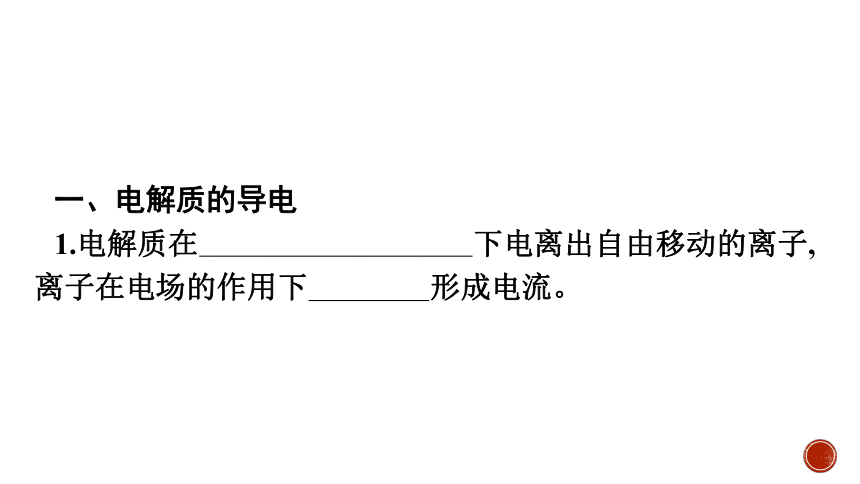
一、电解质的导电
1.电解质在水溶液里或熔融状态下电离出自由移动的离子,离子在电场的作用下定向移动形成电流。
2.电解质溶液导电能力的影响因素。
电解质溶液的导电能力与溶液中自由移动的离子浓度及离子所带电荷多少有关,离子浓度越大,离子所带电荷越多,导电能力越强。
判断电解质是否导电,首先要看电解质是否发生电离产生了自由移动的离子,还要看电离产生的离子浓度的大小,如CaCO3在水中的溶解度很小,溶于水电离产生的离子浓度很小,故认为其水溶液不导电。
二、电解质与电离方程式
1.强电解质。
(1)定义:在水溶液中能完全电离的电解质。
(2)常见强电解质。
①强酸:H2SO4、HCl、HNO3等。
②强碱:NaOH、KOH等。
③绝大多数盐。
(3)电离方程式。
2.弱电解质。
(1)定义:在水溶液中不能完全电离的电解质。
(2)常见弱电解质。
①弱酸:CH3COOH、H2CO3等。
②弱碱:NH3·H2O等。
(3)电离方程式。
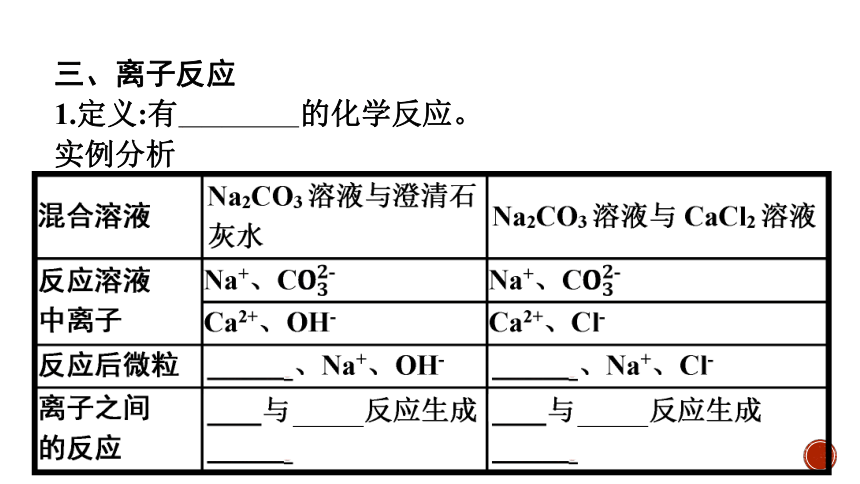
三、离子反应
1.定义:有离子参加的化学反应。
实例分析
离子反应的实质:溶液中部分离子的浓度减小。
2.离子方程式。
(1)定义:用实际参加反应的离子符号来表示反应的式子。
(2)书写步骤:以碳酸钠溶液与盐酸反应为例。
①写:写出反应的化学方程式。
Na2CO3+2HCl══2NaCl+CO2↑+H2O。
②拆:把溶于水且完全电离的物质写成离子形式,难溶于水或溶于水但难电离的物质仍用化学式表示。
③删:删去化学方程式两边不参加反应的离子。
④查:检查离子方程式两边各元素的原子数目和离子所带的电荷总数是否相等。
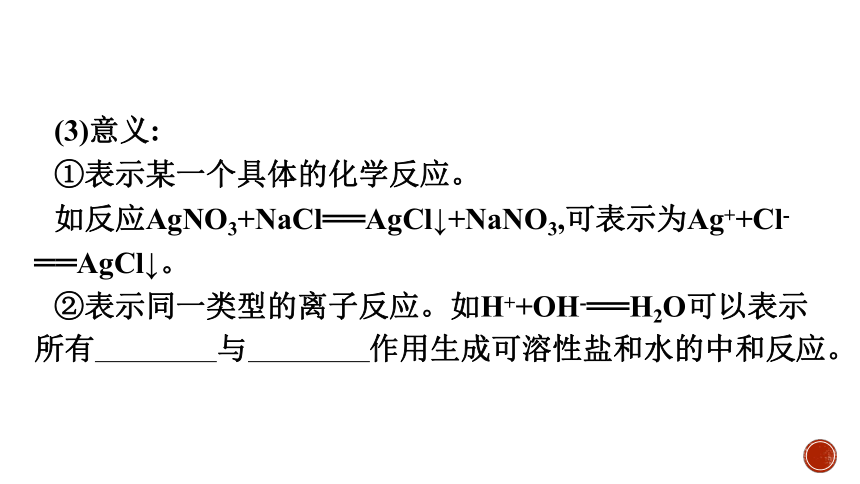
(3)意义:
①表示某一个具体的化学反应。
如反应AgNO3+NaCl══AgCl↓+NaNO3,可表示为Ag++Cl-══AgCl↓。
②表示同一类型的离子反应。如H++OH-══H2O可以表示所有强酸溶液与强碱溶液作用生成可溶性盐和水的中和反应。
【自主思考1】 按如图装置做实验,比较1.0 mol·L-1的盐酸和1.0 mol·L-1的醋酸溶液导电性有什么差异 为什么有这种差异
提示:实验表明,一定体积的1.0 mol·L-1的盐酸比同体积同浓度的醋酸溶液导电性强。这是因为氯化氢在水中完全电离,而醋酸在水中只有部分电离。因此相同体积的1.0 mol·L-1的盐酸和醋酸溶液所含有的H+的浓度不同,所以两种溶液的导电能力不一样。
【自主思考2】 参加离子反应的所有物质都是电解质吗 离子反应一定是离子与离子之间的反应吗
提示:不一定;如Zn与稀硫酸的反应(Zn+2H+══Zn2++H2↑)并不是离子与离子之间的反应,且Zn不是电解质。
【效果自测】
1.下列物质的电离方程式书写错误的是( )。
答案:C
解析:根据电解质的化学式,可把其拆写成阳离子和阴离子,C项的电离方程式应为Fe2(SO4)3══2Fe3++3 。
2.将以下4份溶液分别置于如图的装置中,其他条件相同时,灯泡最亮的是( )。
A.100 mL 1 mol·L-1的盐酸
B.100 mL 2 mol·L-1的蔗糖溶液
C.100 mL 1 mol·L-1的食盐水
D.30 mL 1 mol·L-1的CaCl2溶液
答案:D
解析:电解质溶液中离子浓度越大,离子所带电荷数越多,溶液导电能力越强,1 mol·L-1盐酸中c(H+)、c(Cl-)均为1 mol·L-1,
1 mol·L-1食盐水中c(Na+)、c(Cl-)均为1 mol·L-1,1 mol·L-1 CaCl2溶液中c(Ca2+)=1 mol·L-1,c(Cl-)=2 mol·L-1,即CaCl2溶液中离子浓度最大。
3.下列不能发生离子反应的是( )。
A.NaCl溶液与AgNO3溶液 B.KNO3溶液与NaOH溶液
C.稀硫酸与BaCl2溶液 D.盐酸与Na2CO3溶液
答案:B
解析:A项,NaCl电离出的Cl-与AgNO3电离出的Ag+反应生成AgCl沉淀;C项,硫酸电离出的 与BaCl2电离出的Ba2+反应生成BaSO4沉淀;D项,盐酸中的H+与Na2CO3电离出的 反应生成H2CO3,H2CO3分解生成CO2和H2O。
4.下列化学反应的离子方程式错误的是( )。
答案:D
解析:D项中因碳酸钙为不溶于水的固体,应写化学式,正确的离子方程式为CaCO3+2H+══Ca2++CO2↑+H2O。
问题引领
1.书写离子方程式时把CaCO3拆写成Ca2+和 正确吗 为什么
提示:不正确。原因是CaCO3难溶于水。
2.AgNO3溶液与Cu反应的离子方程式写成Cu+Ag+══Ag+Cu2+正确吗 为什么
提示:不正确。因为离子方程式两边电荷不守恒。
探究任务1 离子方程式的书写方法
归纳提升
离子方程式的书写与正误判断
1.离子反应的实质。
通过离子反应使溶液中某些离子浓度减小。
2.常见离子反应的类型。
(1)复分解反应型。
(2)氧化还原反应型。
①如Zn+2H+══Zn2++H2↑,还原性Zn>H2;
②如Cl2+2Br-══2Cl-+Br2,氧化性Cl2>Br2。
3.书写离子方程式的拆分原则。
(1)能拆写成离子的物质。
(2)不能拆写成离子的物质。
(3)微溶物作为反应物,若是澄清溶液写离子符号,若是悬浊液写化学式。微溶物作为生成物,一般写化学式(标“↓”),如石灰水和石灰乳:石灰水写成离子形式,而石灰乳则写化学式。
(4)氨水作反应物可写作NH3·H2O;作生成物,若有加热条件或浓度很大时,可写作NH3(标“↑”)。
(5)固体之间反应不能写离子方程式,如氯化铵与氢氧化钙的反应。
(6)多元弱酸的酸式酸根离子,在离子方程式中不能拆开写,如NaHCO3与盐酸反应的离子方程式为 +H+══ CO2↑+H2O。
4.判断离子方程式正误的方法。
典型例题
【例题1】 能正确表达下列反应的离子方程式为( )。
D
解析:醋酸是弱酸不能拆写成离子,正确的离子方程式为2CH3COOH+CaCO3══2CH3COO-+Ca2++CO2↑+H2O,A项错误;离子所带电荷不守恒,B项错误;盐酸是完全电离的,MnO2+4H++2Cl- Mn2++Cl2↑+2H2O,C项错误;Cl2与OH-发生歧化反应,D项正确。
【例题2】 离子方程式H++OH-══H2O所表示的反应是
( )。
A.所有酸与碱之间的中和反应
B.所有强酸与强碱之间的中和反应
C.所有可溶性酸与可溶性碱的反应
D.强酸与强碱生成可溶性盐和水的反应
答案:D
解析:离子方程式H++OH-══H2O,反应物用H+、OH-表示,说明反应物为强酸和强碱,离子方程式中生成物只有H2O,说明生成的盐为可溶性盐,D项正确。
【变式训练1】 写出下列反应的离子方程式。
(1)氢氧化钠溶液与稀硫酸反应: ;
(2)氯化钠溶液与硝酸银溶液反应: ;
(3)氢氧化钡溶液与稀硫酸反应: ;
(4)铁与硫酸铜溶液反应: ;
(5)碳酸钠溶液与氢氧化钙溶液反应: ;
(6)铁与稀盐酸反应: ;
(7)碳酸钠溶液与稀硫酸反应: 。
【变式训练2】 (双选)能正确表示下列化学反应的离子方程式的是( )。
A.澄清的石灰水与盐酸的反应OH-+H+══H2O
B.氧化镁与稀硝酸反应O2-+2H+══H2O
D.碳酸钙溶于稀盐酸中CaCO3+2H+══H2O+CO2↑+Ca2+
答案:AD
解析:单质、氧化物、难溶于水的物质、难电离的物质不能写成离子形式,B项错误;C项还生成氢氧化镁沉淀。
问题引领
1.某河道两旁有甲、乙两厂,它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、 六种离子。甲厂的废水呈碱性,那么甲、乙两厂废水中各含哪三种离子
探究任务2 判断离子能否大量共存
提示:甲厂的废水呈碱性,即含OH-,而Ag+、Fe3+与OH-不能共存,故Ag+、Fe3+只能在乙厂废水中。由于Cl-与Ag+不共存,故Cl-在甲厂中,依电荷守恒,甲厂废水中不能只含阴离子,还必须含有阳离子,这种阳离子只能为K+(因为阳离子中只剩K+可供选择)。所以甲厂废水中含OH-、Cl-、K+,乙厂废水中含Ag+、Fe3+、 。
2.离子间不共存(即发生反应)的条件有哪些
提示:离子间反应产生难溶的物质(沉淀)、难电离的物质(如H2O)或挥发性的物质(气体),则不共存。
归纳提升
离子共存
判断离子能否大量共存实际上是看离子之间能否反应,若反应,则不能大量共存;若不反应,则能大量共存。
1.离子不能大量共存的三种情况。
(1)生成难溶性或微溶性物质的离子不能大量共存。
②生成难溶性的碱:如OH-与Cu2+、Fe2+、Fe3+、Mg2+等。
(3)生成水或其他难电离物质的离子不能大量共存:如H+与OH-、CH3COO-,OH-与 等。
2.注意事项——“隐含条件”。
(1)“无色透明”溶液中不存在有色离子,如:
Cu2+ Fe3+ Fe2+
| | | |
蓝色 棕黄色 浅绿色 紫红色
(2)酸性溶液中不能大量存在与H+反应的离子。
“酸性”溶液的不同描述:①酸性溶液。②常温下pH<7的溶液。③使石蕊试液变红色的溶液。
(3)碱性溶液中不能大量存在与OH-反应的离子。
“碱性”溶液的不同描述:①碱性溶液。②常温下pH>7的溶液。③使石蕊试液变蓝的溶液。
3.解答离子共存题的常见思路。
(1)看是否有隐含限制条件,如碱性、酸性、无色等。这些问题较易忽视,故放在第一步。
(2)看能否发生复分解反应。可分三步进行:
①查H+,主要看是否有弱酸根离子和酸式酸根离子等;
②查OH-,主要看是否有 、酸式酸根离子和金属离子等;
③查金属离子,主要看是否与酸根产生难溶性盐(包括微溶性盐)。
典型例题
【例题3】 在强酸性溶液中能大量共存并且溶液为无色透明的离子组是( )。
答案:B
【例题4】 某电解质溶液中,可能大量存在有Ag+、H+、Cu2+、 、OH-、Cl-,当向该溶液中加入酚酞试剂,溶液变红。则:
该溶液中一定能大量存在的离子是 ;一定不能大量存在的离子是 ;还需要进一步确认的离子是 。
解析:加入酚酞试剂变红,说明该溶液呈碱性,所以OH-一定存在,OH-存在则一定不能大量存在Ag+、H+、Cu2+三种离子,因为这三种离子与OH-能发生反应。只根据题给条件无法确定 和Cl-是否存在,所以需要进一步确认。
【变式训练3】 (双选)在下列各溶液中,离子一定能大量共存的是( )。
答案:CD
【变式训练4】 下列各组离子能在溶液中大量共存的是
( )。
答案:D
第二单元 金属钠及钠的化合物
第3课时 离子反应
课标定位素养阐释
1.能通过实验探究理解强、弱电解质的概念。
2.能够掌握书写电离方程式的方法。
3.能通过微观视角认识离子反应实质及其发生的条件。
4.能够书写离子方程式并能进行正误判断。
一、电解质的导电
1.电解质在水溶液里或熔融状态下电离出自由移动的离子,离子在电场的作用下定向移动形成电流。
2.电解质溶液导电能力的影响因素。
电解质溶液的导电能力与溶液中自由移动的离子浓度及离子所带电荷多少有关,离子浓度越大,离子所带电荷越多,导电能力越强。
判断电解质是否导电,首先要看电解质是否发生电离产生了自由移动的离子,还要看电离产生的离子浓度的大小,如CaCO3在水中的溶解度很小,溶于水电离产生的离子浓度很小,故认为其水溶液不导电。
二、电解质与电离方程式
1.强电解质。
(1)定义:在水溶液中能完全电离的电解质。
(2)常见强电解质。
①强酸:H2SO4、HCl、HNO3等。
②强碱:NaOH、KOH等。
③绝大多数盐。
(3)电离方程式。
2.弱电解质。
(1)定义:在水溶液中不能完全电离的电解质。
(2)常见弱电解质。
①弱酸:CH3COOH、H2CO3等。
②弱碱:NH3·H2O等。
(3)电离方程式。
三、离子反应
1.定义:有离子参加的化学反应。
实例分析
离子反应的实质:溶液中部分离子的浓度减小。
2.离子方程式。
(1)定义:用实际参加反应的离子符号来表示反应的式子。
(2)书写步骤:以碳酸钠溶液与盐酸反应为例。
①写:写出反应的化学方程式。
Na2CO3+2HCl══2NaCl+CO2↑+H2O。
②拆:把溶于水且完全电离的物质写成离子形式,难溶于水或溶于水但难电离的物质仍用化学式表示。
③删:删去化学方程式两边不参加反应的离子。
④查:检查离子方程式两边各元素的原子数目和离子所带的电荷总数是否相等。
(3)意义:
①表示某一个具体的化学反应。
如反应AgNO3+NaCl══AgCl↓+NaNO3,可表示为Ag++Cl-══AgCl↓。
②表示同一类型的离子反应。如H++OH-══H2O可以表示所有强酸溶液与强碱溶液作用生成可溶性盐和水的中和反应。
【自主思考1】 按如图装置做实验,比较1.0 mol·L-1的盐酸和1.0 mol·L-1的醋酸溶液导电性有什么差异 为什么有这种差异
提示:实验表明,一定体积的1.0 mol·L-1的盐酸比同体积同浓度的醋酸溶液导电性强。这是因为氯化氢在水中完全电离,而醋酸在水中只有部分电离。因此相同体积的1.0 mol·L-1的盐酸和醋酸溶液所含有的H+的浓度不同,所以两种溶液的导电能力不一样。
【自主思考2】 参加离子反应的所有物质都是电解质吗 离子反应一定是离子与离子之间的反应吗
提示:不一定;如Zn与稀硫酸的反应(Zn+2H+══Zn2++H2↑)并不是离子与离子之间的反应,且Zn不是电解质。
【效果自测】
1.下列物质的电离方程式书写错误的是( )。
答案:C
解析:根据电解质的化学式,可把其拆写成阳离子和阴离子,C项的电离方程式应为Fe2(SO4)3══2Fe3++3 。
2.将以下4份溶液分别置于如图的装置中,其他条件相同时,灯泡最亮的是( )。
A.100 mL 1 mol·L-1的盐酸
B.100 mL 2 mol·L-1的蔗糖溶液
C.100 mL 1 mol·L-1的食盐水
D.30 mL 1 mol·L-1的CaCl2溶液
答案:D
解析:电解质溶液中离子浓度越大,离子所带电荷数越多,溶液导电能力越强,1 mol·L-1盐酸中c(H+)、c(Cl-)均为1 mol·L-1,
1 mol·L-1食盐水中c(Na+)、c(Cl-)均为1 mol·L-1,1 mol·L-1 CaCl2溶液中c(Ca2+)=1 mol·L-1,c(Cl-)=2 mol·L-1,即CaCl2溶液中离子浓度最大。
3.下列不能发生离子反应的是( )。
A.NaCl溶液与AgNO3溶液 B.KNO3溶液与NaOH溶液
C.稀硫酸与BaCl2溶液 D.盐酸与Na2CO3溶液
答案:B
解析:A项,NaCl电离出的Cl-与AgNO3电离出的Ag+反应生成AgCl沉淀;C项,硫酸电离出的 与BaCl2电离出的Ba2+反应生成BaSO4沉淀;D项,盐酸中的H+与Na2CO3电离出的 反应生成H2CO3,H2CO3分解生成CO2和H2O。
4.下列化学反应的离子方程式错误的是( )。
答案:D
解析:D项中因碳酸钙为不溶于水的固体,应写化学式,正确的离子方程式为CaCO3+2H+══Ca2++CO2↑+H2O。
问题引领
1.书写离子方程式时把CaCO3拆写成Ca2+和 正确吗 为什么
提示:不正确。原因是CaCO3难溶于水。
2.AgNO3溶液与Cu反应的离子方程式写成Cu+Ag+══Ag+Cu2+正确吗 为什么
提示:不正确。因为离子方程式两边电荷不守恒。
探究任务1 离子方程式的书写方法
归纳提升
离子方程式的书写与正误判断
1.离子反应的实质。
通过离子反应使溶液中某些离子浓度减小。
2.常见离子反应的类型。
(1)复分解反应型。
(2)氧化还原反应型。
①如Zn+2H+══Zn2++H2↑,还原性Zn>H2;
②如Cl2+2Br-══2Cl-+Br2,氧化性Cl2>Br2。
3.书写离子方程式的拆分原则。
(1)能拆写成离子的物质。
(2)不能拆写成离子的物质。
(3)微溶物作为反应物,若是澄清溶液写离子符号,若是悬浊液写化学式。微溶物作为生成物,一般写化学式(标“↓”),如石灰水和石灰乳:石灰水写成离子形式,而石灰乳则写化学式。
(4)氨水作反应物可写作NH3·H2O;作生成物,若有加热条件或浓度很大时,可写作NH3(标“↑”)。
(5)固体之间反应不能写离子方程式,如氯化铵与氢氧化钙的反应。
(6)多元弱酸的酸式酸根离子,在离子方程式中不能拆开写,如NaHCO3与盐酸反应的离子方程式为 +H+══ CO2↑+H2O。
4.判断离子方程式正误的方法。
典型例题
【例题1】 能正确表达下列反应的离子方程式为( )。
D
解析:醋酸是弱酸不能拆写成离子,正确的离子方程式为2CH3COOH+CaCO3══2CH3COO-+Ca2++CO2↑+H2O,A项错误;离子所带电荷不守恒,B项错误;盐酸是完全电离的,MnO2+4H++2Cl- Mn2++Cl2↑+2H2O,C项错误;Cl2与OH-发生歧化反应,D项正确。
【例题2】 离子方程式H++OH-══H2O所表示的反应是
( )。
A.所有酸与碱之间的中和反应
B.所有强酸与强碱之间的中和反应
C.所有可溶性酸与可溶性碱的反应
D.强酸与强碱生成可溶性盐和水的反应
答案:D
解析:离子方程式H++OH-══H2O,反应物用H+、OH-表示,说明反应物为强酸和强碱,离子方程式中生成物只有H2O,说明生成的盐为可溶性盐,D项正确。
【变式训练1】 写出下列反应的离子方程式。
(1)氢氧化钠溶液与稀硫酸反应: ;
(2)氯化钠溶液与硝酸银溶液反应: ;
(3)氢氧化钡溶液与稀硫酸反应: ;
(4)铁与硫酸铜溶液反应: ;
(5)碳酸钠溶液与氢氧化钙溶液反应: ;
(6)铁与稀盐酸反应: ;
(7)碳酸钠溶液与稀硫酸反应: 。
【变式训练2】 (双选)能正确表示下列化学反应的离子方程式的是( )。
A.澄清的石灰水与盐酸的反应OH-+H+══H2O
B.氧化镁与稀硝酸反应O2-+2H+══H2O
D.碳酸钙溶于稀盐酸中CaCO3+2H+══H2O+CO2↑+Ca2+
答案:AD
解析:单质、氧化物、难溶于水的物质、难电离的物质不能写成离子形式,B项错误;C项还生成氢氧化镁沉淀。
问题引领
1.某河道两旁有甲、乙两厂,它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、 六种离子。甲厂的废水呈碱性,那么甲、乙两厂废水中各含哪三种离子
探究任务2 判断离子能否大量共存
提示:甲厂的废水呈碱性,即含OH-,而Ag+、Fe3+与OH-不能共存,故Ag+、Fe3+只能在乙厂废水中。由于Cl-与Ag+不共存,故Cl-在甲厂中,依电荷守恒,甲厂废水中不能只含阴离子,还必须含有阳离子,这种阳离子只能为K+(因为阳离子中只剩K+可供选择)。所以甲厂废水中含OH-、Cl-、K+,乙厂废水中含Ag+、Fe3+、 。
2.离子间不共存(即发生反应)的条件有哪些
提示:离子间反应产生难溶的物质(沉淀)、难电离的物质(如H2O)或挥发性的物质(气体),则不共存。
归纳提升
离子共存
判断离子能否大量共存实际上是看离子之间能否反应,若反应,则不能大量共存;若不反应,则能大量共存。
1.离子不能大量共存的三种情况。
(1)生成难溶性或微溶性物质的离子不能大量共存。
②生成难溶性的碱:如OH-与Cu2+、Fe2+、Fe3+、Mg2+等。
(3)生成水或其他难电离物质的离子不能大量共存:如H+与OH-、CH3COO-,OH-与 等。
2.注意事项——“隐含条件”。
(1)“无色透明”溶液中不存在有色离子,如:
Cu2+ Fe3+ Fe2+
| | | |
蓝色 棕黄色 浅绿色 紫红色
(2)酸性溶液中不能大量存在与H+反应的离子。
“酸性”溶液的不同描述:①酸性溶液。②常温下pH<7的溶液。③使石蕊试液变红色的溶液。
(3)碱性溶液中不能大量存在与OH-反应的离子。
“碱性”溶液的不同描述:①碱性溶液。②常温下pH>7的溶液。③使石蕊试液变蓝的溶液。
3.解答离子共存题的常见思路。
(1)看是否有隐含限制条件,如碱性、酸性、无色等。这些问题较易忽视,故放在第一步。
(2)看能否发生复分解反应。可分三步进行:
①查H+,主要看是否有弱酸根离子和酸式酸根离子等;
②查OH-,主要看是否有 、酸式酸根离子和金属离子等;
③查金属离子,主要看是否与酸根产生难溶性盐(包括微溶性盐)。
典型例题
【例题3】 在强酸性溶液中能大量共存并且溶液为无色透明的离子组是( )。
答案:B
【例题4】 某电解质溶液中,可能大量存在有Ag+、H+、Cu2+、 、OH-、Cl-,当向该溶液中加入酚酞试剂,溶液变红。则:
该溶液中一定能大量存在的离子是 ;一定不能大量存在的离子是 ;还需要进一步确认的离子是 。
解析:加入酚酞试剂变红,说明该溶液呈碱性,所以OH-一定存在,OH-存在则一定不能大量存在Ag+、H+、Cu2+三种离子,因为这三种离子与OH-能发生反应。只根据题给条件无法确定 和Cl-是否存在,所以需要进一步确认。
【变式训练3】 (双选)在下列各溶液中,离子一定能大量共存的是( )。
答案:CD
【变式训练4】 下列各组离子能在溶液中大量共存的是
( )。
答案:D
